既述のページへのリンク: ①炭素という名称の起源 ②炭素の認識:木炭は何故炭素なのか ③元素としての炭素の性質 ④炭素の誕生 ⑤宇宙の炭素 ⑥原始太陽系の炭素 ⑦炭素と有機物 ⑧炭素原子とメタン分子 ⑨炭化水素分子内での炭素の結合 ➉分子内での炭素と酸素の共有結合 ⑪窒素の形成と水素と炭素と酸素 ⑫窒素を含んだ有機化合物と無機化合物 ⑬星(恒星)と炭素 ⑭炭化水素分子内での炭素―炭素結合と電子 ⑮複雑な構造の炭化水素、⑯複素環式化合物、⑰炭素化合物の多様性、⑱炭素原子と星間分子
------------------ーーーーーーーーーーー
現代では炭素を含んだ全ての化合物が有機化学の対象となっている。その中には従来から無機化合物とされている化合物も含まれている。そして、炭素を含んだ化合物の数は膨大で、原理的には無限大と言ってよい。これは、炭素と言う元素が持つ独特の性質による。形成初期の地球の環境が、この炭素の性質に作用した結果として地球に生物が誕生したと考えられる。
原子は、陽子と中性子からなる原子核とその周囲に存在する電子(陰電子)によって形成されている。この形成要素は、中性子を持たない水素(1H)を除いて、全ての元素について共通していて炭素も例外ではない。陽子の数は名称の異なる全ての元素で異なっている。陽子の数が同じだが中性子の数が異なる元素は、同じ元素名を持ち同位体と呼ばれる。通常の原子では、電子の数と陽子の数は同じで、原子としての電荷は中性である。
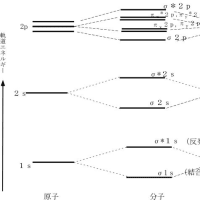
原子核は、原子の中心点とみなされる位置に存在する。その点の周囲の空間を電子が広く飛び回っている。飛び回る電子の挙動は、古典的力学では、原子核を中心として一定の軌道の上を運動する点として表現された。その後、原子核の周りの電子は、量子力学による波動関数で、三次元的な確率論的濃淡を持った原子核を取り巻く雲のように表現された。以降、その雲を電子軌道として表現している。一つの原子核を取り巻く電子の軌道には多くの種類が存在し、電子殻と呼ばれ、エネルギー順位の低い方からアルファベット順にK殻、L殻、M殻、N殻、・・・と名付けられている。さらに、電子殻には、小軌道(副電子穀又は亜穀)呼ばれる軌道が存在し、エネルギー順位の低い方からs軌道、p軌道、d起動、f軌道と名付けられている。ただし、それぞれの電子穀に存在する小軌道は限定されている。
ちなみに、周期律表の第一周期の水素とヘリウムはK殻にs軌道(1sと略称:以後K核=1、L殻=2、M穀=3、・・・と表記)のみを持ち、周期律表の第二周期に属するリチウムからネオンまでの元素は1s軌道の他に2s軌道と2p軌道を持つ。ネオンと同じ第二周期に属する炭素原子もこの軌道を持つ。小軌道の形は、s軌道は球状で表され中心に原子核が存在する。p軌道は図に示すような長めの8の字(瓢箪)型をしていて、 くびれたところに原子核が存在する。d軌道は2個のp軌道が直交したような形をしていて中心に原子核が存在する。

電子はエネルギー順位の低い軌道から原子番号の順に1個ずつ充填されるが、それぞれの小軌道に収まる電子の数は限定されており、s軌道に2個、p軌道に6個、d軌道に10個、f軌道に14個までである。従って、元素の周期律表の第一周期で1番元素である水素は1sに1個、第一周期で2番元素であるヘリウムは1sに2個、第二周期で3番元素であるリチウムは、1sに2個と2sに1個で合計3個の電子が存在し、第二周期で6番元素である炭素は1sに2個と2sに2個、さらに2pに2個で合わせて6個の電子が存在する。ただし、これらの電子軌道は原子が単独で存在する場合のものであって、地球の通常の環境では、希ガス(貴ガス)元素を除いて、全ての原子が何らかの形で複合体(分子)を形成している。その場合には、それぞれの原子の原子軌道は大幅に変形して分子軌道を形成する。
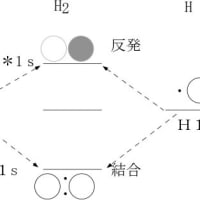
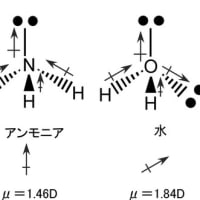
原子の一番外側の電子殻に存在する電子を最外殻電子と呼び、原子が結合して分子を形成する際に主要な働きをする。ちなみに、水素では1個の電子(1s)、リチウムでも1個の電子(2s)、炭素では4個の電子(2sに2個と2pに2個)がこれに相当する。ただし、希(貴)ガス元素の最外殻電子は結合にほとんど関与しない。希(貴)ガス元素が安定なのは原子の最外殻軌道が電子で満たされているためである。希(貴)ガス元素以外の元素は、他の原子と結合して分子を形成することによって、原子としての最外郭電子を相互に授受や共有を行い、分子として最外殻電子の数を希(貴)ガス元素と同じようにして安定な状態になろうとする。例えば、水素原子は外郭電子として1s軌道に1個の電子しか持たないが、お互いが結合して水素分子(H2)形成することによって、新しい電子軌道を作り、その軌道でお互いの電子を共有することによって、最外殻電子の数をヘリウムと同じ2個にすることによって安定化している。
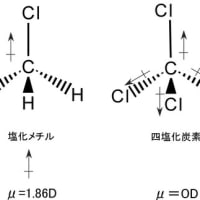
炭素原子は4個の最外郭電子を持っている。従って、炭素原子が何らかの分子を形成することによって安定化しようとすると、同じ第2周期の希(貴)ガス元素であるネオンと同じ8個の電子を持つことが必要となる。そのためには、炭素としての本来の外郭電子にさらに4個の外殻電子を含んだ軌道を作る必要がある。この時、分子を形成する相手の原子も安定化の条件を満たしている必要がある。1個の炭素と4個の水素から形成されているメタン(CH4)を例にとると、4個の最外殻電子を持った1個の炭素原子が1個の最外殻電子を持った4個の水素原子と電子を共有することによりネオンと同じ数の8個の外郭電子を持ち、それぞれの1個の外殻電子を持った水素は炭素の外郭電子のうちの1つを共有することとによってヘリウムと同じ2個の外郭電子を持つことになる。この時形成される分子の電子の軌道を混成軌道と呼ぶ。
有機化学の分野では、分子の構造や反応を理解し易くするため、元素記号の周りに最外殻電子を点で表すことが多い。例えば、水素の場合、元素記号(H)の横に点を1個配置し、炭素の場合元素記号(C)の上下左右に1点ずつ配置する。原子間に共有結合が形成されると、1つの共有結合につき1本の直線(又は2つの点)で表すことが多い。例えば、2個の水素原子がお互いの電子を共有して1個の水素分子が形成される時(2H→H2)には、以下のように表される。

1個の炭素原子と4個の水素原子からメタンが形成される時(C + 4H → CH4)には、下の反応式のように表される。メタンは3次元の構造を持っているが、通常は、反応が理解し易いように、ここに示されたように、平面的に表示する。

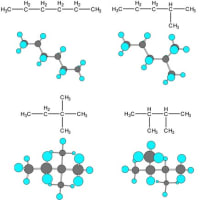
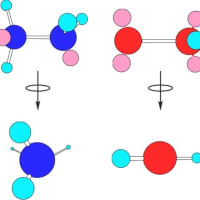
3次元的なイメージを示すのには原子を球で示しその間の結合をを棒で示したボール・スティックモデルや分子軌道を示したフィリングモデルと呼ばれるものも使われる。メタンの場合の分子軌道はsp3混成軌道と呼ばれ、正四面体の中心に炭素原子が存在し、各頂点に水素原子が存在している形となる。これを立体構造と呼ぶ。