既述のページへのリンク: ①炭素という名称の起源 ②炭素の認識:木炭は何故炭素なのか ③元素としての炭素の性質 ④炭素の誕生 ⑤宇宙の炭素 ⑥原始太陽系の炭素 ⑦炭素と有機物 ⑧炭素原子とメタン分子 ⑨炭化水素分子内での炭素の結合 ➉分子内での炭素と酸素の共有結合 ⑪窒素の形成と水素と炭素と酸素 ⑫窒素を含んだ有機化合物と無機化合物 ⑬星(恒星)と炭素 ⑭炭化水素分子内での炭素―炭素結合と電子 ⑮複雑な構造の炭化水素、⑯複素環式化合物、⑰炭素化合物の多様性、炭素原子と星間分子
------------------ーーーーーーーーーーー
宇宙における元素合成でトリプルアルファ反応によって早い時期に合成される炭素の原子核は水素、ヘリウムに次いで合成される宇宙に蓄積され得る安定な原子核である。しかし、観測される宇宙における炭素の存在量は、炭素の核合成に際して付随的に炭素から合成される酸素より少ない。それは炭素の原子が酸素より低い温度で他の元素の合成に消費されることが一因となっている可能性がある。
その他に炭素が同じようなエネルギー環境で様々な分子を形成し得るので、宇宙に存在する個々の分子の存在量が少ないため観測による検出が困難なことも起因しているかもしれない。 第18族元素(稀元素)を除くと,原子が単体で存在するのは恒星形成の場のような極端に高温・高圧の場や宇宙空間の極端に原子の密度が低く温度の低い場所である。高温の場では原子間の結合はすぐ切れてしまい、低濃度・低温度の場では原子間の反発を乗り越えて結合を作るだけ原子同士が接近出来ず分子は形成されない。星の内部で原子核ができた後に外周まで出てきて温度が下がると、原子核は電子と結合して原子となる。この時結合する電子の数と結合状態は元素の種類によるが、原子核の周りに分布する電子の軌道(原子軌道)にエネルギーの低い順に配置されることになる。原子軌道は原子核に近くエネルギーの低い順に1s、2s、2p、3s、3p、3d、4S、・・・・と呼ばれる。炭素の場合は、6個の陽子を持った原子核のまわりに6個の電子が存在し、一つ有る1s軌道に2個、一つ有る2s軌道に2個、三つ有る2p軌道のうち二つの2p軌道に1個ずつ配置される。水素の場合は1s軌道に1個の電子のみ配置される。1つの原子軌道にはスピンの異なる電子を1個ずつ合計2個しか収容出来ない。
原子が出来てからさらに低温の環境で、希元素以外の原子が相互の反発を乗り越え、他の原子に原子軌道が重なるまで接近すると相互に結合して分子を作ることになる。この時、新たに分子軌道と呼ぶ電子の軌道が作られる。その軌道に存在する電子が双方の原子を結び付ける力となる。分子が形成される時には原子どうしが反発を超えて接近するエネルギーが必要であるが、分子が形成される時にはエネルギーが放出されて安定化するので、この放出されたエネルギーが加わっても出来た分子が壊れない程度に周辺のエネルギー環境が冷えている必要がある。この環境は、原子核が形成される温度よりはるかに低いが、ビッグバンから星の形成を繰り返しながら現在の宇宙が出来上がる過程ではこの環境を経過するものと考えられる。問題は形成れた分子が置かれている環境の変化である。
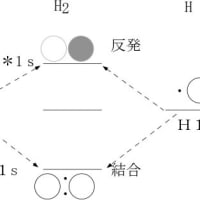
宇宙で最初に作られた分子であり、最も簡単な分子である水素の場合を例に挙げるとorbital diagram、(MOダイアグラム、分子軌道図)で示すと、下図のようになる。
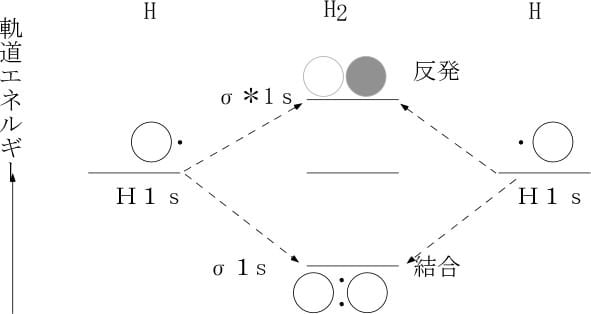
水素原子の場合1s軌道に1個の電子しか無く、もう1個の電子を結合合軌道(σ1s)に入れて安定化することが可能である。核間を結ぶ線に対して円筒対称の電子分布を持つ結合をσ(シグマ)結合と呼び、同じ位相を持つ2個の電子が作る軌道を結合性軌道、異なった位相を持つ2個の電子が作る軌道を反結合性軌道(σ*1s)と呼ぶ。水素原子と違い炭素原子の場合、空の2p軌道に1個の電子を受け入れて不対電子を増やす余裕があるので、2s軌道の電子を1個空の2p軌道に移し(昇位させ)、分子軌道(混成軌道)が作られる。s軌道とp軌道が混生する時の電子軌道の概略の変化は下図のようであり、エネルギーの変化もその下の図に示した。S軌道にP軌道が混成すると方向性が増す。
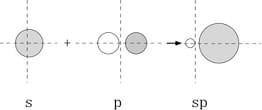
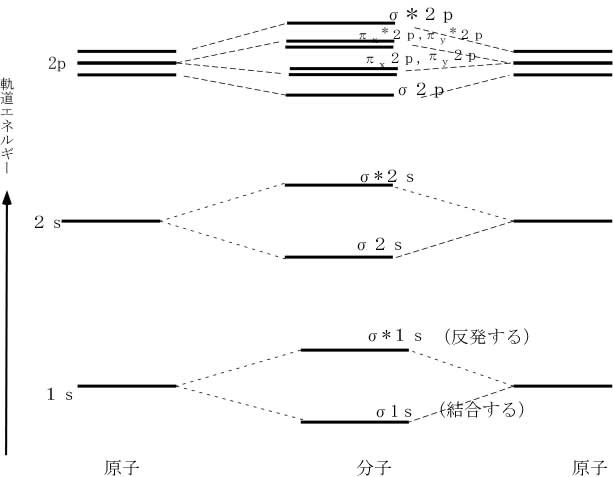
p軌道には2個のプローブがあって互いにその位相は逆である。したがって、p軌道とs軌道を組合わせると(sp混成)、核の一方の側では加算、逆側では引き算の形となる。炭素原子の場合、一つ在る1s軌道に2個、一つ在る2s軌道に2個、三つ在る2p軌道のうち二つの2p軌道に1個ずつの電子が存在する。一つの2p軌道は空である。このままでは共有結合の形成に関与し得る電子(不対電子)は2p軌道の2個のみとなる(この状態で形成されたと思われる分子が「二原子炭素」として彗星や恒星大気に存在が知られている)が、分子軌道を形成する時2s軌道の電子を1個の空の2p軌道に移す(昇位と言う)ことにより4個の電子が結合に関与することが可能な不対電子となる。s軌道とp軌道の組み合わせ方によりsp、sp2、sp3の3つの混成軌道を作り得る。結果として2s軌道に残った1個の電子も不対電子として共有結合の形成に関与することになり、sp混成では混成軌道にある2個の電子(2s由来が1個、2p由来が1個)がσ結合、残りの2つの2p軌道にある電子が2本のπ結合の形成に関関与することになる。sp2の場合には混成軌道にある3個の電子がσ結合、残りの一つの2p軌道にある1個の電子がπ結合の形成に関与する。sp3混成の場合は4個在る全ての外郭電子がσ結合の形成に関与する。
原子から分子が形成される時にはエネルギーを放出して、個々の原子が独立して存在している状態の時よりエネルギーの低い(安定な)状態になる。分子内の結合を切って、結合ができる前の個々のパーツ(2原子分子の場合は2個の原子)に分解するにはその逆で、放出されたのと同じ量のエネルギーを加える必要がある。それぞれの原子が1個ずつ電子を出し合って1つの共有結合を作る場合、あるいは一本の共有結合を切断してできたそれぞれの部分に1個ずつ電子を残す場合(結果としてラジカルになる)、このエネルギーは均一結合解離エネルギー(D)と呼ばれ、多くの分子について測定されており、2原子分子の例を表18.1に示す。
表18.1
|
均一結合解離エネルギー A-B → A・ + B・ ΔH=D(A-B)kJ/mol |
||||
|
H-H |
435 |
|
|
|
|
F-F |
159 |
|
H―F |
569 |
|
Cl-Cl |
243 |
|
H―Cl |
431 |
|
Br-Br |
193 |
|
H―Br |
368 |
|
I-I |
151 |
|
H-I |
297 |
表18.1の場合、対象としている原子は外郭軌道に1個だけ結合に関与する不対電子を持ち、他の外郭原子軌道には2個ずつ電子が入っている(水素を除く)ので結合に関与しない。2個とも同じハロゲン原子を含む同核2原子分子の結合力は元素によってかなり差がある。片方のハロゲン原子が水素と置き換わった場合も同様である。
表18.1の分子の結合の片方が炭素に置き換わった場合の例を表18.2に示した。
表18.2
|
均一結合解離エネルギー A-B → A・ + B・ ΔH=D(A-B)kJ/mol |
||||
|
|
|
CH3-H 435 |
|
|
|
CH3-F |
452 |
|
C2H5―H |
410 |
|
CH3-Cl |
352 |
|
n-C3H7-H |
410 |
|
CH3-Br |
293 |
|
iso-C3H7-H |
397 |
|
CH3-I |
234 |
|
tert-C4H9-H |
385 |
|
|
|
|
H2C=CH-H |
452 |
|
|
|
|
C6H5-H |
460 |
炭素部分がメチル基で相手が表18.1と同じハロゲン原子である場合は似た結合力の変化の傾向にあるが、メチル基の部分が異なった構造を持った炭化水素と置き換わってもメチル基の場合とC-Hの結合力はあまり変わらず結構強い結合解離エネルギーを保持する。これと同じ傾向が表18.3に示したC-Cの結合やC-Clの結合にも見られる。
表18.3
|
均一結合解離エネルギー A-B → A・ + B・ ΔH=D(A-B)kJ/mol |
||||
|
CH3-CH3 |
368 |
|
CH3-Cl |
352 |
|
C2H5―CH3 |
365 |
|
C2H5―Cl |
339 |
|
n-C3H7-CH3 |
356 |
|
n-C3H7-Cl |
343 |
|
iso-C3H7-CH3 |
352 |
|
iso-C3H7-Cl |
339 |
|
tert-C4H9-CH3 |
335 |
|
tert-C4H9-Cl |
331 |
|
H2C=CH-CH3 |
385 |
|
H2CCH-Cl |
352 |
|
C6H5-CH3 |
389 |
|
C6H5-Cl |
360 |
これが炭素を含んだ分子の種類が非常に多く存在する理由の一つである。
ここで混乱してはならないのが「分解エネルギー(E)」との違いである。メタンを例に挙げるとメタンの分解エネルギーは下のように表されるが、これはメタンのすべてのC-H結合を切った場合の平均値であり、1本ずつ切ってゆくと表18.4のようになり、それぞれのC-H結合が固有の値を示す。
|
CH4 |
→ |
C + 4・H |
Δ = |
1661 |
kJ/mol |
|
|
|
|
E(C-H) = |
414 |
kJ/mol |
表18.4
|
CH4 → |
CH3 + H・ |
|
D(CH3ーH) |
435 |
kJ/mol |
|
CH3 → |
CH2+ H・ |
|
D(CH2―H) |
443 |
kJ/mol |
|
CH2 → |
CH + H・ |
|
D(CH―H) |
443 |
kJ/mol |
|
CH → |
C + H・ |
|
D(C―H) |
339 |
kJ/mol |
「均一結合解離エネルギー」という理由は、共有結合を切断する場合に、生成した部分の片方に結合に関与離していた全ての電子を置く場合(結果としてイオンが出来る)に必要なエネルギーを「不均一結合解離エネルギー」と称するからである。例を表18.5に示す。
表18.5
|
A:B ➡ A+ + :B- ΔH=不均一結合解離エネルギー D(A+-B-)(kJ/mol) |
||||
|
H-H |
1678 |
|
CH3-H |
1310 |
|
H-F |
1548 |
|
CH3-F |
1071 |
|
H-Cl |
1397 |
|
CH3-Cl |
950 |
|
H-Br |
1356 |
|
CH3-Br |
916 |
|
H-I |
1318 |
|
CH3-I |
887 |
|
H-OH |
1632 |
|
CH3-OH |
1146 |
原子から分子が形成される場合、原子どうしが衝突する必要があり、その為には分子を形成する原子がある程度の濃度で存在する必要がある。第一世代の星形成の場では水素、第二世代以降の星形成の場では星の大きさにより様々な元素が衝突する可能性がある。原子の合成を終えた直後の星形成の場では分子を形成するための原子の濃度は十分にあるがエネルギーが高すぎて原子間の結合ができないと考えられる。星の外周では光の放出等でエネルギーが下がっているが、分子が形成されるエネルギーは残っている可能性があり、分子の形成とともにエネルギーがさらに下がる。外部から解離に必要なエネルギーが補給されない限り分子が維持されることになる。このような原子濃度とエネルギーが、分子形成に適した場所が宇宙に有る可能性は十分考えられる。褐色矮星や惑星の形成環境などもその候補である。
暗黒星雲に存在する分子は、その環境に相互反発乗り越えて分子を形成できるほどのエネルギー(熱エネルギー)が無いので、衝突した時に相互に反発しない「イオン分子反応」が提案されている
星間分子を作る材料として、炭素は早い時点から存在し、他の元素(水素とヘリウムを除く)よりも圧倒的に濃度が高い場所が多い。従って、炭素原子が分子を形成するチャンスは他の原子より大きい。その結果、二原子分子や三原子分子には炭素を含まない分子も多種類見つかっているが、四原子以上の星間分子として確認されている化合物(アンモニアとシランを除く)には殆ど全て炭素原子が含まれている。これらの分子に含まれている水素原子と炭素原子以外の原子は炭素の原子核からアルファ反応で直接導かれる酸素や、CNOサイクルで炭素の原子核を触媒として、水素から導かれる窒素で、炭素原子と反応して分子を形成する機会は十分あったと考えられる。それらの分子のなかには二次的な反応で形成されたと思われる分子も有り、一旦出来た分子が宇宙線によってラジカルやイオンになって存在する可能性は有る。










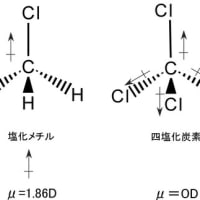
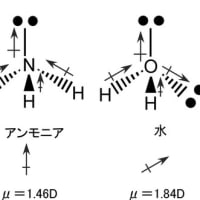
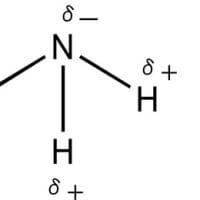






※コメント投稿者のブログIDはブログ作成者のみに通知されます