既述のページへのリンク: ①炭素という名称の起源 ②炭素の認識:木炭は何故炭素なのか ③元素としての炭素の性質 ④炭素の誕生 ⑤宇宙の炭素 ⑥原始太陽系の炭素 ⑦炭素と有機物 ⑧炭素原子とメタン分子 ⑨炭化水素分子内での炭素の結合 ➉分子内での炭素と酸素の共有結合 ⑪窒素の形成と水素と炭素と酸素 ⑫窒素を含んだ有機化合物と無機化合物 ⑬星(恒星)と炭素 ⑭炭化水素分子内での炭素―炭素結合と電子 ⑮複雑な構造の炭化水素、⑯複素環式化合物、⑰炭素化合物の多様性、⑱炭素原子と星間分子
------------------ーーーーーーーーーーー
炭素は、宇宙における元素合成の過程で、太陽の50%程度以上の大きさの星の内部で、トリプルアルファ反応と呼ばれる3個のヘリウム原子の核融合反応で作られる。宇宙における元素合成の過程で、炭素は、安定元素としては、水素とヘリウムに次いで3番目に宇宙に蓄積された元素である。従って、宇宙の物質形成における初期の冷却過程おいて、分子形成が可能な条件下で、水素分子が濃厚に存在する空間に炭素原子が放出されたことがあったと考えられる。炭素を含む全ての化合物が有機化学の対象とされている現在、生命発生の遥か以前、宇宙の元素合成の早い時期から有機化学の対象としての分子形成が行われていたと推定される。
ある程度冷却された水素分子が濃厚に存在する環境に炭素原子が放出された場合には、炭素が水素と結合し、その生成物が水素とさらに結合を繰り返すことによって以下に示されるように4段階の反応でメタンが形成されると考えられる。この中でCH3以外の分子は星間分子として報告されている。
C + H2 → CH + H , CH + H → CH2, CH2 + H2 → CH3 + H, CH3 + H → CH4
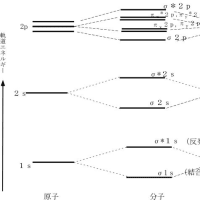
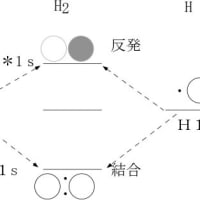
ある原子が他の原子と結合して分子を作る場合には、結合に関与する原子の最外殻電子の軌道(原子軌道)が変化して混成軌道となる。単独の炭素原子の最外殻には、一つの 2s 軌道と三つの 2p 軌道が存在し、2s 軌道に2個と二つの 2p 軌道に1個ずつ計4個の電子が存在する。メタンの分子が形成される場合には、1個の s 軌道と3個の p 軌道が全て混合されて、sp3と呼ばれる混成軌道が形成される。この軌道は3次元的に分布しており、炭素を中心として正四面体の頂点に向かって電子が分布する。メタン分子の炭素原子と水素原子はお互いの最外殻電子を1個ずつ共有することで共有結合と呼ばれる結合を形成していて、それぞれの電子の軌道の軸は結合軸の方向に向いている。このような結合はσ(シグマ)結合と呼ばれる。またこの結合は分子構造的には1本の線で表現されることから単結合とも呼ばれる。

2個の炭素原子と複数個の水素から成る分子には、エタン(C2H6)、エテン(C2H4)、エチン(C2H2)がある。エテンとエチンの名称は国際純正・応用化学連合(IUPAC)の規則による名称であるが、一般的には慣用名のエチレンとアセチレンが圧倒的に多く使用されるので、ここではエチレンとアセチレンを使用する。
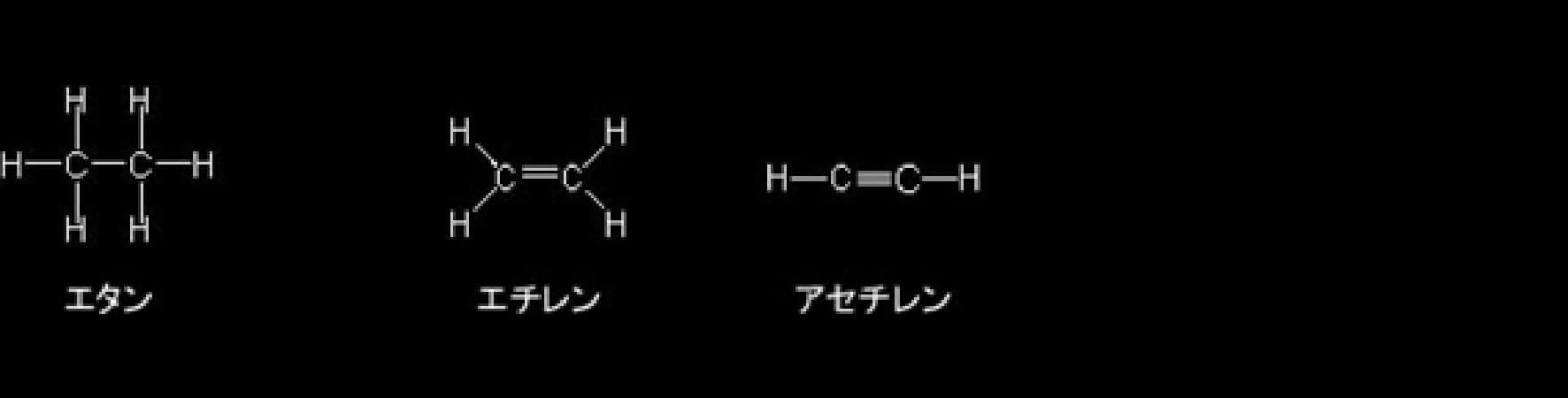
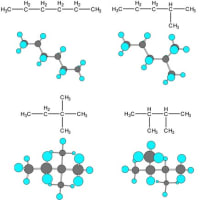
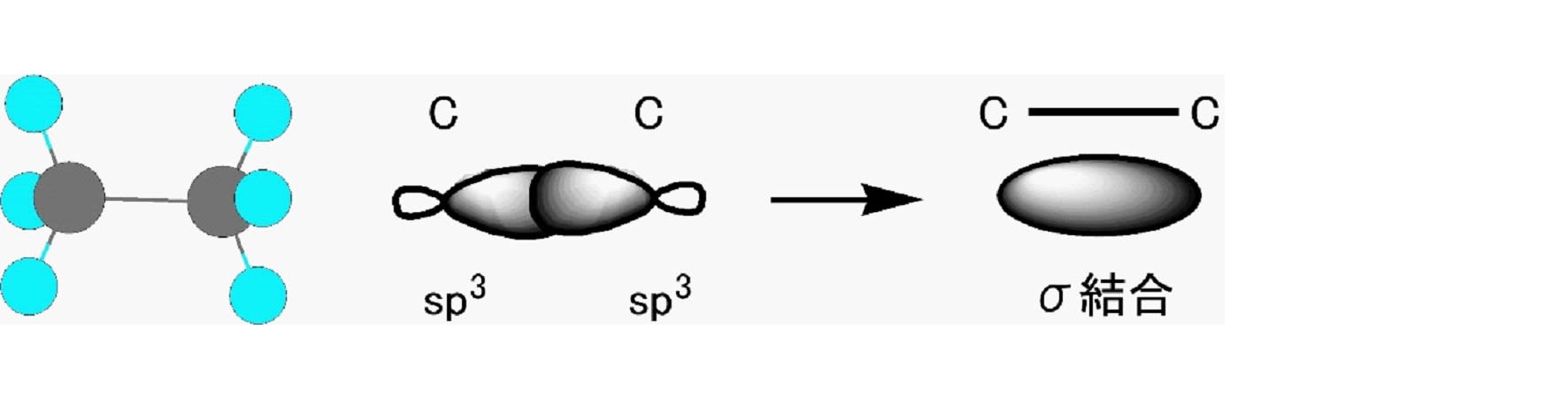
2個の炭素と6個の水素から成る分子であるエタン(C2H6)の分子構造は下図のように表現され、どちらの炭素原子も結合に使われている電子の軌道はsp3混成軌道である。この場合には炭素原子と水素原子はメタンと同じくσ結合で結ばれ、さらに炭素どうしもσ結合で結ばれている。この炭素と炭素の間の結合も、お互いに1個ずつの電子を出し合って共有し、1本の直線で表現されるので単結合で結ばれていることになる。
エチレン(エテン:C2H4)の構造式においては炭素と炭素は2本の共有結合で結ばれているので2本の直線で結んで表現され、二重結合と呼ばれる。ただし、この2本の共有結合は互いに異なった性質を持っている。エチレンの分子内の炭素と炭素の結合に使われる電子の軌道の一つは sp2 と呼ばれる混成軌道で、もう一つは炭素原子本来の p 軌道である。炭素の sp2 混成軌道は炭素原子の一つの 2s 軌道と二つの 2p 軌道(一つの p 軌道は空)の混成によって形成され、合計3個の電子が存在する。軌道の軸は中心から平面的に3方向に等角度(120O)で分布している。残された一つの 2p 軌道はもとの形を保持し、sp2混成軌道が作る平面に直交する形で分布する。エチレンの炭素原子と炭素原子を結ぶ結合の一つは双方のs p2 軌道の電子を一つずつ共有することによって形成される共有結合で、σ結合である。もう一つの結合は、それぞれの炭素の p 軌道に1個ずつ存在する電子を共有することで作られる。この場合の結合は sp2 軌道面に直交して互いに平行に存在する p 軌道の電子分布の側面の重なり合いによって形成されるもので、π(パイ)結合という。従って、エチレンでは、炭素と炭素の間が1本のσ結合と1本のπ結合で二重に結ばれていることになる。炭素と各水素の間は、炭素の sp2 混成軌道の電子と水素の s 軌道の電子を共有することでσ結合で結ばれている。
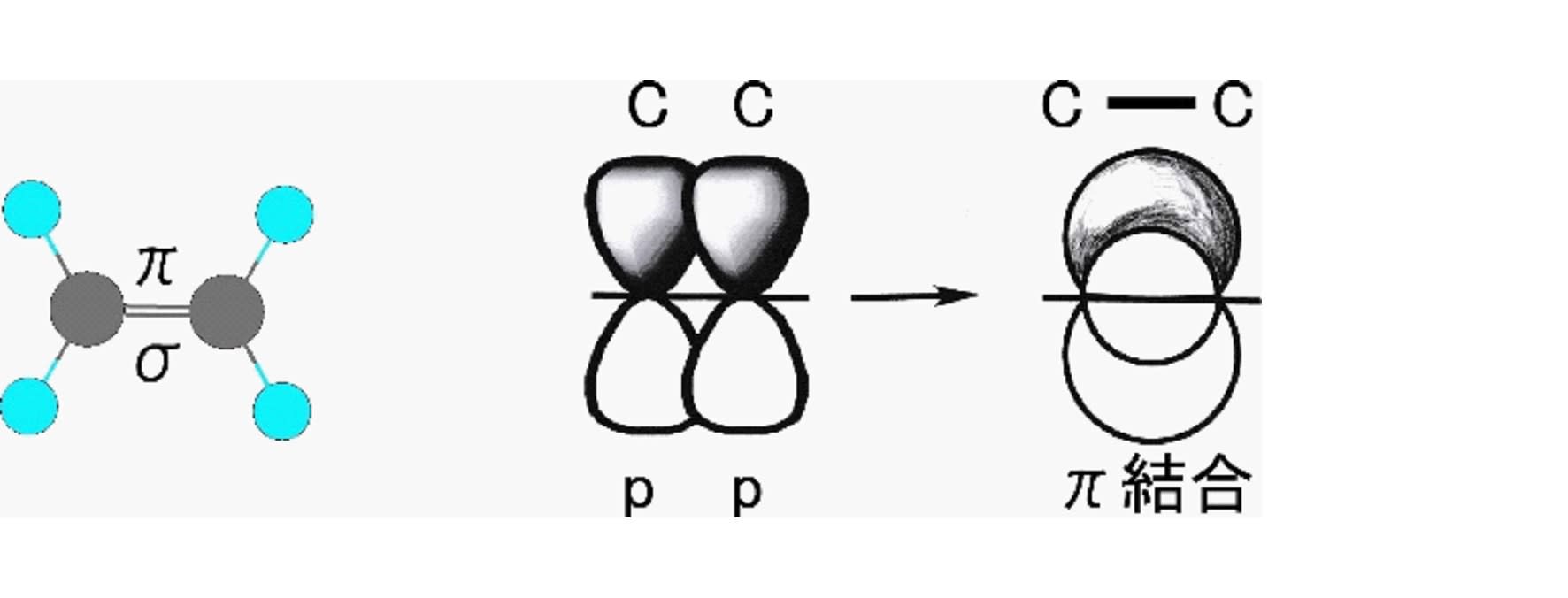
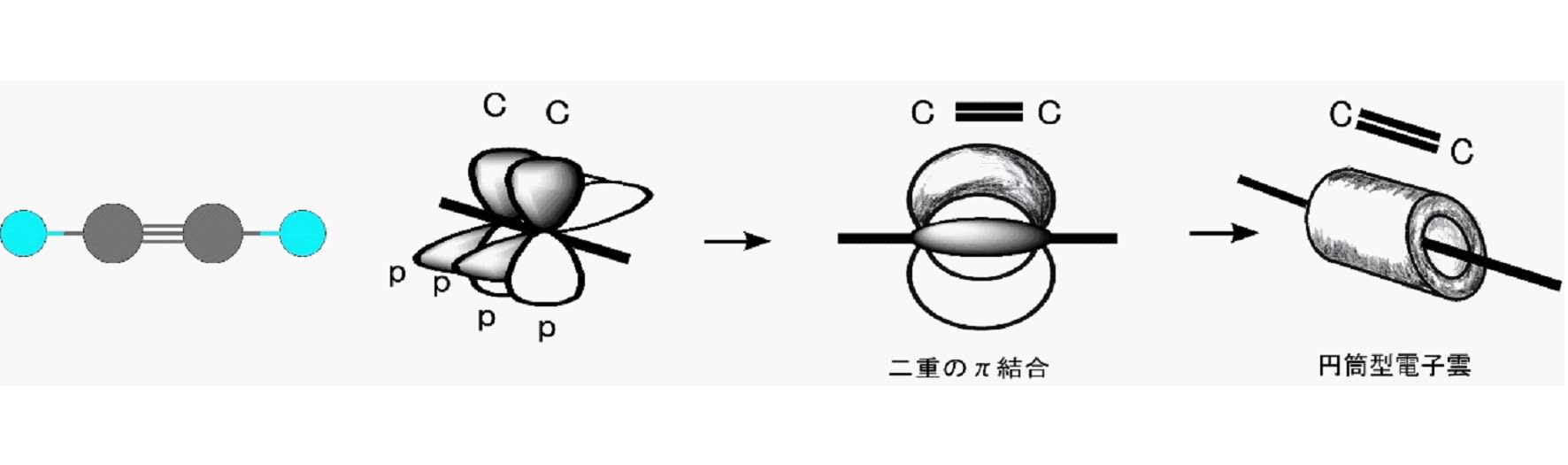
アセチレン(エチン)においては炭素と炭素は3本の共有結合で結ばれており、この結合を三重結合と呼ぶ。アセチレン分子の炭素の最外郭電子の軌道は、2s 軌道と一つの 2p 軌道が混合された sp と呼ばれる一つの混成軌道と二つの本来の2p軌道によって形成されている。電子は、一つの sp 混成軌道に2個と、二つのp軌道に1個ずつの計4個存在する。この場合の p 軌道の軸はお互いに直交するとともに、sp 軌道の軸とも直交して分布する。分子内の炭素と炭素の間は、sp 軌道にある電子を1個ずつ共有する一つのσ結合と p 軌道に存在する電子を1個ずつ共有する二つのπ結合から成り立っている。但し、この2個のπ結合の4個の電子は混合されて、結合方向に向いた一つの円筒状の軌道に分布する。
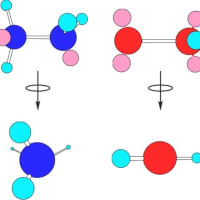
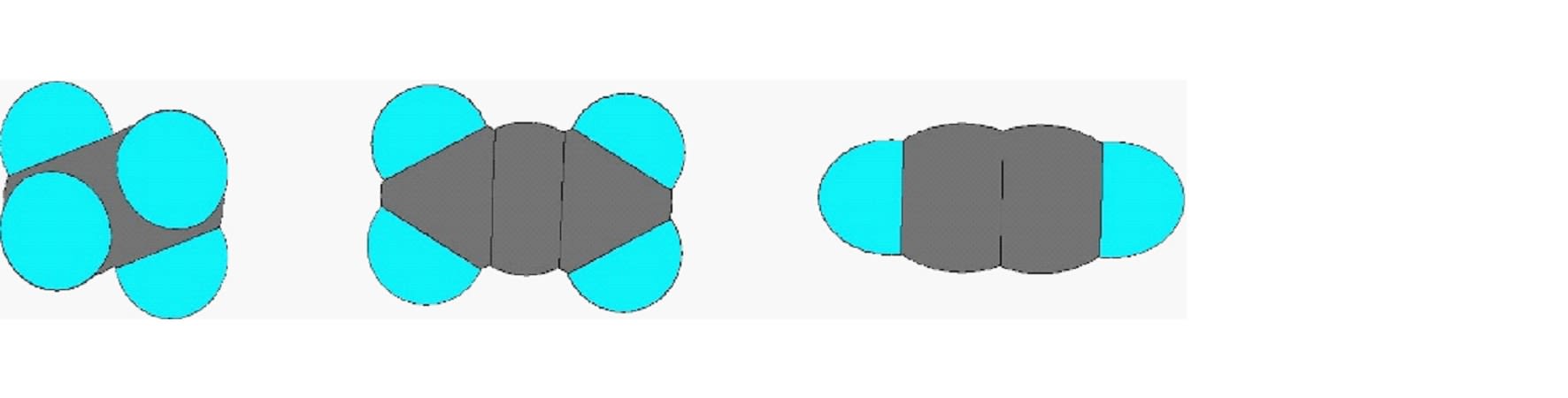
エタンとエチレンとアセチレンの3つの化合物をスペースフィリングモデルで示すと以下のようになり、水素との結合を含めた結合軸は、エタンは3次元的、エチレンは2次元的、アセチレンは1次元的である。
炭素と水素だけからできた分子を一括して炭化水素と呼ぶ。メタンやエタンのような単結合のみで形成されている炭化水素を飽和炭化水素と呼び、エチレンやアセチレンのような二重結合や三重結合を含むものを不飽和炭化水素と呼ぶ。化合物の名称は、国際純正・応用化学連合(IUPAC)で世界標準が示されており、炭化水素の場合は炭素の数と不飽和の結合の種類と数を基準として命名される。炭化水素全般については炭化水素を意味する語「アルク(alk)」に飽和化合物の場合には接尾辞「アン(ane)」、1個の二重結合が存在する場合には接尾辞「エン(ene)」、1個の三重結合が存在する場合には接尾辞「イン(yne)」を付けてそれぞれ「アルカン(alkane)」、「アルケン(alkene)」、「アルキン(alkyne)」と称する。
個々の炭化水素分子の名称も炭素の数と不飽和結合の種類と数によって表される。炭素の数は、エト(eth: 2個)、プロプ(prop: 3個)、ブト(but: 4個)、ペント(pent: 5個)、ヘキス(hex: 6個)等々で表される。例えば、炭素が3個の鎖状の飽和炭化水素は、3個の炭素を意味する「プロプ」に飽和を意味する「アン」を付けて「プロパン」と呼ぶ。炭素が3個の鎖状炭化水素で二重結合を含むものは「プロプ」に「エン」を付けて「プロペン」、三重結合を含むものは「プロプ」に「イン」を付けて「プロピン」と呼ぶ。プロペンは慣用名としての「プロピレン」が使われることが多い。なお、分子内の炭素のつながりには環状のものもあり、その場合には接頭語として環を意味する「シクロ」を付ける。例えば鎖状プロパンの両端が結ばれてできる三角形の炭化水素は「シクロプロパン」と呼ぶ。

これらを分子モデルで示すと下図のようになる。

星間分子には、最外殻電子が分子としての安定条件を満たしていない不安定な化合物も、希薄で低温な条件の環境では長期に存在する。炭化水素として報告されているものは、以下の通りである。ただし、分子式の中にCH3と記載されている場合は、分子内にメチル基が存在することを意味する。
2原子分子:CH、3原子分子:CH2、C2H、4原子分子:C2H2、l-C3H(鎖状)、c-C3H(環状)、5原子分子:CH4、l-C3H2、c-C3H2、C4H、6原子分子:C2H4、l-H2C4、C5H、7原子分子:CH3C2H、C6H、8原子分子:C6H2、C7H、9原子分子:CH3C4H、CH3CHCH2、C8H、10原子以上の分子:CH3C6H、C6H6、C10H8