
書きかけ → 送った(≧ω≦)b 今日12月20日締切!
人間への安全性を全てにおいて異なる動物で試したとしても、結果無意味であるどころか人間の健康や安全のための研究が遅れるばかりであり、税金と資金と労力と動物の命の無駄でしかないのである。
ビジネスのために盲目的に動物実験が有効であるとされている現状を懸念している良識ある医師や研究者も世界中に数多くいるが、利益追求の権力と政治の影に隠されているのである。
「医療機器の生物学的安全性評価の基本的考え方」に関する意見の募集について
http://search.e-gov.go.jp/servlet/Public?CLASSNAME=PCMMSTDETAIL&id=495110288&Mode=0
平成23年11月21日
厚生労働省医薬食品局
審査管理課医療機器審査管理室
薬事法に基づく医療機器の製造販売承認申請又は製造販売認証申請に際して添付すべき資料のうち、生物学的安全性に関する資料の取扱いについては、平成15年2月13日付け医薬審発第0213001号「医療用具の製造(輸入)承認申請に必要な生物学的安全性試験の基本的考え方について」及び平成15年3月19日付け事務連絡医療機器審査No.36「生物学的安全性試験の基本的考え方に関する参考資料について」に基づき取り扱ってきたところです。
今般、「医療機器の生物学的安全性評価の基本的考え方」について改正案を作成いたしましたので、広く国民の方々から御意見を募集いたします。
この案に関して御意見のある場合には、下記の方法に従い提出してください。
なお、提出していただいた御意見に対する個別の回答はいたしかねますので、その旨御了承願います。
平成23年12月20日(火)必着
入力フォームの件名欄には「医療機器の生物学的安全性評価の基本的考え方」と書いておく。
【意見送信フォーム】意見は3000文字以内で
https://www-secure.mhlw.go.jp/cgi-bin/getmail/publiccomment_input.cgi?mailto=ninshou201111@mhlw.go.jp
(なぜかこのURLはリンクができないのでコピーして貼り付けてね。フォームリンクは短縮したやつ。それかぴかりぃさんとこにリンクあるよ。)
御意見は日本語に限ります。
個人の場合は住所、氏名、年齢及び職業を書きましょう。
ファクシミリの場合
ファクシミリ番号:03-3597-0332
厚生労働省医薬食品局審査管理課医療機器審査管理室宛て
意見募集の案件
・医療機器の生物学的安全性評価の基本的考え方(案)
・[別添]医療機器の生物学的安全性試験法ガイダンス(案)
Testing 123
★〓★〓★〓
「さよなら、じっけんしつ」のぴかりぃさんから
http://goodbyelab.blog.so-net.ne.jp/2011-11-26
例)
「医療機器の生物学的安全性評価の基本的考え方」について
・試験法の選定にあたっては、動物福祉の観点からin vivo試験を最小限に減らすべき旨、明記してください。
・使用数の削減が図られている試験法があること等に注意を促し、動物福祉の観点から、試験計画の立案においては動物の使用数を必要最低限とするべきことを明記してください。
・「8.動物福祉」に環境省の実験動物の飼養保管基準と厚生労働省の動物実験指針の遵守についても追加するべきだと思います。
・医療機器の動物実験についても、代替法の研究開発、評価、およびガイダンスへの採用を促進する方向で予算配分や研究・評価体制の整備などを行ってください。
など。
「理由を付して」とあるので、ぜひ動物実験に対する気持ちなどをぜひ書いてください! よろしくお願いします。
★〓★〓★〓

【意見送信フォーム】 今日中に送るぞ!
https://www-secure.mhlw.go.jp/cgi-bin/getmail/publiccomment_input.cgi?mailto=ninshou201111@mhlw.go.jp
件名:「医療機器の生物学的安全性評価の基本的考え方」
本文:
厚生労働省が発行している臨床研究に関する倫理指針の前文に「最終的には臨床研究に依存せざるを得ない」と書いている。
その言葉どおり、人間に対する生物学的安全性を唯一評価できるのは人間に対する試験と観察であり、認可を得るためのデータ収集目的と言わざるを得ないヒト以外の動物を使った試験は国民を欺く行為であり、年齢、性別、体格、体質、生活習慣などの違う様々な人が対象になる医療機器や薬などの安全性を評価するための方法は即刻根本的に見直さなければならない。
一度認可を受けてしまえば、例えば風邪薬一つにしても、処方する患者の身長、体重、遺伝的疾患、その日の食事、生活習慣、アレルギーなど全く調べもせず、患者への簡単なアンケートだけを元に判断し、処方される。
すべての患者が自分の潜在的な病気やアレルギーなどを全て把握しているわけがないにも関わらず、薬を服用したあとの食事や生活態度などの追跡調査をするわけでもなく、患者に重大な異変が起こり自己申告があって初めて対処にあたるわけです。
人間は千差万別であるし、病気の症状も全く同じものなど一つとしてないのだが、処方した薬がその患者にどのような効果を表しているのかなどは、認可を得て広く国民に服用させていても常に調査研究の対象でなければならないはずである。
医療機器の生物学的安全性も同様に、例えば乳がん検診のマンモグラフィーを受ける個々の女性が放射線に対してどのような異変が起きる可能性があるのか、人工的に作られた放射線を浴びた後何年、何十年と経過し次世代へも影響が起きないのか、個別に詳しく調査しておらず、医薬品や医療機器を普及させるためにのみ安全性の評価が求められており、実際ガンや心臓病や脳血管疾患などを患う患者は増加の一方であり、病気の予防のための研究や改善の普及には資金や労力をかけず、病気の治療をすれば利益につながる医療業界と、その業界とつながりを持つ厚生労働省は、病気になる人を減らそうとする努力を怠っているとしか見えないのが現状であるから、安全性の評価は、「健康を害する恐れがあるが比較的安全であると言える」程度の評価までとするべきであり、普及のために国民を安心させるような評価をつけてはならない。
ましてや動物で試験をした結果を、適切な研究結果であると認識している現状はすぐにでも改革しなければならない。
法律で動物実験のデータを求めることをやめ、迅速に慎重に代替法を成立させ、臨床研究によるヒトの観察のみを重要視し、新たな開発よりも病気にならないための生活習慣の改善につながる安全な医療機器を提供する必要がある。
「近年の科学技術の進展に伴い、臨床研究の重要性は一段と増している。臨床研究の主な目的は、医療における疾病の予防方法、診断方法及び治療方法の改善、疾病原因及び病態の理解並びに患者の生活の質の向上にあり、最善であると認められた予防方法、診断方法及び治療方法であっても、その有効性、効率性、利便性及び質に関する臨床研究を通じて、絶えず再検証されなければならない。また、医療の進歩は、最終的には臨床研究に依存せざるを得ない場合が多いが、臨床研究においては、被験者の福利に対する配慮が科学的及び社会的利益よりも優先されなければならない。」
GPMTやA&Pではいずれもモルモットが用いられているが、モルモットを含むヒト以外の動物はヒトではなく、ヒトへの安全性の試験にヒト以外の動物を使用する事はあまりにも無意味であると言える。
動物の体重が試験に重要な要因であると言っているが、実際に医療機器を使用するヒトは個々様々な体重や感度をもつし、対象動物がヒトに類似した反応を示すとしても、それが様々なヒトに対して有効なデータとして認めるには不確実であり、動物での試験結果をヒトに当てはめ安全性を評価している現状を危惧します。
人間への安全性を全てにおいて異なる動物で試したとしても、結果無意味であるどころか人間の健康や安全のための研究が遅れるばかりであり、税金と資金と労力と動物の命の無駄でしかないのである。
ビジネスのために盲目的に動物実験が有効であるとされている現状を懸念している良識ある医師や研究者も世界中に数多くいるが、利益追求の権力と政治の影に隠されているのである。
動物の細胞や、特に生きた動物を使用する試験を続けていてはいけない。
★〓★〓★〓

『医療機器の生物学的安全性評価の基本的考え方(案)』PDFファイル
http://search.e-gov.go.jp/servlet/PcmFileDownload?seqNo=0000081172
1.目的
本文書は、医療機器の市販前の安全性評価の一環として、生物学的有害作用(毒性ハザード)のリスク評価を行うための生物学的安全性評価に関する基本的考え方を示すものである。
2.定義
本文書において用いられる用語の定義は以下によるものとする。
1) 原材料
医療機器の材料又は医療機器の製造工程中で用いられる材料をいい、合成又は天然高分子化合物、金属、合金、セラミックス、その他の化学物質などをいう。
2) 最終製品
出荷可能な医療機器をいい、滅菌品については滅菌後の製品をいう。ただし、出荷後、用時加工・調製され使用されるものにあっては、実際に使用される状態の製品をいう。
3) ハザード
人の健康に不利益な影響を及ぼす原因となりうる遺伝毒性、感作性、慢性全身毒性などの要素をいう。
4) リスク
ハザードにより引き起こされる人の健康に不利益な影響の発生確率及びその影響の程度をいう。
8.動物福祉
試験に動物を用いる際の動物の取扱いについては、動物の愛護及び管理に関する法律及びISO 10993-2 動物福祉に関する要求事項などに従い、動物の福祉に努めること。

in vivo 病態モデル; 関節炎モデル、血管新生モデル、動脈硬化症モデル(transgenic mice)、再狭窄モデル(静脈移植片疾患モデル)、繊維症モデル等をもちいたサイレンシング効果の検討。
実験データを人間にあてはめたいがために人為的に病気を作られる。生体解剖。
『[別添]医療機器の生物学的安全性試験法ガイダンス(案)』PDFファイル
http://search.e-gov.go.jp/servlet/PcmFileDownload?seqNo=0000081173
3.試験試料と試験法の選択
3) LLNA : 単一化学物質を対象に、GPMTの代替法として国際的に認められている。
現在、化学物質に対しては動物愛護の観点も含め、優先される試験となりつつある。LLNAの特性として、偽陰性や偽陽性物質の存在、ある種の金属や高分子化合物といった皮膚に浸透しないものでは正確な評価は難しいことが知られている。同様に、水系媒体では評価が困難な場合がある。また、刺激によりLLNAが陽性反応を示す可能性のあることも認識しておかなければならない。試験試料は溶液、懸濁液、ゲルもしくはペーストなど、マウスの耳に適用できる性状でなければならない。
以上のとおり、各試験法にはメリット、デメリットが存在し、いずれの試験法も万能でないことを理解し、適切な試験法を選択することが重要である。また、試験試料からの抽出物を溶解又は分散させる際に用いる溶媒が強い全身毒性又は局所刺激性を示すものである場合は、その毒性を勘案して試験法を選択することが必要である。
第2部 感作性試験 ※【物質によって特異的にアレルギー反応が起こされる場合を感作性という。】
4.GPMT
4.1 試験法
4.1.1 試験動物と動物数
体重400 g前後の健康な若齢白色モルモット(通常l~3カ月齢)を使用する。雄ないし雌の動物を使用することが可能であるが、雌を使用する場合は妊娠していない未経産の動物を使用する。動物数は、試験群10 匹、対照群は最低5 匹とする。感作性評価が困難な場合には、再惹起あるいは動物数を増やすなどの対応が必要である。また、動物は無作為に各群に振り分けるようにする。
4.1.2 群構成及び陽性対照物質
試験群と陰性対照群、陽性対照群を設定する。試験液を希釈あるいは濃縮して濃度を複数設定できる場合は最低3 群設定し、用量依存性も評価できる群構成とする。惹起濃度を複数設定できる場合には試験群を1 群とし、陰性、陽性対照群の3 群設定でも評価できる場合がある。また、生理食塩液抽出液のように、濃縮処理などが困難でかつ抽出液の原液で感作することで十分に安全性を評価できると判断される場合も、試験群を1 群とし、陰性、陽性対照群の3 群での試験も可能である。陽性対照物質は、試験動物の感度及び感作性の強さの比較に必要であり、次
のような物質が用いられている。 p-フェニレンジアミン (CAS No. 106-50-3)、1-クロロ-2,4-ジニトロベンゼン (CAS No. 97-00-7)、重クロム酸カリウム (CASNo. 77781-50-9)、硫酸ネオマイシン (CAS No. 1405-10-3)、硫酸ニッケル (CASNo. 7786-81-4)。その他、文献で知られた感作性物質も使用可能である。
4.1.3 感作
あらかじめ刈毛したモルモットの肩甲骨上部皮膚(約2 × 4 cm)に、以下のものを図1に示すように左右対称0.1 mLずつ皮内注射する。
(a) 蒸留水とFreund 完全アジュバント (FCA) の1 : 1の油中水型 (W/O) 乳化物 (E-FCA)
(b) 各試料液(試験液、陽性対照液、陰性対照 (溶媒) 液)
(c) (b)の試料液((b) の 2 倍濃度)とFCAとの等量乳化混合物皮内注射後1 週間目に、皮内注射部位(刈毛した肩甲骨上部皮膚部、図2)にラウリル硫酸ナトリウム(ワセリン中10%)を塗布する。ただし、試料液に刺激性がある場合、この操作は不要である。翌日、ラウリル硫酸ナトリウム(ワセリン中10%)を拭き取った後、同一部位に試料液 (b) 0.2 m Lを48時間閉塞貼付する。
4.1.4 惹起
閉塞貼付後2 週間目に、試料液を適切な溶媒に溶解あるいは混合したもの及びその段階希釈した試料液をあらかじめ刈毛した背部又は側腹部に適用する。試験群には、溶媒のみ(0%液)も適用し、判定の参考にする。惹起に用いる濃度は、予備試験で刺激性を示さなかった最高濃度から段階的に希釈したもの各0.1 mLを個々のモルモットの皮膚に適用する(図2)。適用は、閉塞貼付あるいは開放塗布で行う。原料化学物質あるいは金属材料を試験する場合であって、それらが水溶性の場合は水溶液を用いてもかまわない。植物油(オリブ油、綿実油及びゴマ油など)は刺激性あるいは感作性を示すことがあるので、陰性対照群の反応などを十分考慮して判定すること。
4.1.5 皮膚反応の判定
閉塞貼付の場合は、24 時間後に貼付物を取り去り、その24 及び48 時間後に皮膚反応を通常の判定基準に従って採点し、以下のように表示する。通常の判定基準とは、表 1 に示した評点などをさす。開放塗布の場合は、塗布後24、 48、 72時間の皮膚反応を採点する。なお、平均評価点が約 1.0になる惹起濃度から、およその最低感作濃度を推定す
ることができる1)。
皮膚(皮内)反応の評点付けシステム(ISO 10993-10)
高度紅斑からわずかな痂皮の形成(深部損傷まで) 4点
[最高点4 点]
浮腫の形成
高度浮腫(1 mm 以上の膨隆と暴露範囲を超えた広がり) 4点
[最高点4 点]
4.2 試験報告書
試験報告書には、少なくとも以下の事項を記載する。
1) 試験実施機関及び試験責任者
2) 試験実施期間
3) 試験試料(医療機器又は原材料)を特定する要素(例:医療機器の名称、製造業者名、製造番号、原材料名など)
4) 使用した対照物質(陽性対照物質)(例:対照物質名、入手先、製造番号など)
5) 試験液の調製方法(抽出方法、抽出率を含む)
6) 試験動物の種と系統、数、週齢、性別
7) 試験方法
8) 実験開始時及び終了時の個別体重
9) 個々の動物の皮膚反応結果及び総括表
10) 結果の評価と考察
11) 参考文献
採点結果は下表に例示するごとく、惹起濃度、陽性率、平均評価点などが見やすいものを作成する。
5.A&P
5.1 試験法
5.1.1 試験動物と動物数
4.1.1と同様に動物を選択し、準備する。
6.LLNA
6.1 試験法
6.1.1 試験動物と動物数
CBA/Ca もしくはCBA/J 系統の健康な雌性マウスを使用する。マウスは非妊娠、未経産で、8~12 週齢を用いる。動物数は試験群、対照群ともに1群最低5匹を使用し、個体別の反応を測定することが望ましい。
6.1.5 測定試料の調製
標識化合物の投与5 ± 0.75 時間後、マウスを安楽死させ、耳介リンパ節を採取する。個別にマウスの両耳のリンパ節をプールする。調製した単離細胞は、遠心分離により2 回洗浄を行い、PBS に再懸濁する。細胞を5%トリクロロ酢酸 (TCA) 中、4 ± 2℃で18 ± 1 時間沈殿させる。最後の遠心分離後、ペレットを1 mL のTCA に再懸濁し、3H の計測をシンチレーションカウンタで行う。
7.5 試験動物について
試験動物の選択に当たっては感受性の高い動物を用いることが原則である。GPMTやA&Pではいずれもモルモットが用いられている。モルモットが選ばれたのは、感作性反応の感度の良さに加えて、外観的に紅斑及び浮腫を形成し、種々の化学物質においてヒトに類似した反応を示すことが知られており、更に、豊富な背景データの蓄積があることが主たる理由である。動物の体重は重要な要因であり、あまり小さいと操作がやりにくく、あまり大きい(600 g以上)と反応性が鈍くなるため、実験開始時の体重が400 g前後の、健康な若齢白色モルモット(通常l~3カ月齢)を用いるのが望ましい。雄ないし雌の動物を使用することが可能であるが、雌を使用する場合は妊娠していない未経産の動物を使用する。LLNAではDBA/2, B6C3F1, BALB/cなどの系統でも使用可能であるとの報告はあるが、実際に用いる場合にはCBA系統と感度が同等であることを確認する必要がある。各試験で使用するマウスは同一週齢(1週間以内のもの)とする。感度が雌と同等であることを示すことができれば、雄を使用してもよい。群数に関しては、医療機器では、試験に用いる試料は抽出液になることが多いので、1 用量のみしか設定できない場合もあるが、抽出液を濃縮乾固後に再溶解することで用量を複数設定できる場合には 3 群程度設定し、用量依存性を確認することが望ましい。陽性対照群も試験ごとに設定することが望ましい。LLNAでは特に媒体の刺激性が反応に大きく影響することから、試験試料と同じ媒体を使用できる物質を選択すべきであるが、適切な陽性対照物質が存在しない場合には、別途陽性対照用の媒体群も設定して試験を行い、それぞれの陰性対照に対するSIを求めるべきである。
7.7 皮膚反応の採点基準について
モルモットの場合、血管拡張に基づく紅斑と、血管透過性亢進に基づく浮腫とが容易に区別できることから、一般的に皮膚反応の判定基準は、紅斑 (erythema)の程度に浮腫 (edema) の形成を加味して行っているものが多い。ISO 10993-10では、総合的に4段階でスコアをつけているが、より多くの情報が得られることから、本ガイダンスでは今までのスコアを再掲した。LLNAでは評価に用いるものではないが、投与期間中の耳介の状態を観察することが重要である。刺激性が強い物質では、耳介の状態が悪化し、結果として感作性の反応が低下するおそれがあるため、試験結果の評価に重要な情報となる。
※「耳介(じかい、pinna)または耳殻(じかく)とは、動物の耳のうち、外に張り出て飛び出している部分のこと。外耳の一部。音を集める機能の他、動物によっては体温調節の機能などを担っている場合もある。」
第3部 遺伝毒性試験
4.参考情報
4.1 背景
遺伝毒性試験 (genotoxicity test) は、1 個の細胞に生じたDNA 傷害 (DNAdamage)から派生して、細胞や個体レベルで遺伝子突然変異 (gene mutation) や染色体異常 (chromosomal aberration) を誘発する遺伝毒性物質の検出を目的とする試験である。遺伝毒性物質の作用は、その傷害が生体内の体細胞で起きるか、もしくは生殖細胞で起きるかにより傷害の現われ方が異なる。各組織の体細胞においてDNA 傷害が生じると、がんの原因となる場合がある。その意味で、遺伝毒性試験は発がん物質の短期スクリーニング試験の役割を果たしている。一方、卵子や精子など生体内の生殖細胞にDNA 傷害が生じると、傷を持つ大部分の細胞は生殖細胞や胚の発生過程で淘汰を受けるが、次世代に遺伝子突然変異や染色体異常が伝わる可能性がある。また、妊娠中の母体が暴露受け、胎児の体細胞DNA に傷害が生じた場合、奇形や身体的障害を有する新生児が産まれる可能性もある。このように、遺伝毒性物質はDNA に作用して、がんの発生や次世代に遺伝的影響を及ぼすことから、医療機器は短期的または長期的いずれの使用条件下においても、生体に作用して遺伝毒性を示さないことが望まれる。
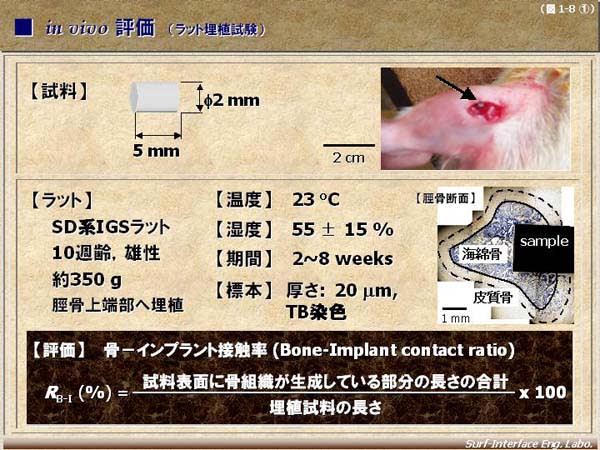
第4部 埋植試験
3.5 試験動物
3.5.1 短中期の埋植試験には、げっ歯類、ウサギなどが一般的に用いられる。長期埋植では、げっ歯類、ウサギ、イヌ、ヒツジ、ヤギ、ブタなどが用いられる。ラットでは異物発がんが知られているため1)、26 週を超える皮下埋植試験に用いる場合は注意を要する。表1 に長期埋植の際の動物種の選択を示した。
『ケイ&リル 動物愛護の超メルマガ』
http://archive.mag2.com/0001350453/index.html



人間への安全性を全てにおいて異なる動物で試したとしても、結果無意味であるどころか人間の健康や安全のための研究が遅れるばかりであり、税金と資金と労力と動物の命の無駄でしかないのである。
ビジネスのために盲目的に動物実験が有効であるとされている現状を懸念している良識ある医師や研究者も世界中に数多くいるが、利益追求の権力と政治の影に隠されているのである。
「医療機器の生物学的安全性評価の基本的考え方」に関する意見の募集について
http://search.e-gov.go.jp/servlet/Public?CLASSNAME=PCMMSTDETAIL&id=495110288&Mode=0
平成23年11月21日
厚生労働省医薬食品局
審査管理課医療機器審査管理室
薬事法に基づく医療機器の製造販売承認申請又は製造販売認証申請に際して添付すべき資料のうち、生物学的安全性に関する資料の取扱いについては、平成15年2月13日付け医薬審発第0213001号「医療用具の製造(輸入)承認申請に必要な生物学的安全性試験の基本的考え方について」及び平成15年3月19日付け事務連絡医療機器審査No.36「生物学的安全性試験の基本的考え方に関する参考資料について」に基づき取り扱ってきたところです。
今般、「医療機器の生物学的安全性評価の基本的考え方」について改正案を作成いたしましたので、広く国民の方々から御意見を募集いたします。
この案に関して御意見のある場合には、下記の方法に従い提出してください。
なお、提出していただいた御意見に対する個別の回答はいたしかねますので、その旨御了承願います。
平成23年12月20日(火)必着
入力フォームの件名欄には「医療機器の生物学的安全性評価の基本的考え方」と書いておく。
【意見送信フォーム】意見は3000文字以内で
https://www-secure.mhlw.go.jp/cgi-bin/getmail/publiccomment_input.cgi?mailto=ninshou201111@mhlw.go.jp
(なぜかこのURLはリンクができないのでコピーして貼り付けてね。フォームリンクは短縮したやつ。それかぴかりぃさんとこにリンクあるよ。)
御意見は日本語に限ります。
個人の場合は住所、氏名、年齢及び職業を書きましょう。
ファクシミリの場合
ファクシミリ番号:03-3597-0332
厚生労働省医薬食品局審査管理課医療機器審査管理室宛て
意見募集の案件
・医療機器の生物学的安全性評価の基本的考え方(案)
・[別添]医療機器の生物学的安全性試験法ガイダンス(案)
Testing 123
★〓★〓★〓
「さよなら、じっけんしつ」のぴかりぃさんから
http://goodbyelab.blog.so-net.ne.jp/2011-11-26
例)
「医療機器の生物学的安全性評価の基本的考え方」について
・試験法の選定にあたっては、動物福祉の観点からin vivo試験を最小限に減らすべき旨、明記してください。
・使用数の削減が図られている試験法があること等に注意を促し、動物福祉の観点から、試験計画の立案においては動物の使用数を必要最低限とするべきことを明記してください。
・「8.動物福祉」に環境省の実験動物の飼養保管基準と厚生労働省の動物実験指針の遵守についても追加するべきだと思います。
・医療機器の動物実験についても、代替法の研究開発、評価、およびガイダンスへの採用を促進する方向で予算配分や研究・評価体制の整備などを行ってください。
など。
「理由を付して」とあるので、ぜひ動物実験に対する気持ちなどをぜひ書いてください! よろしくお願いします。
★〓★〓★〓

【意見送信フォーム】 今日中に送るぞ!
https://www-secure.mhlw.go.jp/cgi-bin/getmail/publiccomment_input.cgi?mailto=ninshou201111@mhlw.go.jp
件名:「医療機器の生物学的安全性評価の基本的考え方」
本文:
厚生労働省が発行している臨床研究に関する倫理指針の前文に「最終的には臨床研究に依存せざるを得ない」と書いている。
その言葉どおり、人間に対する生物学的安全性を唯一評価できるのは人間に対する試験と観察であり、認可を得るためのデータ収集目的と言わざるを得ないヒト以外の動物を使った試験は国民を欺く行為であり、年齢、性別、体格、体質、生活習慣などの違う様々な人が対象になる医療機器や薬などの安全性を評価するための方法は即刻根本的に見直さなければならない。
一度認可を受けてしまえば、例えば風邪薬一つにしても、処方する患者の身長、体重、遺伝的疾患、その日の食事、生活習慣、アレルギーなど全く調べもせず、患者への簡単なアンケートだけを元に判断し、処方される。
すべての患者が自分の潜在的な病気やアレルギーなどを全て把握しているわけがないにも関わらず、薬を服用したあとの食事や生活態度などの追跡調査をするわけでもなく、患者に重大な異変が起こり自己申告があって初めて対処にあたるわけです。
人間は千差万別であるし、病気の症状も全く同じものなど一つとしてないのだが、処方した薬がその患者にどのような効果を表しているのかなどは、認可を得て広く国民に服用させていても常に調査研究の対象でなければならないはずである。
医療機器の生物学的安全性も同様に、例えば乳がん検診のマンモグラフィーを受ける個々の女性が放射線に対してどのような異変が起きる可能性があるのか、人工的に作られた放射線を浴びた後何年、何十年と経過し次世代へも影響が起きないのか、個別に詳しく調査しておらず、医薬品や医療機器を普及させるためにのみ安全性の評価が求められており、実際ガンや心臓病や脳血管疾患などを患う患者は増加の一方であり、病気の予防のための研究や改善の普及には資金や労力をかけず、病気の治療をすれば利益につながる医療業界と、その業界とつながりを持つ厚生労働省は、病気になる人を減らそうとする努力を怠っているとしか見えないのが現状であるから、安全性の評価は、「健康を害する恐れがあるが比較的安全であると言える」程度の評価までとするべきであり、普及のために国民を安心させるような評価をつけてはならない。
ましてや動物で試験をした結果を、適切な研究結果であると認識している現状はすぐにでも改革しなければならない。
法律で動物実験のデータを求めることをやめ、迅速に慎重に代替法を成立させ、臨床研究によるヒトの観察のみを重要視し、新たな開発よりも病気にならないための生活習慣の改善につながる安全な医療機器を提供する必要がある。
「近年の科学技術の進展に伴い、臨床研究の重要性は一段と増している。臨床研究の主な目的は、医療における疾病の予防方法、診断方法及び治療方法の改善、疾病原因及び病態の理解並びに患者の生活の質の向上にあり、最善であると認められた予防方法、診断方法及び治療方法であっても、その有効性、効率性、利便性及び質に関する臨床研究を通じて、絶えず再検証されなければならない。また、医療の進歩は、最終的には臨床研究に依存せざるを得ない場合が多いが、臨床研究においては、被験者の福利に対する配慮が科学的及び社会的利益よりも優先されなければならない。」
GPMTやA&Pではいずれもモルモットが用いられているが、モルモットを含むヒト以外の動物はヒトではなく、ヒトへの安全性の試験にヒト以外の動物を使用する事はあまりにも無意味であると言える。
動物の体重が試験に重要な要因であると言っているが、実際に医療機器を使用するヒトは個々様々な体重や感度をもつし、対象動物がヒトに類似した反応を示すとしても、それが様々なヒトに対して有効なデータとして認めるには不確実であり、動物での試験結果をヒトに当てはめ安全性を評価している現状を危惧します。
人間への安全性を全てにおいて異なる動物で試したとしても、結果無意味であるどころか人間の健康や安全のための研究が遅れるばかりであり、税金と資金と労力と動物の命の無駄でしかないのである。
ビジネスのために盲目的に動物実験が有効であるとされている現状を懸念している良識ある医師や研究者も世界中に数多くいるが、利益追求の権力と政治の影に隠されているのである。
動物の細胞や、特に生きた動物を使用する試験を続けていてはいけない。
★〓★〓★〓

『医療機器の生物学的安全性評価の基本的考え方(案)』PDFファイル
http://search.e-gov.go.jp/servlet/PcmFileDownload?seqNo=0000081172
1.目的
本文書は、医療機器の市販前の安全性評価の一環として、生物学的有害作用(毒性ハザード)のリスク評価を行うための生物学的安全性評価に関する基本的考え方を示すものである。
2.定義
本文書において用いられる用語の定義は以下によるものとする。
1) 原材料
医療機器の材料又は医療機器の製造工程中で用いられる材料をいい、合成又は天然高分子化合物、金属、合金、セラミックス、その他の化学物質などをいう。
2) 最終製品
出荷可能な医療機器をいい、滅菌品については滅菌後の製品をいう。ただし、出荷後、用時加工・調製され使用されるものにあっては、実際に使用される状態の製品をいう。
3) ハザード
人の健康に不利益な影響を及ぼす原因となりうる遺伝毒性、感作性、慢性全身毒性などの要素をいう。
4) リスク
ハザードにより引き起こされる人の健康に不利益な影響の発生確率及びその影響の程度をいう。
8.動物福祉
試験に動物を用いる際の動物の取扱いについては、動物の愛護及び管理に関する法律及びISO 10993-2 動物福祉に関する要求事項などに従い、動物の福祉に努めること。

in vivo 病態モデル; 関節炎モデル、血管新生モデル、動脈硬化症モデル(transgenic mice)、再狭窄モデル(静脈移植片疾患モデル)、繊維症モデル等をもちいたサイレンシング効果の検討。
実験データを人間にあてはめたいがために人為的に病気を作られる。生体解剖。
『[別添]医療機器の生物学的安全性試験法ガイダンス(案)』PDFファイル
http://search.e-gov.go.jp/servlet/PcmFileDownload?seqNo=0000081173
3.試験試料と試験法の選択
3) LLNA : 単一化学物質を対象に、GPMTの代替法として国際的に認められている。
現在、化学物質に対しては動物愛護の観点も含め、優先される試験となりつつある。LLNAの特性として、偽陰性や偽陽性物質の存在、ある種の金属や高分子化合物といった皮膚に浸透しないものでは正確な評価は難しいことが知られている。同様に、水系媒体では評価が困難な場合がある。また、刺激によりLLNAが陽性反応を示す可能性のあることも認識しておかなければならない。試験試料は溶液、懸濁液、ゲルもしくはペーストなど、マウスの耳に適用できる性状でなければならない。
以上のとおり、各試験法にはメリット、デメリットが存在し、いずれの試験法も万能でないことを理解し、適切な試験法を選択することが重要である。また、試験試料からの抽出物を溶解又は分散させる際に用いる溶媒が強い全身毒性又は局所刺激性を示すものである場合は、その毒性を勘案して試験法を選択することが必要である。
第2部 感作性試験 ※【物質によって特異的にアレルギー反応が起こされる場合を感作性という。】
4.GPMT
4.1 試験法
4.1.1 試験動物と動物数
体重400 g前後の健康な若齢白色モルモット(通常l~3カ月齢)を使用する。雄ないし雌の動物を使用することが可能であるが、雌を使用する場合は妊娠していない未経産の動物を使用する。動物数は、試験群10 匹、対照群は最低5 匹とする。感作性評価が困難な場合には、再惹起あるいは動物数を増やすなどの対応が必要である。また、動物は無作為に各群に振り分けるようにする。
4.1.2 群構成及び陽性対照物質
試験群と陰性対照群、陽性対照群を設定する。試験液を希釈あるいは濃縮して濃度を複数設定できる場合は最低3 群設定し、用量依存性も評価できる群構成とする。惹起濃度を複数設定できる場合には試験群を1 群とし、陰性、陽性対照群の3 群設定でも評価できる場合がある。また、生理食塩液抽出液のように、濃縮処理などが困難でかつ抽出液の原液で感作することで十分に安全性を評価できると判断される場合も、試験群を1 群とし、陰性、陽性対照群の3 群での試験も可能である。陽性対照物質は、試験動物の感度及び感作性の強さの比較に必要であり、次
のような物質が用いられている。 p-フェニレンジアミン (CAS No. 106-50-3)、1-クロロ-2,4-ジニトロベンゼン (CAS No. 97-00-7)、重クロム酸カリウム (CASNo. 77781-50-9)、硫酸ネオマイシン (CAS No. 1405-10-3)、硫酸ニッケル (CASNo. 7786-81-4)。その他、文献で知られた感作性物質も使用可能である。
4.1.3 感作
あらかじめ刈毛したモルモットの肩甲骨上部皮膚(約2 × 4 cm)に、以下のものを図1に示すように左右対称0.1 mLずつ皮内注射する。
(a) 蒸留水とFreund 完全アジュバント (FCA) の1 : 1の油中水型 (W/O) 乳化物 (E-FCA)
(b) 各試料液(試験液、陽性対照液、陰性対照 (溶媒) 液)
(c) (b)の試料液((b) の 2 倍濃度)とFCAとの等量乳化混合物皮内注射後1 週間目に、皮内注射部位(刈毛した肩甲骨上部皮膚部、図2)にラウリル硫酸ナトリウム(ワセリン中10%)を塗布する。ただし、試料液に刺激性がある場合、この操作は不要である。翌日、ラウリル硫酸ナトリウム(ワセリン中10%)を拭き取った後、同一部位に試料液 (b) 0.2 m Lを48時間閉塞貼付する。
4.1.4 惹起
閉塞貼付後2 週間目に、試料液を適切な溶媒に溶解あるいは混合したもの及びその段階希釈した試料液をあらかじめ刈毛した背部又は側腹部に適用する。試験群には、溶媒のみ(0%液)も適用し、判定の参考にする。惹起に用いる濃度は、予備試験で刺激性を示さなかった最高濃度から段階的に希釈したもの各0.1 mLを個々のモルモットの皮膚に適用する(図2)。適用は、閉塞貼付あるいは開放塗布で行う。原料化学物質あるいは金属材料を試験する場合であって、それらが水溶性の場合は水溶液を用いてもかまわない。植物油(オリブ油、綿実油及びゴマ油など)は刺激性あるいは感作性を示すことがあるので、陰性対照群の反応などを十分考慮して判定すること。
4.1.5 皮膚反応の判定
閉塞貼付の場合は、24 時間後に貼付物を取り去り、その24 及び48 時間後に皮膚反応を通常の判定基準に従って採点し、以下のように表示する。通常の判定基準とは、表 1 に示した評点などをさす。開放塗布の場合は、塗布後24、 48、 72時間の皮膚反応を採点する。なお、平均評価点が約 1.0になる惹起濃度から、およその最低感作濃度を推定す
ることができる1)。
皮膚(皮内)反応の評点付けシステム(ISO 10993-10)
高度紅斑からわずかな痂皮の形成(深部損傷まで) 4点
[最高点4 点]
浮腫の形成
高度浮腫(1 mm 以上の膨隆と暴露範囲を超えた広がり) 4点
[最高点4 点]
4.2 試験報告書
試験報告書には、少なくとも以下の事項を記載する。
1) 試験実施機関及び試験責任者
2) 試験実施期間
3) 試験試料(医療機器又は原材料)を特定する要素(例:医療機器の名称、製造業者名、製造番号、原材料名など)
4) 使用した対照物質(陽性対照物質)(例:対照物質名、入手先、製造番号など)
5) 試験液の調製方法(抽出方法、抽出率を含む)
6) 試験動物の種と系統、数、週齢、性別
7) 試験方法
8) 実験開始時及び終了時の個別体重
9) 個々の動物の皮膚反応結果及び総括表
10) 結果の評価と考察
11) 参考文献
採点結果は下表に例示するごとく、惹起濃度、陽性率、平均評価点などが見やすいものを作成する。
5.A&P
5.1 試験法
5.1.1 試験動物と動物数
4.1.1と同様に動物を選択し、準備する。
6.LLNA
6.1 試験法
6.1.1 試験動物と動物数
CBA/Ca もしくはCBA/J 系統の健康な雌性マウスを使用する。マウスは非妊娠、未経産で、8~12 週齢を用いる。動物数は試験群、対照群ともに1群最低5匹を使用し、個体別の反応を測定することが望ましい。
6.1.5 測定試料の調製
標識化合物の投与5 ± 0.75 時間後、マウスを安楽死させ、耳介リンパ節を採取する。個別にマウスの両耳のリンパ節をプールする。調製した単離細胞は、遠心分離により2 回洗浄を行い、PBS に再懸濁する。細胞を5%トリクロロ酢酸 (TCA) 中、4 ± 2℃で18 ± 1 時間沈殿させる。最後の遠心分離後、ペレットを1 mL のTCA に再懸濁し、3H の計測をシンチレーションカウンタで行う。
7.5 試験動物について
試験動物の選択に当たっては感受性の高い動物を用いることが原則である。GPMTやA&Pではいずれもモルモットが用いられている。モルモットが選ばれたのは、感作性反応の感度の良さに加えて、外観的に紅斑及び浮腫を形成し、種々の化学物質においてヒトに類似した反応を示すことが知られており、更に、豊富な背景データの蓄積があることが主たる理由である。動物の体重は重要な要因であり、あまり小さいと操作がやりにくく、あまり大きい(600 g以上)と反応性が鈍くなるため、実験開始時の体重が400 g前後の、健康な若齢白色モルモット(通常l~3カ月齢)を用いるのが望ましい。雄ないし雌の動物を使用することが可能であるが、雌を使用する場合は妊娠していない未経産の動物を使用する。LLNAではDBA/2, B6C3F1, BALB/cなどの系統でも使用可能であるとの報告はあるが、実際に用いる場合にはCBA系統と感度が同等であることを確認する必要がある。各試験で使用するマウスは同一週齢(1週間以内のもの)とする。感度が雌と同等であることを示すことができれば、雄を使用してもよい。群数に関しては、医療機器では、試験に用いる試料は抽出液になることが多いので、1 用量のみしか設定できない場合もあるが、抽出液を濃縮乾固後に再溶解することで用量を複数設定できる場合には 3 群程度設定し、用量依存性を確認することが望ましい。陽性対照群も試験ごとに設定することが望ましい。LLNAでは特に媒体の刺激性が反応に大きく影響することから、試験試料と同じ媒体を使用できる物質を選択すべきであるが、適切な陽性対照物質が存在しない場合には、別途陽性対照用の媒体群も設定して試験を行い、それぞれの陰性対照に対するSIを求めるべきである。
7.7 皮膚反応の採点基準について
モルモットの場合、血管拡張に基づく紅斑と、血管透過性亢進に基づく浮腫とが容易に区別できることから、一般的に皮膚反応の判定基準は、紅斑 (erythema)の程度に浮腫 (edema) の形成を加味して行っているものが多い。ISO 10993-10では、総合的に4段階でスコアをつけているが、より多くの情報が得られることから、本ガイダンスでは今までのスコアを再掲した。LLNAでは評価に用いるものではないが、投与期間中の耳介の状態を観察することが重要である。刺激性が強い物質では、耳介の状態が悪化し、結果として感作性の反応が低下するおそれがあるため、試験結果の評価に重要な情報となる。
※「耳介(じかい、pinna)または耳殻(じかく)とは、動物の耳のうち、外に張り出て飛び出している部分のこと。外耳の一部。音を集める機能の他、動物によっては体温調節の機能などを担っている場合もある。」
第3部 遺伝毒性試験
4.参考情報
4.1 背景
遺伝毒性試験 (genotoxicity test) は、1 個の細胞に生じたDNA 傷害 (DNAdamage)から派生して、細胞や個体レベルで遺伝子突然変異 (gene mutation) や染色体異常 (chromosomal aberration) を誘発する遺伝毒性物質の検出を目的とする試験である。遺伝毒性物質の作用は、その傷害が生体内の体細胞で起きるか、もしくは生殖細胞で起きるかにより傷害の現われ方が異なる。各組織の体細胞においてDNA 傷害が生じると、がんの原因となる場合がある。その意味で、遺伝毒性試験は発がん物質の短期スクリーニング試験の役割を果たしている。一方、卵子や精子など生体内の生殖細胞にDNA 傷害が生じると、傷を持つ大部分の細胞は生殖細胞や胚の発生過程で淘汰を受けるが、次世代に遺伝子突然変異や染色体異常が伝わる可能性がある。また、妊娠中の母体が暴露受け、胎児の体細胞DNA に傷害が生じた場合、奇形や身体的障害を有する新生児が産まれる可能性もある。このように、遺伝毒性物質はDNA に作用して、がんの発生や次世代に遺伝的影響を及ぼすことから、医療機器は短期的または長期的いずれの使用条件下においても、生体に作用して遺伝毒性を示さないことが望まれる。
第4部 埋植試験
3.5 試験動物
3.5.1 短中期の埋植試験には、げっ歯類、ウサギなどが一般的に用いられる。長期埋植では、げっ歯類、ウサギ、イヌ、ヒツジ、ヤギ、ブタなどが用いられる。ラットでは異物発がんが知られているため1)、26 週を超える皮下埋植試験に用いる場合は注意を要する。表1 に長期埋植の際の動物種の選択を示した。

『ケイ&リル 動物愛護の超メルマガ』
http://archive.mag2.com/0001350453/index.html















































何とか送れました(泣)
時間が過ぎてしまい ほんとに涙が出てきましたが
返信があったので多分大丈夫だと思います。
動物愛護のパブコメも送り、数人の知り合いにも
お願いしたのですが 返信無しでした。
私も変人扱いまっしぐらかもしれませんが
ケイさんやさっち~さんの活動を励みに 出来ること
やっていきます!
意見提出ご苦労さまでした。
融通のきかない厚生労働省だし時間がすぎてしまったからパブコメとしては受理されないと思うけど、意見は担当者が必ず読んでるから意義ありです。
送信ありがとう御座いましたの返信メールは自動プログラムだからいつ何を送ってもみんなに届くと思います。
これからもみんなでやれる事どんどんやっていきましょうね。