全身性アミロイドーシスの総説
Blood Rev 2020; 40: 100636
アミロイドーシスは異常な折りたたみの蛋白が臓器に沈着し、機能障害を来す疾患群である。症状は多くの場合非特異的なので、診断は臨床医がアミロイドーシスを疑うことができるかどうかにかかっている。アミロイドの種類を確定することは非常に重要で、治療方針の決定と予後予測に必須である。
AL アミロイドーシスは欧米で最も多いアミロイドーシスであり、モノクローナルな形質細胞が産生した異常な折りたたみの免疫グロブリンの軽鎖が沈着する。AL アミロイドーシス患者の予後予測に必要なデータが蓄積されつつある。AL アミロイドーシスの治療のゴールは高用量のメルファランまたは新規薬剤(プロテアソーム阻害薬、免疫調整薬、抗 CD38 モノクローナル抗体) でアミロイド産生形質細胞を除去することである。早期診断が重要で、診断が遅れると臓器障害は不可逆的になる。
ATTR アシドーシスは診断ツールの発展にともない診断が増えつつある。治療法(パティシラン、イノテルセン、タファミディス)については新しい知見が集まりつつある。
1. 疾患概念
アミロイドーシスは特定の臓器に蛋白性の線維が沈着し、形態変化・機能障害を来す疾患群である。診断は組織学的にアミロイドの沈着を示すことで確定される。HE 染色では、不定形の好酸性の沈着物を認める。また、コンゴレッドで染色して偏光で観察すると緑の複屈折を認める。アミロイドの原因蛋白の特定は予後予測と適切な治療の選択に必要であり、その目的のために免疫電子顕微鏡、質量分析器、免疫組織染色が用いられる。
アミロイドの原因蛋白は 30種類が知られているが、このうち全身性アミロイドーシスの原因となるのは 14種類である。全身性アミロイドーシスの原因として多いのは免疫グロブリン軽鎖 (AL)、反応性 (AA) 、変異または野生型トランスサイレチン (ATTR)、アポリポ蛋白 A-I (AApoAI) がある。
AL アミロイドーシスの症状は非特異的で、体重減少、倦怠感、呼吸困難、知覚障害が出現し得る。特異的な所見とされる巨舌、眼窩周囲の紫斑は稀にしか認めない。
AL アミロイドーシスの眼窩周囲の紫斑
https://casereports.bmj.com/content/2014/bcr-2013-201407
AL アミロイドーシスはアミロイドーシスの中で最も多く、米国では罹患率は 9-14 人/100万人・年と報告されている。しかし、アミロイドーシスは診断が難しいので、真の罹患率はもっと高いだろうと考えられている。全ての意義不明の単クローン性免疫グロブリン血症 (monoclonal gammopathy of undeterminrd significance: MGUS) の患者に対してはアミロイドーシスのスクリーニングのための問診と身体診察を行うべきである。
AL アミロイドーシスの治療の多くは多発性骨髄腫の治療に由来している。しかし、臨床像が複雑であることから治療は個別的になる。そして、個別的な治療が可能になるためには、リスクと治療反応性を評価できるようになることが必要である。
最近、リスクの層別化が可能になり、治療に関連する死亡 (treatment-related mortality: TRM) を減らすために誰に対して自家幹細胞移植 (autologous stem cell transplantation: ASCT) をするべきかを選択できるようになりつつある。
新しく診断された AL アミロイドーシスの患者はボルテゾミブ (プロテアソーム阻害薬、商品名: ベルケイド) を主剤とする化学療法で治療される。特に高リスクな患者では高用量メルファラン (アルキル化剤、商品名: アルケラン) および ASCT で治療する。
再発した場合の最適な治療再開時期についてはデータが不足しており、新規薬剤の臨床試験が進められている。ダラツムマブ (抗 CD38 モノクローナル抗体、商品名: ダラザレックス、ダラキューロ) 単独あるいは併用療法は血液学的反応が良好で認容性に優れるので期待されている。
最近 20 年間で早期診断、リスクの層別化、補助療法および新規療法の開発で進歩があり、生命予後は改善している。
ATTRm アミロイドーシスは常染色体優性遺伝の多臓器を冒す進行性の疾患である。トランスサイレチンをコードする遺伝子に変異があり、異常蛋白が肝内で産生される。異常蛋白は心臓、神経、消化管に沈着する。ATTRwt アミロイドーシスでは正常のトランスサイレチン蛋白が異常に折りたたまれ、アミロイド線維を形成する。
最近まで、ATTR アミロイドーシスの治療は肝移植かトランスサイレチン四量体安定化薬 (タファミディス、商品名: ビンダケル、ジフルニサル: NSAIDs のひとつでトランスサイレチン四量体を安定化する作用がある) しかなかった。2018年に ATTRm ニューロパチーの治療薬についての二つの大規模な臨床試験の結果が公表され、ATTRm アミロイドーシスの治療にパラダイムシフトを引き起こした。現在、FDA は ATTRm アミロイドーシスの治療薬として、タファミディス、イノテルセン: アンチオリゴヌクレオチド薬、パティシラン: RNA 干渉治療薬、商品名:オンパットロ) の三剤を承認している。
2.心アミロイドーシス
AL アミロイドーシスに特徴的な単一の血液所見や画像所見はなく、診断は難しい。障害されている臓器の数と程度によって臨床像は変化する。症状は体重減少、倦怠感、呼吸困難、末梢の浮腫など非特異的なものが多い。アミロイドーシスに特異的とされる所見は感度が低い。たとえば、軟部組織が障害されるのは AL アミロイドーシスらしいとされるが、軟部組織が障害されるのは 1割程度である。障害される臓器で多いのは、心臓、腎臓、肝臓、神経系、消化管、軟部組織である。複数の臓器が障害されることが多いが、単一の臓器が障害される場合もある。
AL アミロイドーシスの 60-75% で心臓が障害され、生命予後規定因子となる。AL アミロイドーシスによって心不全、不整脈、失神、突然死を来たし得る。また、稀だが冠動脈にアミロイド線維が沈着すると心筋梗塞を起こすことがある。それまで安定していた患者が急速に全身状態が悪化する場合は肺塞栓や心房細動が起こっている可能性がある。AL アミロイドーシスによる心障害に対して最も感度が高い指標はナトリウム利尿ペプチド (NT-pro BNP, BNP) である。ナトリウム利尿ペプチドは治療反応性の評価にも利用できる。心障害を来している AL アミロイドーシスでは半数以上で心電図で低電位を認める。他に心房細動、梗塞様変化 ( 胸部誘導における r 波増高不良)、伝導障害を認めることがある。
心アミロイドーシスは通常は拡張障害を来たし、駆出率は保たれる。心臓超音波では、左室肥大と心室中隔肥厚、心嚢水、駆出率低下、global longitudinal strain: GLS の低下を認め得る。心アミロイドーシスに特徴的な所見とされる心筋の不均一な顆粒状の高輝度 (granular sparkling) は感度は 5割程度であり、現在では心アミロイドーシスの診断基準には用いられない。
最近報告された後ろ向きの観察研究によると、うっ血性心不全の原因のうち AL アミロイドーシスはわずか 0.5%を占めるに過ぎない。著者らは心不全患者に対して AL アミロイドーシスのスクリーニングを行う場合は、NT-pro BNP 5000 pg/mL 以上、後壁の厚さ 13 mm 以上の患者に対して免疫グロブリ軽鎖を測定するようにすると検査前確率が上がるのではないかと議論している。血清免疫電気泳動と尿電気泳動も加えると良いかもしれない。
心内膜心筋生検は心アミロイドーシス診断のゴールドスタンダードだが、侵襲的なのでできれば避けたい検査である。心臓 MRI は非侵襲的で感度・特異度ともに優れる(感度: 80-100%、特異度 80-94%)。特に後期の造影効果はアミロイドーシスを強く示唆する。ただし、アミロイドのタイプは識別できない。
Tc-99m ピロリン酸シンチグラフィ(Tc-99m PYP) は非侵襲的に ATTR アミロイドーシスを AL アミロイドーシスから鑑別することができる。ただし、AL アミロイドーシスでも陽性になることがあることは留意する。M 蛋白が陰性で、PYP スキャンが陽性の場合は ATTR アミロイドーシスと判断しても良い。逆に M 蛋白が陽性で PYP スキャンが陽性の場合は、ATTR の診断には組織病理が必要になる。
3. アミロイド腎症
腎障害は AL アミロイドーシスの 50-70% で認め、ネフローゼ症候群または非選択的な蛋白尿を呈する。アミロイド腎症は腎間質へのアミロイド沈着を確認することによって確定診断されるが、腎生検をすることは稀である。腎以外の組織でアミロイド線維を確認できていれば、0.5 g/日以上のアルブミン主体の蛋白尿をもってアミロイド腎症と診断している。腎腫大を認めることは稀である。アミロイド腎症は診断が遅れるあるいは治療が不十分である場合には末期腎不全(end stage renal disease: ESRD) に至る。
4. アミロイドポリニューロパチー
アミロイドーシスにより、感覚神経 (感覚異常 paresthesia, しびれ numbness, 疼痛)、自律神経(胃不全麻痺 gastroparesis、膀胱機能障害、腸管機能障害、起立性低血圧)、運動神経が障害される。
筋電図は末梢神経障害の評価には利用しやすく、有用な検査である。アミロイドポリニューロパチーではふつう、対称性の脱髄性多発神経炎で感覚神経および運動神経が障害される。アミロイドポリニューロパチーの患者の 5%では無髄 C 線維のみが障害されるが、この場合は筋電図には異常を認めないので注意が必要である。このような小径線維ポリニューロパチーの検査のゴールドスタンダードは皮膚生検で表皮内の小径線維を定量することで、感度・特異度ともに 90%と高い。
50歳以前に発症するポリニューロパチーは ATTRm アミロイドーシスらしい。またATTR アミロイドーシスのポリニューロパチー出現の 10年以上前に両側の手根管症候群が先行することがある。AL アミロイドーシスでも 20%で手根管症候群が先行する。
AL アミロイドーシスや ATTR アミロイドーシスでは神経伝導検査で伝導速度低下や遠位潜時遅延を認め(いずれも脱髄を示唆する所見) 、慢性炎症性脱髄性多発神経炎 (chronic inflammatory demielinating polyneuropathy: CIDP) との鑑別が問題になる。アミロイドニューロパチーでは自律神経障害 (消化管の運動障害による嘔吐、便秘・下痢や勃起障害、起立性低血圧による失神) を認めることが鑑別点となる。
5. 消化管障害
AL アミロイドーシスでは、10%で症候性の消化管障害が起こる。消化管の運動障害による嘔気・嘔吐、下痢・便秘の他、体重減少、吸収不良、消化管出血を来たし得る。
AL アミロイドーシスの 20%では、肝障害を来たし、体重減少、肝腫大、アルカリフォスファターゼ高値、凝固異常を来たし得る。FibroScan では肝硬度 (liver stiffness) の上昇 (17.3 kPa 以上) を認めるかもしれない。
6. その他の臨床症状
アミロイドーシスの紫斑は通常、乳頭線より上に出現する。アミロイドーシスに特徴的であるとされる眼窩周囲の紫斑は 20% 以下の症例で認める。
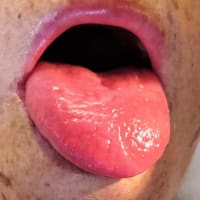
巨舌は AL アミロイドーシスを疑わせる所見であり、10%前後で認める。巨舌を呈する他疾患としては、甲状腺機能低下症、先端巨大症、舌癌がある。AL アミロイドーシスの巨舌は硬く、歯の痕がついている。巨舌は睡眠時無呼吸症候群、口腔の乾燥、嚥下障害を来たし、生活の質を著しく損ねる。
肺障害は呼吸困難と乾性咳嗽を呈し、画像上は間質影を認める。
顎、腓腹部および臀部に細静脈が鬱滞ことによる跛行を認めることがある。動脈周囲にアミロイドが沈着することにより shoulder pad signを認めることがあるが稀である。
shoulder pad sign の写真
https://www.nejm.org/doi/full/10.1056/ENEJMicm040061
AL アミロイドーシスの出血性素因は第 X 因子の欠乏、後天性 von Willebrand 病、肝障害による凝固因子の合成低下、アミロイドによる血管閉塞が原因になる。
AL アミロイドーシス以外のアミロイドーシスと AL アミロイドーシスとを臨床的に区別することはできない。ATTRwt アミロイドーシスによる心アミロイドーシスは 90%で男性である。半数で手管根症候群の既往があり、腎障害は稀である。上腕二頭筋断裂と末梢神経障害を認めることがある。
元論文
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7124973/