脳腱黄色腫症
Front Neurol 2022; 13: 1049850
脳腱性黄色腫症 (Cerebrotendinous Xanthomatosis) は、CYP27A1 遺伝子のホモ接合体または複合ヘテロ接合体の変異に起因する、稀な見過ごされやすい診断の遺伝性神経代謝疾患である。脳腱黄色腫症は胆汁酸代謝異常によるものであり、主な症状である神経学的症状のスペクトルが広く、潜在的に治療可能な神経遺伝学的疾患である。
小脳失調症 (cerebellar ataxia)、末梢神経障害 (peripheral neuropathy)、痙性対麻痺 (spatic paraparesis)、てんかん (epilepsy)、パーキンソニズム (parkinsonism)、認知機能低下 (cognitive decline)、知的障害 (intellectual disability)、精神神経障害 (neuropsychiatric disturbances) は、この疾患で観察される神経学的徴候の一部である。多系統の病変は、診断の指標として疑われる重要な徴候であるにもかかわらず、必須の徴候ではなく、診断のためのワークアップにおいて過小評価されることもある。
ケノデオキシコール酸 (chenodeoxycolic acid) は、この遺伝性代謝性疾患に対する有効な治療法としてよく知られているが、様々な状況下で使用できないこと、高コストであること、疾患経過の後期の患者に使用されることが多いことから、ほとんどの患者にとってより良好な神経学的転帰が得られていない。本総説は、脳腱性黄色腫症に関連する臨床的、病態生理学的、神経画像学的、遺伝学的、治療学的側面に関する最新の知見について論じ、強調することを目的とする。
1. はじめに
脳腱性黄色腫症(Cerebrotendinous Xanthomatosis: CTX)または脳コレステリン症(Cerebral Cholesterinosis, MIM #213700)は、胆汁酸生合成経路に関連するまれな常染色体劣性遺伝性の代謝性脂質蓄積障害である。CTX は、チトクローム P450 オキシダーゼ系のミトコンドリア酵素であるステロール 27-ヒドロキシラーゼ (sterol 27-hydroxylase) をコードする CYP27A1(2q35)の遺伝子アレルの変異によって引き起こされる。この酵素の活性が低下すると、いくつかの組織、特に腱、水晶体、末梢神経系、中枢神経系で異常な脂質の合成と蓄積が増加する。
1937 年に Van Bogaert によって初めて報告されて以来、数百例の症例が報告されている。現在のデータによると、この疾患はかなり過小診断されているようである。米国での発症率は 1/72,000~1/150,000 であり、モロッコのセファルディム系ユダヤ人における発症頻度は 70,000 人に 6 人と推定されている。世界中で 400 人以上の CTX 患者が報告されており、イタリア、オランダ、ドイツ、日本、中国、トルコ、イスラエル、スペインの医学文献には、多くの患者が報告されている。CTX の発症率は、ヨーロッパ人で 1:134,970 から 1:461,358、アフリカ人で 1:263,222 から1:468,624、アメリカ人で 1:71,677 から1:148,914、東アジア人で 1:64,267 から1:64,712、南アジア人で 1:36,072 から 1:75,601 である。
本論文の目的は、CTX の主な臨床所見、生化学所見、画像所見、治療に関する現在のエビデンスを提示することである。
2. 脳腱黄色腫の病態生理
CTX は、コレステロール代謝および胆汁酸合成経路において重要な役割を果たすミトコンドリア酵素であるステロール 27-水酸化酵素の欠損を引き起こす CYP27A1 の変異体によって引き起こされる。CTX に関連するバリアントは、ミスセンス、挿入/欠失、スプライスサイト、ナンセンスバリアントなど複数同定されており、遺伝子型と表現型の明確な相関は知られていない。
胆汁酸合成は主に 2 つの代謝経路で起こる。古典的な経路はコレステロールの 7α-水酸化で始まり、コレステロール 7α-水酸化酵素が作用する。代替経路の第一段階はコレステロールの 27-水酸化で、ステロール 27-水酸化酵素が触媒となり、さまざまなステロール中間体の側鎖が酸化される。CTX では、CYP27A1 の活性が低下しているため、ケノデオキシコール酸(chenodeoxycolic acid: CDCA)とコール酸の形成が損なわれている。コレステロール 7α-水酸化酵素に対する CDCA の負のフィードバック作用が失われると、古典的経路における 7α-ヒドロキシ-4-コレステン-3-オンおよびその代謝物の濃度が上昇する(図 1)。
図 1. 胆汁酸の合成経路
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F1/
グルクロン酸抱合体として血清コレステロール濃度と尿中胆汁酸濃度の上昇が認められる。増加したコレステロール代謝物は組織に沈着する。さらに、コレスタノール (cholestanol) などの他の異常な病理学的中間体のレベルも上昇する。これらは主に脳、眼球、腱に蓄積し、それぞれ進行性の神経機能障害、白内障 (cataract)、黄色腫 (xanthomas) を引き起こし、これらはこの疾患の典型的な臨床症状の一部である。しかし、多様な全身症状や精神神経症状を伴う表現型も数多く存在する。
コレスタノールは血液脳関門(blood brain barrier)を効率的に通過しないため、脳への蓄積についてはまだ完全には解明されていない。CTX 患者の脳脊髄液 (cerebrospinal fluid) 中に高濃度のコレスタノールとアポリポ蛋白 B が認められることから、血液脳関門の障害または透過性の亢進が示唆されている。この血液脳関門の変化は、循環する胆汁アルコールのグルクロン酸抱合体の影響かもしれない。しかし、CTX 患者において血液脳関門が無傷であることを示した研究もあり、コレスタノールの増加は、除去が不十分であるか、コレステロールまたは別の前駆体から脳内でコレスタノールが合成された結果である可能性が示されている。さらに、胆汁酸前駆体である 7α-ヒドロキシ-4-コレステン-3-オンは血液脳関門を通過し、神経細胞、アストロサイト、ミクログリア、ヒト単球由来マクロファージによってコレスタノールに変換される(図 1)。
CTX の病変部にはコレステロールとコレスタノールが著しく沈着しているが、血清コレステロール値は通常正常である。しかし、血清中のラトステロール (lathosterol)とフィトステロール (phytosterol) の濃度が上昇していることから、それぞれコレステロールの新生合成と腸管吸収が亢進していることがわかる。また、コレステロールの代謝に関しては、CTX 患者は早期の動脈硬化と黄色腫を発症するが、これは、細胞膜をより効率的に通過する 27-ヒドロキシラーゼ活性の産物である 27-ヒドロキシコレステロールの濃度が有意に低下していることから、末梢コレステロールの肝臓への輸送が減少していることと関連している可能性がある。歯状核 (dentate nucleus) の泡沫性組織球 (foamy histocytes) でも、酸化ストレスによる機能障害に関連した細胞質 Nε-カルボキシメチル-リジンの増加が証明されている。
泡沫状組織球
3. 脳腱黄色腫の臨床的概要と診断
CTX の診断は主に臨床所見、画像所見、遺伝学的所見、生化学的所見に基づいて行われる。本疾患の臨床像は非常に不均一であり、診断の大幅な遅れにつながる。若年者では、CTX に関連する所見は主に両側性の若年性白内障(82%)、慢性下痢(31%)、知的障害(48-74%)である。成人では、これらに加えて、腱黄色腫(76%)、精神障害(11.4%)、末梢神経障害(45%)、小脳失調症(36-83%)、運動障害(パーキンソニズム、ジストニア、ミオクローヌス、姿勢振戦)、認知機能低下(87%)、痙性対麻痺などの錐体性徴候(64-92%)がみられる(図 2)。
図 2. 脳腱黄色腫の自然経過
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F1/
小児期には、小児下痢と新生児黄疸が最も早期に現れる。通常、黄疸は一過性であり、重篤な合併症を伴わず、直接ビリルビン高値、肝トランスアミナーゼおよびアルカリホスファターゼの上昇を伴う。ガンマグルタミルトランスフェラーゼの血清濃度は一般に正常かわずかに上昇する。CDCA 含量の著明な減少は、ファルネソイド X 受容体の活性化と発現を刺激せず、胆管における胆汁酸塩の輸出と輸送の減少をもたらす。しかし、CTX 患者ではまれに重症の新生児胆汁うっ滞がみられ、非常に早期に致死的な経過をたどったり、肝移植が必要なまでに進行したりすることがある。
原因不明の乳児期発症の慢性下痢は、最も一般的な消化器症状であり(患者の 76%)、管腔内領域に胆汁アルコールが存在し、CDCA が相対的に存在しないために起こる。ステアトルレア (steatorrhea)、コレスタノール、コレステロール、脂肪酸は便に含まれず、吸収不良や発育不全も通常観察されない。CDCA は症候性下痢の寛解に非常に有効な治療法である。
両側の若年性白内障もよくみられる所見で、患者の 85%に認められる。若年期および成人期には、視神経障害および網膜血管の早期動脈硬化が眼科的合併症として認められることがある。
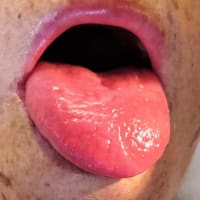
神経学的徴候および腱黄色腫は、白内障が出現した後に発現することが多い。黄色腫は CTX 患者の 71%に認められ、生後 1-3 年目に出現し、青年期後期から成人期早期に多くみられる。組織病理学的には、複雑な脂質結晶で満たされた大量の泡沫状マクロファージを認める。アキレス腱に好発するが、脛骨結節、上腕三頭筋、手指の腱にも認められる(図 3)。
図 3. 脳腱黄色腫症の臨床所見
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F3/
遺伝性代謝異常症における腱の病変は CTX の黄色腫に限らず、家族性高コレステロール血症 3 型(familial hypercholestrolemia type 3, PCSK9)、シトステロール血症(sitosterolemia, ABCG8)、ビタミン E 欠乏性運動失調症(ataxia with vitamin E deficiency, TTPA)でも起こることがある、 III 型高リポ蛋白血症(hyperlipoproteinemia type III, APOE)、2 型原発性低アルファリポ蛋白血症(primary hypoalphalipoproteinemia, APOA1)、Alagille 症候群(Alagille syndrome, JAG1)、まれに先天性低リン血症 (congenital hypophosphatemia)、組織黒変症 (ochronosis)、ガラクトース血症 (galactosemia) などがある。角膜輪(corneal arcus) や眼瞼黄色腫 (eyelid xanthelasmata) など、家族性高コレステロール血症におけるその他の典型的な検査所見は、CTX では観察されない。
神経障害はほとんど常にみられ、通常青年期後期から成人期早期に発症する(図 2)。精神症状(行動障害、うつ病、幻覚、激越)、認知症、知的障害がみられることもある。知的障害は一般に、CTX で最もよくみられる神経学的合併症のひとつであり、10 歳までに発症する。錐体路徴候(痙縮と反射亢進)および小脳徴候(進行性運動失調と構音障害)が頻繁にみられる。頻度は低いが、パーキンソニズム、ジストニア、ミオクローヌス、振戦などの運動障害も報告されている。ジストニアの多くは多巣性で、眼瞼痙攣、顎関節症、頸部ジストニア、四肢ジストニアが報告されている。CTX の初期の運動障害の特徴として、陽性および陰性ミオクローヌスの両方が報告されており、主に上肢が侵され、随意運動に類似したポリミニミオクローヌスパターン (polyminimyoclonus pattern) を示すこともあれば、動作時振戦 (action tremor) を示すこともある。
陽性ミオクローヌスと陰性ミオクローヌス
https://www.msdmanuals.com/ja-jp/professional/07-%E7%A5%9E%E7%B5%8C%E7%96%BE%E6%82%A3/%E9%81%8B%E5%8B%95%E9%9A%9C%E5%AE%B3%E7%96%BE%E6%82%A3%E3%81%8A%E3%82%88%E3%81%B3%E5%B0%8F%E8%84%B3%E7%96%BE%E6%82%A3/%E3%83%9F%E3%82%AA%E3%82%AF%E3%83%AD%E3%83%BC%E3%83%8C%E3%82%B9
咽頭、喉頭、舌に軟口蓋ミオクローヌス(palatal myoclonus) を認めることがある。痙攣、末梢神経障害(軸索性、脱髄性、混合性)、運動障害、感覚運動障害、凹足 (pes cavus) も起こりうる特徴である (図 3)。
その後、加齢に伴い、早発性動脈硬化症、骨粗鬆症、虚血性心疾患、僧帽弁閉鎖不全症、腹部大動脈瘤、冠動脈解離、脂肪性肥大 (lipomatous hypertrophy) による心房間隔の肥厚などの心血管疾患が高頻度に認められるようになる。CTX の合併症としては、心臓自律神経機能障害、心室頻拍、心房細動も報告されている。
骨粗鬆症は CTX の見過ごされやすい慢性合併症であり、特に最近診断された患者や一般に CDCA 治療に対する反応が悪い患者において、重大な合併症につながる。小児および若年発症の骨粗鬆症も CTX の早期合併症の可能性があり、おそらく若い間は見過ごされることが多い。
CTX 患者では運動失調が主な歩行障害の原因であると考えられることが多いが、錐体所見は小脳徴候よりも頻度が高く、脊髄黄色腫症 (spinal xanthomatosis) の症例は、時に純粋な痙性対麻痺として文献に報告されている。脊髄黄色腫症に関する最近の文献レビューでは、34 症例が報告されており、神経学的症状の平均発症年齢は 24 歳で、ほとんどの症例が複雑な遺伝性痙性対麻痺(hereditary spastic paraplegia: HSP)の表現型を呈し、認知症、運動失調、多発ニューロパチー、痙攣、精神疾患を合併することが報告されている。興味深いことに、唯一の神経学的表現型として痙性対麻痺が報告された患者は 23.5%であり、脊髄黄色腫症患者の 31%のみが黄色腫を呈していた。
一方、白内障と慢性下痢は頻度の高い特徴であり、それぞれ 78%と 65%の症例にみられた。Burguez らの報告以来、本原稿の著者の一人 (Saute JA) のセンターでは、HSP が疑われる患者の調査において CYP27A1 のスクリーニングを行っている。スクリーニングされた 115 家族のうち、CTX と診断されたのは 6 家族であり、これはブラジル南部におけるこのコホートの 5%に相当する(Saute JA 私信)。HSP の表現型は、生化学的あるいは遺伝子学的スクリーニングによって CTX を疑うべきものであることが確認された。
4 つの臨床的特徴(早発白内障、下痢、進行性神経学的徴候、腱黄色腫)のうち 2 つが存在すれば、CTX を疑って生化学検査を行うべきである。眼科医は原因不明の両側白内障に気づくことがあるが、これは特に小児やティーンエイジャーによくみられる症状である。初期の徴候であることから、若年性白内障と慢性下痢は特に重要である。さらに、自閉症スペクトラム障害 (autism spectrum disorder: ASD)、注意欠陥多動性障害(attention deficit hyperactive disorder: ADHD)、過敏性、攻撃的な衝動 (aggressive burst)、反抗挑戦性障害 (oppositional defiant disorder) などの精神疾患を持つ小児や青年で、特に家族歴や白内障や慢性下痢がある場合には、さらなる検査を受ける必要がある。
臨床においては、Mignarri index of suspicion を用いて CTX 予測スコアを算出し、それぞれに最適な診断アプローチを導くことができる。この指標では特定の所見群に異なるスコアを割り当てる(表 1)。
表 1. Mignarri index of suspicion
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/table/T1/
すなわち、 (i) 家族歴、(ii) 全身徴候、(iii) 神経学的病変である。最高指標スコア (100) の "非常に強く疑われる" (A) は、兄弟姉妹 に CTX 患者がいる (A1)、かつ/または腱黄色腫が存在する (A2) 場合である。50 点の "強く疑われる" (B) は、親が CTX 患者である (B1)、かつ/または若年発症の白内障がある (B2)、小児期発症の慢性下痢がある (B3)、長引く原因不明の新生児黄疸 (B4)、かつ/または運動失調または痙性対麻痺を認める (B5)、脳 MRI で歯状核信号変化を認める (B6)、かつ/または知的障害または精神障害がある (B7) 場合である。25 点の「疑いあり」(C) は、早期の骨粗鬆症 (C1)、かつ/またはてんかん (C2)、パーキンソニズム (C3)、多発神経炎 (C4) がある場合である。Mignarri スコアが 100 点以上の患者には、血漿コレスタノール濃度の測定が適応となる。血漿コレスタノール濃度が過去に高値であった場合、または Mignarri スコアが 200 点以上(少なくとも 1 つの「非常に強い指標」または 4 つの「強い指標」を含む)の場合は、CYP27A1 遺伝子の遺伝子解析の適応となる。Mignarri スコアが100 点に満たない場合であっても、CTX 診断を強く示唆する臨床的特徴(すなわち、若年性白内障、小児期発症の慢性下痢)がある患者では精査をやめるべきではない。
血清中のコレスタノール濃度が高いことは CTX の主な診断マーカーである。7-デヒドロコレステロールや 8-デヒドロコレステロールなどの他のコレステロール前駆体の上昇も、CTX でよく観察される。胆汁アルコール (bile alcohol) 高値は、胆汁、血漿、尿で認められ、CTX のバイオマーカーとなる。組織ではコレステロールが増加する傾向があるが、血漿中ではその濃度は正常か減少している。血漿および胆汁中の他の胆汁酸前駆体(ラトステロール [lathosterol]、ラノステロール [lanosterol] など)は増加する。古典的 CTX では通常、コレスタノールの血漿濃度が非定型型や脊髄 CTX (spinal CTX) よりも有意に高くなる。コレスタノールや胆汁酸合成の異常中間体の血漿濃度は、原発性胆汁性肝硬変や進行性家族性肝内胆汁うっ滞症 3 型(Progressive Familial Intrahepatic Cholestasis type 3, 原因遺伝子: ABCB4)などの慢性胆汁性胆道疾患や、ニーマン・ピック病 C 型 (Niemann-Pick disease type C)、シトステロール血症 (sitosterolemia)、家族性高コレステロール血症 (familial hypercholestrolemia)、ペルオキシソーム生合成障害などの遺伝性代謝異常症でも上昇することがある。
進行性家族性肝内胆汁うっ滞症
https://www.nanbyou.or.jp/entry/22459
全身麻酔時のプロポフォールの静脈内投与など、胆汁酸代謝に異常を来す薬剤は、原発性胆汁酸合成障害と同様の代謝異常をもたらす可能性がある。血漿コレスタノール濃度は、新生児期、小児期、成人期で比較すると、民族や年齢によって大きな差がある。ステロイドの長期使用は血漿コレスタノール濃度を低下させ、偽陰性結果や正常値をもたらす可能性があり、甲状腺機能低下症は濃度の上昇をもたらす可能性がある。髄液検査では、コレスタノール、コレステロール、アポリポ蛋白 B の断片、アポリポ蛋白 A1、アルブミンが高値で検出される可能性がある。肝生検では、細胞質に分散する沈着物や結晶形成を認めることがあるが、ルーチンで肝生検が行われることはない。胆汁酸前駆体である 7α-ヒドロキシ-4-コレステン-3-オンの定量は、CTX の迅速に行える新規の診断検査として提案されており、また臨床経過観察中の最適な治療バイオマーカーとしても提案されている。
CYP27A1 の塩基配列決定は、CTX の診断が疑われるすべての患者に実施すべきである。コレスタノール濃度が高い患者や臨床的に非常に疑われる患者に対して遺伝子検査を提案した著者もいるが、現在ではほとんどの施設では、コレスタノール測定よりも遺伝子検査の方が利用しやすくなっている。典型的な臨床所見と遺伝子変異の組み合わせは CTX の診断に有用であるが、意義不明の変異については血漿コレスタノール濃度を確認すべきである。遺伝子検査法が身近になり、希少疾患を専門とするほとんどの施設で検査が可能になったため、CTX における潜在的な臨床所見と遺伝学的相関に関する知識を整理することが臨床における大きな課題となっている(表 2)。
表 2. 脳腱黄色腫の臨床所見と CYP27A1 遺伝子変異のバリアントとの関係
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/table/T2/
診断目的と将来の臨床試験のために CTX の具体的な診断基準を作成することが必要となっている(表 3)。
表 3. 関島による脳腱黄色腫の診断基準と、Stelten による改訂基準
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/table/T3/
鑑別診断としては、シトステロール血症、家族性高コレステロール血症(いずれも腱黄色腫を呈することがある)、Smith-Lemli-Opitz 症候群(7-デヒドロコレステロールの上昇を特徴とし、CTX 患者の一部にもみられることがある)、他の先天性胆汁酸代謝異常症(HSP 5A 型など)、および非特異的肝疾患がある。
Smith-Lemli-Opitz 症候群
https://www.shouman.jp/disease/details/13_01_028/
Spastic Paraplegia type 5A
https://medlineplus.gov/genetics/condition/spastic-paraplegia-type-5a/#causes
進行性の神経症状、白内障、慢性下痢は、CTX をこれらの疾患と区別することができる。小児期の発症では、先天性下痢と Alagille 症候群が、新生児黄疸の他の原因と同様に、重要な鑑別診断となる。
Alagille 症候群
https://www.shouman.jp/disease/details/12_08_024/
成人患者では、HSP、遺伝性小脳失調症、多発性硬化症、白質ジストロフィー (leukodystrophy)、ミトコンドリア病、組織球症 (histocytosis)、その他の後天性運動失調の原因など、進行性神経疾患の他の原因との鑑別診断が行われる。この場合、腱黄色腫や白内障が CTX の最も重要な手がかりとなる。
白質ジストロフィー
https://www.ncnp.go.jp/hospital/patient/disease22.html
もし CTX が国の新生児スクリーニングプログラムに含まれていれば、正しい診断と適切な治療が行われるまでの診断の遅れをかなり防ぐことができるかもしれない。いくつかの研究グループは乾燥血液スポット (dried blood spot) による新生児スクリーニングは、早期診断と早期治療のための重要なステップであると考えている。しかし、新生児スクリーニングプログラムへの組み入れは、治療を受けなくても長期間無症状のままである可能性がある軽度の変異型が検出される可能性があるため、慎重であるべきであり、初めは研究として行うべきであろう。CTX の新生児スクリーニングを実施するためのスクリーニング方法は確立していない。しかし、スクリーニングで CTX であることが判明した新生児における最も特徴的なバイオマーカーは、5-β-コレスタン-3α,7α,12α,25-テトロール,3-O-β-D-グルクロニド(5-β-cholestane-3α, 7α, 12α, 25-tetrol, 3-O-β-D-glucuronide, GlcA-テトロール [GlcA-tetrol])であり、乾燥血液スポットからの 1. GlcA-テトロールと、2. GlcA-テトロールのタウロ-ケノデオキシコール酸 (tauro-chenodeoxycholic acid) に対する比率が、新生児スクリーニングのための最も正確な診断バイオマーカーである。
4. 神経画像所見
CTX の典型的な神経画像所見は、歯状核の T2 高信号である。晩期には小脳空胞化に伴うヘモジデリン沈着や微小出血の結果として、小脳に T2 低信号を認めることもある。
38 人の患者を対象とした総説では、84%の患者に脳 MRI 異常が認められ、1. テント上および下部の皮質の萎縮、皮質下および脳室周囲の白質異常、皮質下および脳室周囲白質異常、脳幹病変、小脳萎縮、歯状核とその周囲の白質に及ぶ小脳実質の病変が主な所見であった。T2W および FLAIR では、脳室周囲の白質、内包後脚 (posterior limb of internal capsule) 、淡蒼球 (globus pallidum)、黒質 (substantia nigra) レベルの大脳脚 (cerebral peduncles) 、橋 (pon) 腹側、下オリーブ核 (inferior olive) 、あるいは歯状核およびその周囲の白質に及ぶ小脳実質に対称性の高信号域を認めることがある。これらの病変は T1W や拡散強調像 (diffusion-weighted-image: DWI) では低信号を呈する (図 4, 5)。
図 4. 脳腱黄色腫の神経画像所見
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F4/
図 5. 脳腱黄色腫の神経画像所見 2
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F5/
歯状核は、経時的に T2W/FLAIR および磁化率強調(susceptibility-weighted image: SWI)で低信号を示すことがある。
磁化率強調画像
https://webview.isho.jp/journal/detail/abs/10.18888/sh.0000000506#:~:text=%E7%A3%81%E5%8C%96%E7%8E%87%E5%BC%B7%E8%AA%BF%E7%94%BB%E5%83%8F%E6%B3%95%EF%BC%88susceptibility%2Dweighted%20imaging%EF%BC%9ASWI,%E3%83%87%E3%82%AA%E3%82%AD%E3%82%B7%E3%83%98%E3%83%A2%E3%82%B0%E3%83%AD%E3%83%93%E3%83%B3%EF%BC%89%EF%BC%8C%E5%87%BA%E8%A1%80%EF%BC%88%E3%83%98%E3%83%A2%E3%82%B8%E3%83%87%E3%83%AA%E3%83%B3
CTX 患者では、歯状核の T2W/FLAIR 信号異常が最もよく認める所見であった。異常信号が歯状核に好発する理由は不明である。歯状核の高信号域の範囲と修正 Rankin Scale で示される障害との間にのみ、有意な臨床-画像相関が認められた。
皮質脊髄路や小脳に沿った病変の分布は、錐体路徴候や小脳徴候の臨床像と一致していた。また、黒質の異常はパーキンソン病の特徴と関連している可能性がある。
脊髄黄色腫症 (spinal xanthomatosis) は、主に中心索と後索に造影されない脊髄に沿った長い T2W 高信号域を呈することがある(図 6)。
図 6. 脊髄腱黄色腫症の神経画像所見
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9816572/figure/F6/
ある研究では、脊髄黄色腫は古典的な脳腱黄色腫と比較して、比較的軽度の臨床経過をとることが報告されている。33 人の患者を対象としたこのケースシリーズでは、脊髄黄色腫患者は通常錐体路徴候を呈し、48%に後索障害を認めたと報告している。患者の 1 人は、CTX の診断が遅く、CTX の治療中止後に精神症状と著明な脊髄黄色腫症(まれ)を呈した。脊髄黄色腫の症状として痙性対麻痺を認め、腱黄色腫は認めなかった。脊髄 MRI では、皮質脊髄路と錐体路に新規の線状の高信号を認めた。
神経画像所見は、患者によって大きく異なるものの、CTX の早期診断を受けた患者であっても、CDCA による治療後に神経画像所見が消退することはほとんどない。神経学的障害の重症度と歯状核や白質病変の広がりとの間には直接的な相関関係はない。運動機能や認知機能の低下が重度の場合でも神経画像的所見が目立たない場合もある。神経画像的所見は、成人患者と小児患者とでよく似ているが、成人患者ではより典型的なパターンを認める。
要約すると、脳 MRI では、びまん性小脳萎縮、第四脳室の拡張、歯状核と小脳白質の対称性の高信号化と隣接領域の DWI 低信号化、T2W と FLAIR で上小脳脚 (superior cerebellar peduncle) と錐体路 (pyramidal truct) の軽度の高信号化が認められる。
さらに、核磁気共鳴スペクトロスコピー(magnetic resonnance spectroscopy: MRS)により、病変に典型的な脂質ピーク、コリン増加、N-アセチル-アスパラギン酸ピーク減少が認められることがあり、これは広範な軸索損傷 (axonal damage) とミトコンドリア機能障害を示している。ドーパミン機能検査では、シナプス前ニューロンの脱神経 (presynaptic denervation) がみられる。このことは一部の患者においてレボドパによって症状が軽度改善するという観察と合う。
通常、腱黄色腫は T1W で低~等信号域、T2W では低~等信号として現れる。両側のアキレス腱に認めることが最も多い。CT スキャンでは、低吸収な軟部組織の腫大として認める。これは異常な脂質の沈着と関連している可能性がある。
5. 治療とフォローアップ
一般に年に 1 回の頻度で神経学的および神経心理学的評価、血漿コレスタノール濃度、脳 MRI、心エコー検査、全身の骨密度を評価すべきである。特筆すべき点として、治療開始後、コレスタノール濃度が正常範囲(平均追跡期間 34 ヵ月で 91 μmol/L の減少)に戻るにはかなりの時間を要する可能性があるため、中間胆汁酸アルコールなどコレスタノール経路の他の基質を短期間のフォローアップや臨床試験における代用アウトカムとして使用することが考えられる。
CTX の病態生理では、胆汁酸、特に CDCA の産生が著しく低下し、コール酸(cholic acid: CA)の産生も低下する。CDCA と CA は、胆汁酸合成経路の律速酵素である 7-α-ヒドロキシラーゼに対して生理的に負のフィードバック作用があるため、CTX では 7-α-ヒドロキシラーゼ活性が非常に亢進する。その結果、コレスタノールが大量に産生され、その後さまざまな組織に蓄積される。一方、血漿中のコレスタノールおよび尿中の胆汁アルコール濃度は正常か低値である。コレスタノールが神経毒性を示す可能性があるという証拠は、1%コレスタノール食を与えたラットの小脳の神経細胞、特にプルキンエ細胞にコレスタノールが沈着し、アポトーシスが認められたことで裏付けられている。CDCA はまた、GABAA 受容体 および NMDA 受容体を拮抗する作用を有する(図 1)。
CDCA の合成が減少し、コレスタノールが大量に産生されること、およびコレスタノールが神経毒性を示す可能性があるという最近のエビデンスに基づいて、CDCA は CTX 患者の標準治療となっている。CDCA は、負のフィードバック経路を介して胆汁酸合成を阻害することにより、コレスタノールの蓄積を防ぐ。これにより、患者の血漿コレスタノール濃度は劇的に低下し、組織への蓄積も抑制される。CDCA を用いた初期の研究では、ほとんどの CTX 患者において短期的には明らかな臨床的有用性が報告されたが、長期的な研究では、一部の患者ではむしろ症状の安定化が報告されている。
1984 年には、血清コレスタノールの減少、神経学的検査所見や脳波所見の改善といった結果において、CDCA 療法による長期的な有益性を支持する最初の研究が発表された。しかし、CTX 患者を対象とした CDCA の無作為プラセボ対照臨床試験は、今日まで行われていない。
CDCA 治療は通常、腱黄色腫を有意に減少させたり、白内障を改善させたりはしないが、認知機能の低下、錐体路徴候、小脳機能障害などの神経学的症状を安定化または改善させることができる。したがって、CTX の自然経過を考慮すると、治療の主な目的は神経学的徴候および症状の安定化または改善であると言える。
ほとんどの CTX 患者は CDCA 療法に良好に反応するが、神経学的に悪化し続ける患者もおり、特に 25 歳以上で診断された患者は治療開始時点ですでに重大な神経学的疾患を有している。神経学的に重大な病態が生じた場合、治療の効果は限定的であると思われる。CTX の早期診断と早期治療は、不可逆的な神経学的障害を予防するために不可欠であり、CTX の神経症状と全身症状を緩和し、疾患の経過を良い方向に向かわせる。43 人の CTX 患者を 8 年間追跡調査した研究では、認知障害(74%)、早発白内障(70%)、腱黄色腫(77%)、神経疾患(81%)が最も頻度の高い病態であり、CDCA による治療で 57%の患者の症状が改善した。
56 人の患者を対象とした CDCA 治療に関する最大の後ろ向きコホート研究では、24 歳以前に診断され治療された患者はすべて、神経症状が完全に消失し、新たな発症症状もみられなかったが、24 歳以降に診断され治療された患者の 61%では神経症状の悪化がみられた。治療抵抗性の症状の主なものはパーキンソニズムだった。これらの所見から、CDCA 治療はできるだけ早く開始されるべきであり、早期診断が本疾患の良好な転帰に最も重要であることが示唆される。
現在推奨されている CDCA の投与量は、小児では 1 日 5-15 mg/kg、成人では 1 日 750 mg を 3 回に分けて投与する。推奨用量に達するまで、1 日 500 mg を 2 週間投与し、その後 1 週間かけて 250 mg/日を増量するというレジメンが正式に推奨されている。3 ヵ月後も血清コレスタノールや尿中胆汁アルコールの上昇が続く場合は、CDCA を 1 日 1,000 mg まで増量してもよい。小児に対しては、初期用量として 1 日 5 mg/kg を 3 回に分けて投与することが推奨されている。CDCA を投与された CTX 患者において、特定の有害事象や安全性に関する懸念はほとんど報告されておらず、ほとんどの報告で重大な有害事象はないとされている。有害事象による治療中止は 5%未満である。肝毒性は CDCA の主な懸念事項と考えられているが、ほとんどの場合、血清アミノトランスフェラーゼの上昇は軽微である。肝毒性のために用量調節が必要になる場合があるが、ほとんどの場合、軽度の血清トランスアミナーゼ上昇(正常値の上限の 3 倍まで)は一過性の現象であり、薬剤中止後最大 6 ヵ月で完全に消失する。血清アミノトランスフェラーゼ値が正常値の上限の 3 倍を超え、CDCA の再投与後にそのような臨床検査値の変化が再発する患者は、治療を中止してもよい。CDCA の再開は、一般的に 1 日 5 mg/kg の低初回用量で推奨され、重大な合併症がなければその用量で維持される。患者が持続的な下痢または重度の胃腸愁訴を呈するようになった場合は、症状が改善するまで推奨投与量を一時的に減量し、その後有効量に戻す。中等度から重度の肝細胞機能障害、肝内胆汁うっ滞、原発性胆汁性肝硬変、硬化性胆管炎、胆道性膵炎、胆道性胃腸瘻、急性胆嚢炎または胆管炎、胆道閉塞のある患者には CDCA 療法は禁忌である。CDCA の使用が絶対禁忌である患者や重篤な有害事象がある患者では、CA を代わりに使用することが有益である可能性がある。
低用量の CDCA と HMG-CoA 還元酵素阻害薬プラバスタチン (pravastatin) との併用療法に関する初期の報告では、この併用療法が血漿中のコレスタノール濃度を低下させ、CDCA 単独療法によるトリグリセリドと低比重リポ蛋白(low-density lipoprotein: LDL)-コレステロールの上昇を回避することが示唆されたが、追跡期間が短すぎたため、関連する臨床的変化を検出することはできなかった。他の症例報告でも CDCA とシンバスタチン (simvastatin) やアトルバスタチン (atorvastatin) のような HMG-CoA 還元酵素阻害薬との併用が支持されており、CDCA にスタチンを追加した場合に生化学的反応や末梢神経障害や認知症状の改善がみられたという報告がある。
CDCA と HMG-CoA 還元酵素阻害薬を併用した LDL-アフェレーシスも可能性のあるアプローチであるが、コレスタノールが正常値あるいは正常値以下まで一貫して低下するにもかかわらず、この積極的なコレスタノール低下療法では臨床症状の明確な改善は認められなかった。CDCA 単独療法は、CDCA と HMG-CoA 還元酵素阻害薬の併用療法よりも、臨床転帰に関する強力なエビデンスを示している。デルファイ法を用いた最近のコンセンサス・ステートメントでは、専門家パネリストは CTX の第一選択療法として CDCA 単独療法が望ましいと考えたが、HMG-CoA 還元酵素阻害薬との併用療法が予後を改善/安定させるとも考えた。LDL アフェレーシスが予後を改善/安定させることについては、パネリストの意見は一致しなかった。
これまでの研究では、臨床反応、特に神経学的病変に関して様々なパターンを示す CTX 患者の管理における CA 療法の効果も評価されている。CDCA と同様に、CA 補充は負のフィードバック機構による内因性胆汁酸の生合成を抑制することにより、胆汁酸生合成経路の中間バイオマーカーの産生と尿中排泄を有意に減少させた。ベルギーで行われた後ろ向きな多施設共同研究では、CDCA 治療後の CTX 患者と未治療の CTX 患者の治療における CA の安全性と有効性が評価された。80%以上の患者で、治療期間中に臨床的改善または安定化がみられ、血漿中コレスタノール濃度が顕著に低下したことから、CDCA 治療で中等度から重度の副作用を示した患者において、第二選択薬または代替療法として CA が有用である可能性が示された。CTX における CA の単独療法としての使用に関しては、現在のところコンセンサスは得られていない。
他の研究では、コレスチラミン (cholestyramine)、親水性ウルソデオキシコール酸 (hydrophilic ursodeoxycolic acid)、ウルソデオキシコール酸 (ursodeoxycolic acid) など、いくつかの他の化合物の CTX 患者の生化学的・臨床的パラメータに対する効果が評価されているが、有意な反応や効果は観察されていない。
最後に、前臨床研究では、肝臓に CYP27A1 を発現するアデノ随伴ウイルス(adeno-associated virus: AAV)を単回静脈内投与することで、CTX のトランスジェニックマウスモデルにおいて、CDCA よりも高い程度で疾患の完全な代謝回復が得られることが示された。
6. 予後
特に無症候性患者や神経精神に重大な病変のない患者において、1. 確定診断時の年齢と 2. 早期の治療導入は治療効果や予後に関連する最も重要な予後因子である。治療開始後の血漿コレスタノール濃度の漸減は、CTX の臨床的進行を遅らせる。脳 MRI で小脳深部白質に空胞化が認められ、T1 強調および FLAIR で低濃度である患者は、一般に予後不良である。一方、歯状核の信号変化がない患者は、一般に予後良好である。いくつかの CYP27A1 遺伝子変異は、より重篤な神経学的および多系統の病変と関連しており、予後も悪い (表 2)。CDCA は継続的な使用を目的に開発された特異的な薬物療法であるため、長期的に治療が行えるかどうかは、神経学的および全身的転帰を改善し、生命予後を延長するための重要な課題である。
7. 結論
CTX はまれな、治療可能な遺伝性疾患であり、多臓器に病変をきたす。障害の主な原因は、錐体路徴候、運動失調、認知障害を含む神経学的症状である。歯状核の T2W 高信号、両側の若年性白内障、腱黄色腫の存在は診断の重要な手がかりである。CDCA による治療は安全であり、後ろ向きの研究の結果から、特に早期に開始すれば有効であると思われる。迅速な診断、場合によっては新生児スクリーニングは、この疾患の負担を大幅に軽減する可能性がある。
元論文
https://pubmed.ncbi.nlm.nih.gov/36619921/