どうも、ここ最近はDmCだのメタルギアライジングだのリフレクだのとゲーム三昧でめっきりダメ人間になっているボクです。
しかし、こんなボクでも数年前は朝9時半から夜9時半まで大学のケンキューシツというところで実験三昧をやっていたラボメンだったのです。
そんなボクがB4でラボに入ってからM2で卒業するまでやってた研究が、とうとう論文になりました。
Enantioselective Synthesis of Multisubstituted Biaryl Skeleton by Chiral Phosphoric Acid Catalyzed Desymmetrization/Kinetic Resolution Sequence
ケムステとかに取り上げられるとかなら別に記事にとかしないんだけど、そんなことはないのでせっかく掲載されてもあとは埋もれていくばかり。
そんなんじゃさびしいから自分で取り上げることにしました(`・ω・´)
さて、これ何してるかと言えば「軸不斉を持つ触媒で軸不斉化合物を不斉合成している」という変なことやってます(自分で言うな
鏡面対称性(Cs対称性)を持つオルト四置換ビアリール化合物に対して、軸不斉を持つキラルなリン酸触媒の存在下、臭素化剤としてNBP(N-ブロモフタルイミド)を作用させることで、芳香環上に臭素の付いた軸不斉を持つ化合物を合成しています。
ここでポイントになるのが
・臭素化の反応を通して「非対称化反応(Desymmetrization)」と「速度論的光学分割(Kinetic Resolution)」の二つの不斉反応を利用している
・基質、触媒、臭素化剤の3分子間での水素結合ネットワークと、基質の分子内での水素結合
の2点、というわけですね。
詳しい内容な論文を読んでくだしあ(ぉ
ここからはどんな研究にもつきものの苦労話とか諸々。
やー、この反応に使ってるデフォルトの基質(オルト位にメトキシ基とメトキシメチル基を持つやつ)、合成するのに11ステップかかってるんですよ。
詳細はサポーティングインフォにあるけど、
まずレゾルシノールのMOM化→オルトリチオ化→ホウ酸化、でカップリングのホウ酸パーツを作成します。
同時に、m-アニスアルデヒドのアルデヒド部位の還元→オルトリチオ化→ヨウ素化→ベンジルアルコール部位の酸化、でハロゲン化パーツの方も作成。
そしてノーベル賞でお馴染みの鈴木カップリングでビアリール骨格を形成し、アルデヒド部分をまた還元→できたベンジルアルコール部位をメチル化→MOMを外す、という過程で作ってます。
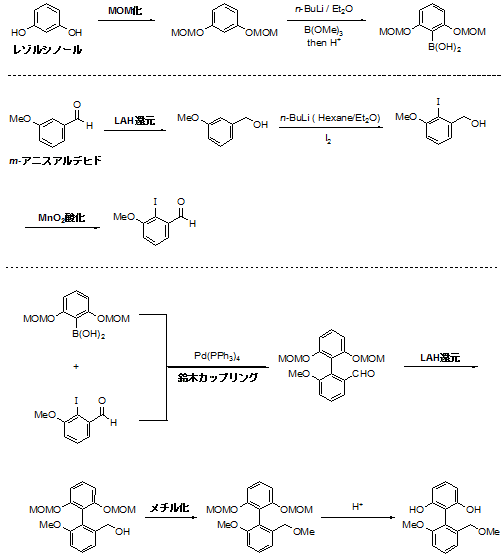
全体的にはLAHを使って還元したり、酸化マンガンで酸化したり、みたいな簡単な反応が多いけど、オルトリチオ化からのホウ酸化やヨウ素化の収率が基本的によくないんですよ(´・ω・`)
ホウ酸化の方は収率にムラがあって、いい時は定量的にいくし、悪い時は50%弱とか。
ヨウ素化は大抵50%ぐらいでしたね。
その後のメインにやるカップリングは、収率こそいいものの(悪い時、反応がいかないパターンも結構あったけど)、使ってる触媒Pd(PPh3)4なんかは15mol%使ってますしね。
鈴木カップリングといえば、世間的には5mol%ぐらいで定量的に反応が進行するイメージが強いかもわからんけど、こいつは結構いきにくい反応です。
MOMも2つ付いてるし、オルト四置換はダテじゃないってことか(・`ω・´)
ついでに言うと、このカップリングパーツのホウ酸も厄介なやつだったりします。
ホウ酸と言えば一般的には低毒性で空気や水に安定だから取扱いしやすいというの売りだったりします。
故に鈴木カップリングが扱いやすい優秀な反応であるという一助にもなっているわけですが…
このホウ酸は安定性低いです(´・ω・`)
というのも、オルト位にMOMという酸で外す保護基を持っているせいで、隣にあるホウ酸部位の影響を受けてしまうそうなのです。
なのでホウ酸だから安定だー、と適当にサンプル管に入れて常温放置しておくと、2~3日で色が赤っぽくなり、いずれは不溶性の謎の固体になり、使い物にならなくなるのです。
このホウ酸に限らず、芳香環上に隣あってMOMとホウ酸があるとダメになりやすいようで。
(ちなみにMOMではなくOMeだと、半年以上常温放置しても変わらぬ品質を保ちます)
この対処法は人それぞれですが、ボクは作ったら、ちょっと水分を含ませた状態で保存容器内を不活性ガス雰囲気にし、パラフィルムなんかで密封した上で冷凍庫に保管してました。
これだとちょこちょこ使って開封しても、1~2ヶ月はもちますね。
あるいは、ホウ酸を作ったその日にピナコールと混ぜて、ホウ酸エステルして保管する、という人もいます。
めんどくさい代物ですね…(´-ω-`)
そして出来上がった基質ですが、構造的には対称性があるし、オルト四置換ということもあり、割とかっちりしてて、すぐいい感じの固体になりそうな雰囲気を出してます。
しかし、これが案外そうでもなかったり。
カラムをやった後、エバポでぐるぐるすると粘っとしたものが出てきます。
溶媒が残ってるのかとヘキサンなんかで共沸すると、もこもこもこー、という感じにもこもこします。しかもぺたぺたします(雑な文章)
そう、素直に粉末や結晶な固体になってくれないのです。
MOMを外す前のやつだとスゴイいい結晶固体なのに。
フェノール性ヒドロキシ基が2つあるせいか知らんけど、これだとすごく扱いにくい。
というわけで、どうにかいい感じの固体にできないかといろいろやってましたが、ある日後輩君が再結晶に成功しました(それまではなかなか再結晶すらしない状態だった)。
しかしその結晶のNMRを取ると、結晶の約半分が溶媒という状態。
溶媒を取り込むことで結晶化する例は結構ありますが、実際目にするとめんどくさいの一言です。
なのでこの結晶を加熱真空引きして溶媒を飛ばすことで、白色粉末をゲットしたのでした。
ここまでくるとNMRもかなりピュアですし、ちゃんと不活性ガス雰囲気で密封すれば常温でもそこそこ長持ちします(フェノールなので空気中でほったらかしにすると酸化されて変色してくる)。
まぁ収率は結構下がっちゃいますけどね…(´・ω・`)
というわけで、11ステップもかけて作って、最終生成物もカラム→再結晶→加熱真空引きなんてやるせいで非常に苦労したという思いで話でした。
ここら辺の研究ネタは多いので、次回は触媒のリン酸とか臭素化反応の思い出話でもしようかと思いつつ。
しかし、こんなボクでも数年前は朝9時半から夜9時半まで大学のケンキューシツというところで実験三昧をやっていたラボメンだったのです。
そんなボクがB4でラボに入ってからM2で卒業するまでやってた研究が、とうとう論文になりました。
Enantioselective Synthesis of Multisubstituted Biaryl Skeleton by Chiral Phosphoric Acid Catalyzed Desymmetrization/Kinetic Resolution Sequence
ケムステとかに取り上げられるとかなら別に記事にとかしないんだけど、そんなことはないのでせっかく掲載されてもあとは埋もれていくばかり。
そんなんじゃさびしいから自分で取り上げることにしました(`・ω・´)
さて、これ何してるかと言えば「軸不斉を持つ触媒で軸不斉化合物を不斉合成している」という変なことやってます(自分で言うな
鏡面対称性(Cs対称性)を持つオルト四置換ビアリール化合物に対して、軸不斉を持つキラルなリン酸触媒の存在下、臭素化剤としてNBP(N-ブロモフタルイミド)を作用させることで、芳香環上に臭素の付いた軸不斉を持つ化合物を合成しています。
ここでポイントになるのが
・臭素化の反応を通して「非対称化反応(Desymmetrization)」と「速度論的光学分割(Kinetic Resolution)」の二つの不斉反応を利用している
・基質、触媒、臭素化剤の3分子間での水素結合ネットワークと、基質の分子内での水素結合
の2点、というわけですね。
詳しい内容な論文を読んでくだしあ(ぉ
ここからはどんな研究にもつきものの苦労話とか諸々。
やー、この反応に使ってるデフォルトの基質(オルト位にメトキシ基とメトキシメチル基を持つやつ)、合成するのに11ステップかかってるんですよ。
詳細はサポーティングインフォにあるけど、
まずレゾルシノールのMOM化→オルトリチオ化→ホウ酸化、でカップリングのホウ酸パーツを作成します。
同時に、m-アニスアルデヒドのアルデヒド部位の還元→オルトリチオ化→ヨウ素化→ベンジルアルコール部位の酸化、でハロゲン化パーツの方も作成。
そしてノーベル賞でお馴染みの鈴木カップリングでビアリール骨格を形成し、アルデヒド部分をまた還元→できたベンジルアルコール部位をメチル化→MOMを外す、という過程で作ってます。

全体的にはLAHを使って還元したり、酸化マンガンで酸化したり、みたいな簡単な反応が多いけど、オルトリチオ化からのホウ酸化やヨウ素化の収率が基本的によくないんですよ(´・ω・`)
ホウ酸化の方は収率にムラがあって、いい時は定量的にいくし、悪い時は50%弱とか。
ヨウ素化は大抵50%ぐらいでしたね。
その後のメインにやるカップリングは、収率こそいいものの(悪い時、反応がいかないパターンも結構あったけど)、使ってる触媒Pd(PPh3)4なんかは15mol%使ってますしね。
鈴木カップリングといえば、世間的には5mol%ぐらいで定量的に反応が進行するイメージが強いかもわからんけど、こいつは結構いきにくい反応です。
MOMも2つ付いてるし、オルト四置換はダテじゃないってことか(・`ω・´)
ついでに言うと、このカップリングパーツのホウ酸も厄介なやつだったりします。
ホウ酸と言えば一般的には低毒性で空気や水に安定だから取扱いしやすいというの売りだったりします。
故に鈴木カップリングが扱いやすい優秀な反応であるという一助にもなっているわけですが…
このホウ酸は安定性低いです(´・ω・`)
というのも、オルト位にMOMという酸で外す保護基を持っているせいで、隣にあるホウ酸部位の影響を受けてしまうそうなのです。
なのでホウ酸だから安定だー、と適当にサンプル管に入れて常温放置しておくと、2~3日で色が赤っぽくなり、いずれは不溶性の謎の固体になり、使い物にならなくなるのです。
このホウ酸に限らず、芳香環上に隣あってMOMとホウ酸があるとダメになりやすいようで。
(ちなみにMOMではなくOMeだと、半年以上常温放置しても変わらぬ品質を保ちます)
この対処法は人それぞれですが、ボクは作ったら、ちょっと水分を含ませた状態で保存容器内を不活性ガス雰囲気にし、パラフィルムなんかで密封した上で冷凍庫に保管してました。
これだとちょこちょこ使って開封しても、1~2ヶ月はもちますね。
あるいは、ホウ酸を作ったその日にピナコールと混ぜて、ホウ酸エステルして保管する、という人もいます。
めんどくさい代物ですね…(´-ω-`)
そして出来上がった基質ですが、構造的には対称性があるし、オルト四置換ということもあり、割とかっちりしてて、すぐいい感じの固体になりそうな雰囲気を出してます。
しかし、これが案外そうでもなかったり。
カラムをやった後、エバポでぐるぐるすると粘っとしたものが出てきます。
溶媒が残ってるのかとヘキサンなんかで共沸すると、もこもこもこー、という感じにもこもこします。しかもぺたぺたします(雑な文章)
そう、素直に粉末や結晶な固体になってくれないのです。
MOMを外す前のやつだとスゴイいい結晶固体なのに。
フェノール性ヒドロキシ基が2つあるせいか知らんけど、これだとすごく扱いにくい。
というわけで、どうにかいい感じの固体にできないかといろいろやってましたが、ある日後輩君が再結晶に成功しました(それまではなかなか再結晶すらしない状態だった)。
しかしその結晶のNMRを取ると、結晶の約半分が溶媒という状態。
溶媒を取り込むことで結晶化する例は結構ありますが、実際目にするとめんどくさいの一言です。
なのでこの結晶を加熱真空引きして溶媒を飛ばすことで、白色粉末をゲットしたのでした。
ここまでくるとNMRもかなりピュアですし、ちゃんと不活性ガス雰囲気で密封すれば常温でもそこそこ長持ちします(フェノールなので空気中でほったらかしにすると酸化されて変色してくる)。
まぁ収率は結構下がっちゃいますけどね…(´・ω・`)
というわけで、11ステップもかけて作って、最終生成物もカラム→再結晶→加熱真空引きなんてやるせいで非常に苦労したという思いで話でした。
ここら辺の研究ネタは多いので、次回は触媒のリン酸とか臭素化反応の思い出話でもしようかと思いつつ。















※コメント投稿者のブログIDはブログ作成者のみに通知されます