皮質脊髄路あるいは錐体路(corticospinal tract, CST)は人の能動的な運動に重要であり、脊髄損傷が治癒しない大きな原因はCSTが再生しないことです。遺伝子操作や再生医療によって脊髄損傷を回復させようという試みは古くよりたくさん報告されており、日本では慶應大学グループの研究が有名です。PtenやSocs3遺伝子のノックアウトによって損傷したCST神経の再生が促進されるという報告もありますし、自家神経幹細胞(neural stem cell, NST)や神経前駆細胞(neural progenitor cells, NPC)移植による再生促進の報告もあり、著者らはNPC移植によりCSTを構成する軸索の顕著な再生が認められることを報告しています(Kadoya et al., Nat. Med. 22, 479–487, 2016)。しかし細胞移植によるCST再生のメカニズムはあまり明らかになっていません。この論文で著者らはNPC移植がCST再生を促すメカニズムを検討しました。
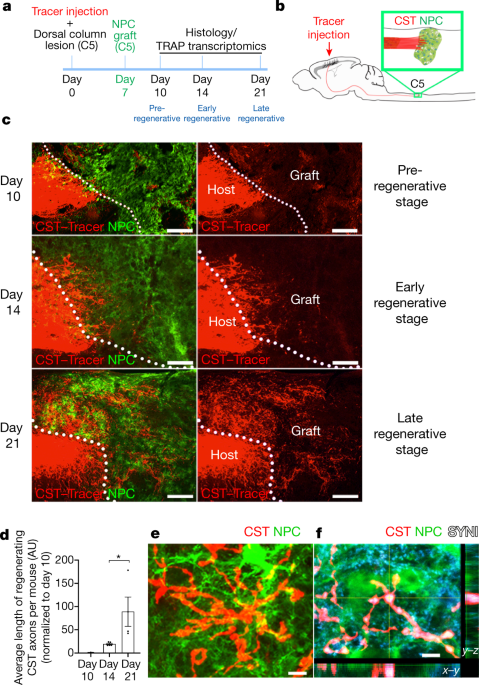
大脳皮質第5層の皮質投射細胞においてeGFPを発現するGlt25d2-eGFP-L10aマウスを用い、成体マウスC5の背側カラム損傷を起こした1週間後にeGFPを発現する胎生12日マウスの脊髄由来NPCを損傷部位に移植しました。脊髄の回復過程は “pre-regenerative” stage, “early regenerative” stage, “late regenerative” stageの3段階に区分することが可能であり、徐々にCST構成軸索が移植したNPCに侵入していく様子が観察されました。この時Glt25d2-eGFP-L10aマウスからCST神経細胞を分離して遺伝子発現を調べました。損傷部にcholera toxin Bを注射して逆行性ラベリングを行った結果、約50%の第5層神経細胞が再生に関与していることが示されました。RNA-seqの結果、軸索再生に伴い、これらの細胞では神経損傷シグナル(neuronal injury signal)の誘導が生じることがわかりました。Gene Ontology analysisでは”stem-cell-like gene families”, “activation of proliferation-, differentiation-, and cell-cycle-progression-related functions”に関係した遺伝子の発現上昇が移植群、非移植群両者でみられ、この中には神経分化に関与することが報告されているSox2やAscl1遺伝子も含まれました。移植群の場合にはこれらの遺伝子発現が損傷後21日を超えても持続するのに対して、非移植群では発現が低下していくことがわかりました。発現遺伝子の中には以前から神経再生に関与することが知られていた遺伝子も多く含まれましたが、興味深いことに、これまで軸索再生などとの関係が知られていなかった遺伝子も見つかってきました。中でもhuntingtin gene (Htt)が制御するnetworkが極めて重要なhubの役割を果たすことも明らかになりました。Httはハンチントン舞踏病の原因遺伝子ですが、ノックアウトマウスは胎生早期に死亡します。Httの生理的な役割は明らかになっていませんが、Creb1やTP53の発現制御やBDNF産生、NFkappaB発現、軸索輸送に関与する可能性が指摘されています。著者らは運動中枢においてHttを欠損したマウスを作成し、このマウスではNPCによるCST再生誘導が60%低下していることが明らかになりました。以上の結果より、NPCの役割はCST構成軸索再生信号の持続的な活性化であり、少なくとも一部にはHttに関係したシグナルが関与している可能性が示されました。現在様々な方法で脊髄損傷治療の可能性が模索されています。日本からは札幌医科大学の間葉系幹細胞移植が臨床応用されています。その作用機序もいまだ明らかにはなっていませんが、HTTの持続的な発現誘導が関与している可能性もあるかと期待されます。
Poplawski et al., Nature https://doi.org/10.1038/s41586-020-2200-5
大脳皮質第5層の皮質投射細胞においてeGFPを発現するGlt25d2-eGFP-L10aマウスを用い、成体マウスC5の背側カラム損傷を起こした1週間後にeGFPを発現する胎生12日マウスの脊髄由来NPCを損傷部位に移植しました。脊髄の回復過程は “pre-regenerative” stage, “early regenerative” stage, “late regenerative” stageの3段階に区分することが可能であり、徐々にCST構成軸索が移植したNPCに侵入していく様子が観察されました。この時Glt25d2-eGFP-L10aマウスからCST神経細胞を分離して遺伝子発現を調べました。損傷部にcholera toxin Bを注射して逆行性ラベリングを行った結果、約50%の第5層神経細胞が再生に関与していることが示されました。RNA-seqの結果、軸索再生に伴い、これらの細胞では神経損傷シグナル(neuronal injury signal)の誘導が生じることがわかりました。Gene Ontology analysisでは”stem-cell-like gene families”, “activation of proliferation-, differentiation-, and cell-cycle-progression-related functions”に関係した遺伝子の発現上昇が移植群、非移植群両者でみられ、この中には神経分化に関与することが報告されているSox2やAscl1遺伝子も含まれました。移植群の場合にはこれらの遺伝子発現が損傷後21日を超えても持続するのに対して、非移植群では発現が低下していくことがわかりました。発現遺伝子の中には以前から神経再生に関与することが知られていた遺伝子も多く含まれましたが、興味深いことに、これまで軸索再生などとの関係が知られていなかった遺伝子も見つかってきました。中でもhuntingtin gene (Htt)が制御するnetworkが極めて重要なhubの役割を果たすことも明らかになりました。Httはハンチントン舞踏病の原因遺伝子ですが、ノックアウトマウスは胎生早期に死亡します。Httの生理的な役割は明らかになっていませんが、Creb1やTP53の発現制御やBDNF産生、NFkappaB発現、軸索輸送に関与する可能性が指摘されています。著者らは運動中枢においてHttを欠損したマウスを作成し、このマウスではNPCによるCST再生誘導が60%低下していることが明らかになりました。以上の結果より、NPCの役割はCST構成軸索再生信号の持続的な活性化であり、少なくとも一部にはHttに関係したシグナルが関与している可能性が示されました。現在様々な方法で脊髄損傷治療の可能性が模索されています。日本からは札幌医科大学の間葉系幹細胞移植が臨床応用されています。その作用機序もいまだ明らかにはなっていませんが、HTTの持続的な発現誘導が関与している可能性もあるかと期待されます。
Poplawski et al., Nature https://doi.org/10.1038/s41586-020-2200-5












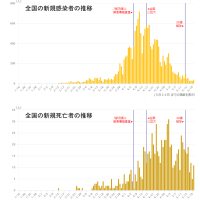
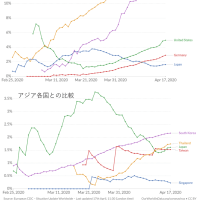
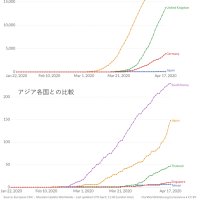
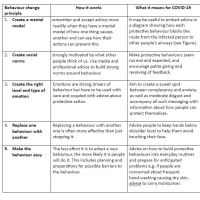
※コメント投稿者のブログIDはブログ作成者のみに通知されます