αβγ の三つのサブユニットからなる三量体Gタンパク質(trimeric G protein)は、細胞内シグナル伝達の分野では古典的ともいえる存在で、1994年のAlfred Goodman GilmanとMartin Rodbellによるノーベル医学・生理学賞受賞をはじめとして、シグナル伝達系や受容体の発見など、何らかの意味でGタンパク質に関係する研究分野は十指に余るノーベル賞受賞者を輩出しています。また現在までに米国FDAが承認した治療薬の何と30%がGタンパク質受容体(G-protein coupled receptors, GPCRs)を標的とするものだそうです。日本からも宇井理生先生による百日咳毒素の研究(Giαを抑制する)や、堅田利明先生によるGiの発見など、世界に誇るべき研究が数多く出ている分野でもあります。
さて細胞内シグナル伝達系を可視化するというイメージングの研究は急速に進歩しており、細胞内カルシウムの可視化をはじめとして、様々なシグナル伝達がリアルタイムで、場合によっては生体内でも観察できるようになっています。典型的なGPCR下流での三量体Gタンパク質シグナルは、受容体へのリガンド結合に伴うGαサブユニットのGDP結合型からGTP結合型への変化(活性化)によってGβγ複合体がGαから分離し、それぞれが異なる細胞内シグナルを活性化するという経路をたどります。これまでの三量体Gタンパク質の細胞内シグナル経路の可視化の取り組みは、FRET(fluorescence resonance energy transfer)あるいはBRET(bioluminescence resonance energy transfer)などの手法を用いて行われてきましたが、GαおよびGβγにそれぞれFRETあるいはBRETのdonor/acceptorを融合させた遺伝子を細胞に発現させ、励起エネルギーによって生じる蛍光などを観察することでこれらの分子の解離を観察するというものでした。この方法の欠点は、①GαとGβγの分離を見ているだけでGαとGTPの結合を検出している訳ではない(たとえばGoLoco GDIはGα-Gβγの分離は促進するが、Gα-GTPの形成を抑制することでGPCRシグナルを抑制する) ②この手法ではGタンパク質自体の過剰発現を行う必要があり、必ずしもendogenousなシグナルを見ていない可能性がある ③数個の遺伝子を同時に過剰発現する必要があり、使える細胞が限られる(ほとんどの研究はHEK293細胞で行われている)などの欠点がありました。著者らは様々な細胞で、できるだけ生理的な状態での三量体Gタンパク質の活性化を検出する手法を開発しました。まず著者らはGαi-GTPを直接検出するために、KB-1753というペプチドを利用しました。KB-1753はGαi-GTPには結合するがGαi-GDPには結合せず、結合は高affinityかつ可逆的で、細胞内に存在するendogenousなGタンパク質にはほとんど影響を与えないペプチドです。KB-1753とBRETのdonorであるNlucとの融合ペプチドをBRET acceptorであるGαi3-YFPとともに細胞に発現することでα2A-adrenergic receptor(α2A-AR)やμ-opioid receptor(MOR)の活性化によってBRETの検出が可能であることを確認しました。そこで彼らはER/K α helicesという可動性の高い配列をBRETのdonorとacceptorのlinkerとして用いることを考えました。つまりER/Kの片端に膜結合配列およびBRET donorであるNlucを、逆端にYFP-KB1753を結合させた分子(BRET biosensor with ER/K linker and YFP, BREKY)を作成しました。Gタンパク質の活性化は膜で生じるので、Gαi-GTPとYFP-KB1753とが結合するとNlucとYFP-KB1753とがBRETを起こすだろうという狙いです。実際に計画通り、Gαi-BERKY3(YFP3分子を用いたもの)を発現した細胞ではα2A-ARやMORの活性化にともない、BRETが観察されました。またGoLoco GDIによる阻害効果も観察可能でした。彼らはGαq, Gα13に対するBERKY、そしてGRK3のC端をdetectorとして用いたGβγ-BERKY3なども作成し、その有用性を確認しています。この手法の優れた点は、BERKYという1つの分子を発現させるだけでendogenousなGタンパク質の動態に影響することなくGタンパク質活性化を可視化できること、そして様々な細胞(癌細胞や神経細胞)にも応用可能であること(場合によってはin vivoにも応用できるかも)、そして多くのGタンパク質に応用可能なことです。今後Gタンパク質シグナルの可視化の分野では中心となる手技だろうと思います。












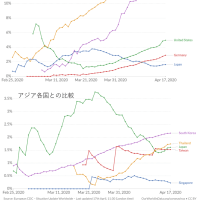
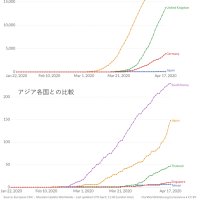
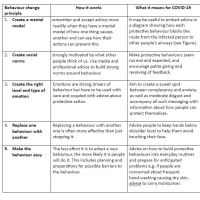
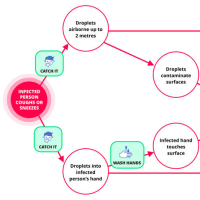
※コメント投稿者のブログIDはブログ作成者のみに通知されます