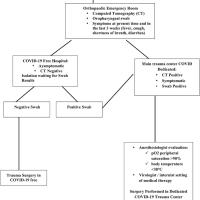
現在用いられているインフルエンザワクチンはウイルス表面のhemagglutinin(HA)およびneuraminidase(NA)に対する中和抗体を誘導することでウイルス感染を抑制するのですが、ウイルスは絶えず抗原ドリフト(抗原連続変異)あるいはシフト(抗原不連続変異)によってこれらの表面抗原を変異させることで宿主の免疫を逃れます。このような抗原不適合が生じるとワクチンの有効性は大きく損なわれるため、不適合を生じないワクチン“universal influenza vaccine”の開発が期待されています。実際にインフルエンザウイルスに感染したり、生ウイルスを投与したりすると自然免疫の活性化を介してこのような反応が生じますが、もちろんリスクを伴います。より安全な非増殖型(不活化)ウイルスで直接肺胞にこのような反応を誘導するためには強いアジュバントの存在が必要ですが、肺胞に存在するサーファクタントによってアジュバントの効果は妨げられてしまいます。著者らはサーファクタントに類似したliposomeで包み込んだ自然免疫誘導アジュバント(2’,3’-cyclic guanosine monophosphate–adenosine monophosphate, cGAMP:stimulator of interferon genes [STING]のアゴニスト)の鼻腔内への投与によって、肺胞サーファクタントに阻止されることなく肺の抗原提示細胞や肺胞上皮細胞にインターフェロンの誘導が可能であることを明らかにしました(著者らはこのliposomeをPS-GAMPと名付けています)。驚くべきことに、このアジュバントを不活化したH1N1インフルエンザ抗原とともにマウス鼻腔に投与すると、H1N1のみならずH3N2, H5N1, H7N9などに対する抵抗性をわずか2日で誘導できることが明らかになりました。この効果は肺局所におけるCD8+ resident memory T cells(TRM cells)の誘導を介すると考えられ、少なくとも6カ月は持続します。マウスのみならず米国FDAがインフルエンザモデルとして認めているフェレット感染モデルにおいても同様の効果が示されました。非常に洗練されたアプローチであり、ウイルス性肺炎に対するワクチン開発において重要な成果だと思います。今後インフルエンザだけではなく、COVID-19ワクチン開発にも応用できる可能性があるのではないでしょうか。研究の進展を祈ります。
Science. 2020 Feb 21;367(6480). pii: eaau0810. doi: 10.1126/science.aau0810.












※コメント投稿者のブログIDはブログ作成者のみに通知されます