男性と女性では体形が異なることからも分かるように、脂肪組織の代謝が性別で異なっていることは以前から知られていました(White et al., Biochim. Biophys. Acta 1842, 377–392, 2014など)。男性では同年代の女性と比べると耐糖能が悪く、それに随伴する高インスリン血症が見られますが、アディポカインに違いはありません。この論文では内臓脂肪に存在するT細胞の違いが男女差を決定している可能性を示しています。
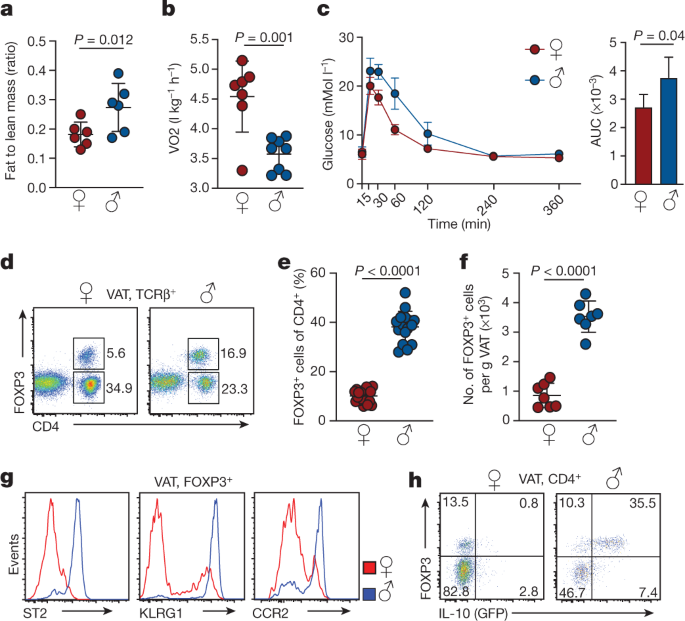
脂肪組織は重要なインスリンの標的組織ですが、内臓脂肪(visceral adipose tissue, VAT)における代謝制御には免疫細胞、中でも制御性T細胞(Treg)が重要な役割を果たすことが知られています。マウスでは、VAT中に存在するTreg(VAT Treg)数がメスと比べてオスで多く、オスのVAT TregではIL-33受容体ST2、成熟マーカーKLRG1およびケモカイン受容体CCR2の高発現をみとめ、また免疫抑制性サイトカインであるIL-10の発現も高いことがわかりました。オスVAT Tregの遺伝子発現プロファイルは、脾臓中Tregとも、メスVAT Tregとも大きく異なっていました。このような違いには性ホルモンが関与しており、アンドロゲン受容体(Ar)欠損のオスではVAT Treg数の減少とST2, KLRG1, CCR2遺伝子発現の低下(メス化)、エストロゲン受容体α欠損のメスではVAT Treg数の増加とST2, KLRG1, CCR2遺伝子発現の上昇(オス化)を認めました。Tregのオス化、メス化は外的な要因によるものであり、次に性ホルモン依存的なニッチがVAT Treg特異的な形質を規定していると考えられました。性特異的なVATニッチの性状を調べるためにVATの遺伝子発現を検討しました。皮下脂肪と比較して、VATにおいてはIl33とともにCcl2, Tnf, Il1b炎症性遺伝子の発現が高く、特にオスVATにおいてはTnf, Ccl2, Il1bなど炎症にかかわる遺伝子、組織線維化にかかわる遺伝子Col6a5、そしてプロスタグランジン代謝に関与する遺伝子Hpgdsが上昇していました。オスVAT Tregにおいて高レベルのCCR2発現がみられ、そのリガンドであるCCL2がVATで見られることから、Tregは脾臓からCCL2によってrecruitされると考えられました。またVATにおいてIL-33を発現しているGp38+ stromal cellはメスのほうが少なく、その数は性ホルモン依存的であることも明らかになりました。オスVAT TregではBLIMP1の発現が増加しており、Treg特異的にBlimp1をノックアウトしたマウスではVAT Treg数が減少していました。
以上の結果から、メスではVATにおける炎症はエストロゲンで抑制されていますが、オスではIL-33を発現するstromal cellによってTregがVATにリクルートされ、局所的に増殖して、VATの炎症を惹起している可能性が示唆されました。
Vasanthakumar, A., Chisanga, D., Blume, J. et al. Sex-specific adipose tissue imprinting of regulatory T cells. Nature 579, 581–585 (2020). https://doi.org/10.1038/s41586-020-2040-3












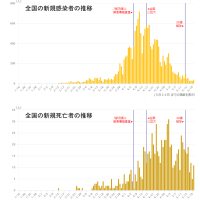
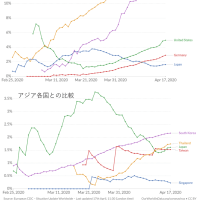
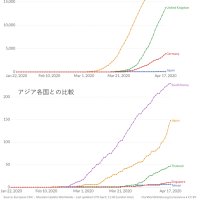
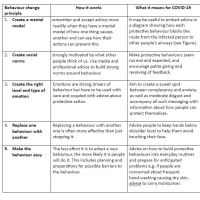
※コメント投稿者のブログIDはブログ作成者のみに通知されます