新型コロナウイルス感染症の流行のせいで体温計が品薄になっているようです。今は削除されていますが、流行当初は感染の徴候として「37.5度以上が4日間続く」というような目安が提示されていましたが、体温に関してはわずか0.5度違いが大きな意味を持つことからもわかるように、生体において体温は極めて厳密に調節されています。体温の調節機構には脳が極めて重要な役割を果たしており、中でも視床下部の最吻側に位置する視索前野(preoptic area)と呼ばれる領域は体温調節中枢として作用し、感染時の発熱を指令する発熱中枢でもあることが明らかになっています(Morrison and Nakamura,Annu Rev Physiol. 2019 Feb 10;81:285-308)。その一方で動物では冬眠(hibernation)や非活動状態(torpor)という状態が知られており、不活動になるだけではなく体温の低下や代謝の低下が見られます。このような状態もまた脳によって調節されていると考えられますが、その詳細は明らかではありませんでした。今回Natureに発表された2報の論文は、それぞれ異なるアプローチを用いて冬眠や非活動状態を制御するneuronの同定を報告しています。
-------------
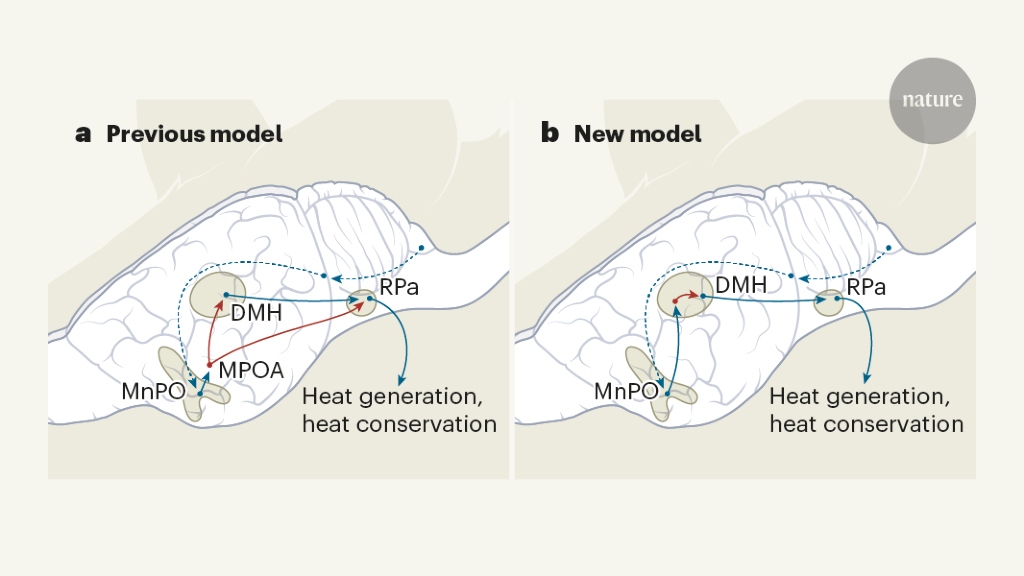
筑波大学と理化学研究所のグループはpyroglutamylated RFamide peptide (QRFP) というペプチドに注目しました。QRFPは元々bioinformaticsによって同定されましたが、摂食や交感神経制御、不安などに関与していることが明らかになっています。QRFPは視床下部に特異的に発現しますが、中でも外側野(lateral hypothalamic area, LHA)、灰白隆起(tuber cinereum)、周室核(periventricular nucleus)で高い発現が見られます。著者らはQRFP産生neuronに特異的にiCreを発現するマウス(QrfpiCreマウス)を用いて、DREADD(designer receptors exclusively activated by designer drugs)agonistであるclozapine-N-oxide(CNO) によってQrfp発現neuron(Q neuron)を活性化すると、褐色脂肪組織(brown adipose tissue, BAT)が豊富な部位の皮膚温とともに体温の低下や不活動が誘導されることを見出しました。またアデノ随伴ウイルスベクターを用いてQrfpiCreマウスのneuronにhM3Dq-mCherry発現を誘導し、CNO依存的にhM3Dq発現neuronを活性化することができるマウスを作成しました。このマウスを用いて、前腹側脳室周囲核(anteroventral periventricular nucleus, AVPe)および内側視索前野(medial preoptic area, MPA)のneuronを特異的に活性化したところ、体温低下、運動低下が見られることがわかりました。BATの著しい温度低下(20度以下)は48時間以上持続し、酸素消費量も低下していました。このような状態(Q-neuron-induced hypothermia and hypometabolism, QIH)においては、呼吸数や心拍数も低下し、脳波の振幅も低下しており、体重も減少しました。CNOの効果がなくなってもすぐに戻ることはなく、徐々に体重は回復しました。回復後は脳や臓器の障害は見られず、行動にも異常はありませんでした。つまりQIHは冬眠と類似した状態であると考えられました。次にQ neuronが投射するneuronをオプトジェネティクスの手法で活性化することで、Q neuronは視床下部背内側部(dorsomedial hypothalamus, DMH)に作用することでQIHを誘導することを示しました。またQ neuronの中でvesicular glutamate transporter 2 (VGLUT2) を発現する興奮性neuronおよびvesicular GABA transporter(VGAT)を発現する抑制性neuronが協調してQIHの誘導に働き、特にVGLUT2発現neuronがQIHの誘導に重要な役割を果たすことも明らかになりました。
一方Harvard大学のMichael E.Greenbergらのグループはマウスを飢餓状態においた際に運動低下と体温低下が生じる非活動状態(torpor)に着目し、この時活性化するneuronとして内側・外側視索前野の前腹側領域(the anterior and ventral portions of the medial and lateral preoptic area, avMLPA)が重要であることを明らかにしました。またこの時活性化するneuronをsingle-nucleus RNA-sequencing(snRNA-seq)でサブグループに分けることにより、glutaminergic Adcyap1陽性のneuronを同定しました。このneuronを刺激するとtorporが誘導され、このneuronを欠失させるとtordorの誘導が抑制されました。
冬眠とtorporは異なる現象のようですが、これらの研究から視索前野preoptic areaに存在する様々な種類のneuronが体温のセットポイントを制御している可能性が示されました。同定されたこれらのneuronがどのような相互作用を有しているのかも興味深いところです。またヒトにおいても同様のメカニズムがあるとすれが、脳梗塞時の低体温療法のような新たな治療法開発にもつながる可能性があります。それにしてもこのように精緻な脳領域の機能同定が可能であるというneuroscienceの進歩にも本当に驚かされます。
-------------
筑波大学と理化学研究所のグループはpyroglutamylated RFamide peptide (QRFP) というペプチドに注目しました。QRFPは元々bioinformaticsによって同定されましたが、摂食や交感神経制御、不安などに関与していることが明らかになっています。QRFPは視床下部に特異的に発現しますが、中でも外側野(lateral hypothalamic area, LHA)、灰白隆起(tuber cinereum)、周室核(periventricular nucleus)で高い発現が見られます。著者らはQRFP産生neuronに特異的にiCreを発現するマウス(QrfpiCreマウス)を用いて、DREADD(designer receptors exclusively activated by designer drugs)agonistであるclozapine-N-oxide(CNO) によってQrfp発現neuron(Q neuron)を活性化すると、褐色脂肪組織(brown adipose tissue, BAT)が豊富な部位の皮膚温とともに体温の低下や不活動が誘導されることを見出しました。またアデノ随伴ウイルスベクターを用いてQrfpiCreマウスのneuronにhM3Dq-mCherry発現を誘導し、CNO依存的にhM3Dq発現neuronを活性化することができるマウスを作成しました。このマウスを用いて、前腹側脳室周囲核(anteroventral periventricular nucleus, AVPe)および内側視索前野(medial preoptic area, MPA)のneuronを特異的に活性化したところ、体温低下、運動低下が見られることがわかりました。BATの著しい温度低下(20度以下)は48時間以上持続し、酸素消費量も低下していました。このような状態(Q-neuron-induced hypothermia and hypometabolism, QIH)においては、呼吸数や心拍数も低下し、脳波の振幅も低下しており、体重も減少しました。CNOの効果がなくなってもすぐに戻ることはなく、徐々に体重は回復しました。回復後は脳や臓器の障害は見られず、行動にも異常はありませんでした。つまりQIHは冬眠と類似した状態であると考えられました。次にQ neuronが投射するneuronをオプトジェネティクスの手法で活性化することで、Q neuronは視床下部背内側部(dorsomedial hypothalamus, DMH)に作用することでQIHを誘導することを示しました。またQ neuronの中でvesicular glutamate transporter 2 (VGLUT2) を発現する興奮性neuronおよびvesicular GABA transporter(VGAT)を発現する抑制性neuronが協調してQIHの誘導に働き、特にVGLUT2発現neuronがQIHの誘導に重要な役割を果たすことも明らかになりました。
一方Harvard大学のMichael E.Greenbergらのグループはマウスを飢餓状態においた際に運動低下と体温低下が生じる非活動状態(torpor)に着目し、この時活性化するneuronとして内側・外側視索前野の前腹側領域(the anterior and ventral portions of the medial and lateral preoptic area, avMLPA)が重要であることを明らかにしました。またこの時活性化するneuronをsingle-nucleus RNA-sequencing(snRNA-seq)でサブグループに分けることにより、glutaminergic Adcyap1陽性のneuronを同定しました。このneuronを刺激するとtorporが誘導され、このneuronを欠失させるとtordorの誘導が抑制されました。
冬眠とtorporは異なる現象のようですが、これらの研究から視索前野preoptic areaに存在する様々な種類のneuronが体温のセットポイントを制御している可能性が示されました。同定されたこれらのneuronがどのような相互作用を有しているのかも興味深いところです。またヒトにおいても同様のメカニズムがあるとすれが、脳梗塞時の低体温療法のような新たな治療法開発にもつながる可能性があります。それにしてもこのように精緻な脳領域の機能同定が可能であるというneuroscienceの進歩にも本当に驚かされます。
Takahashi, T.M., Sunagawa, G.A., Soya, S. et al. A discrete neuronal circuit induces a hibernation-like state in rodents. Nature (2020). https://doi.org/10.1038/s41586-020-2163-6
Hrvatin, S., Sun, S., Wilcox, O.F. et al. Neurons that regulate mouse torpor. Nature (2020). https://doi.org/10.1038/s41586-020-2387-5
Clifford B. Saper & Natalia L. S. Machado. Flipping the switch on the
thermoregulatory system. Nature https://doi.org/10.1038/d41586-020-01600-5
thermoregulatory system. Nature https://doi.org/10.1038/d41586-020-01600-5