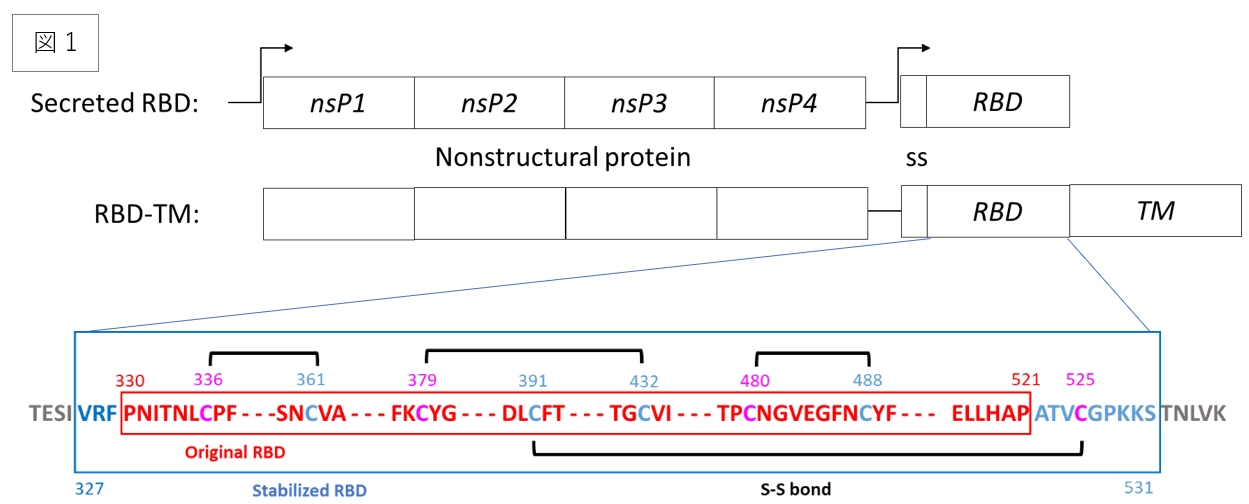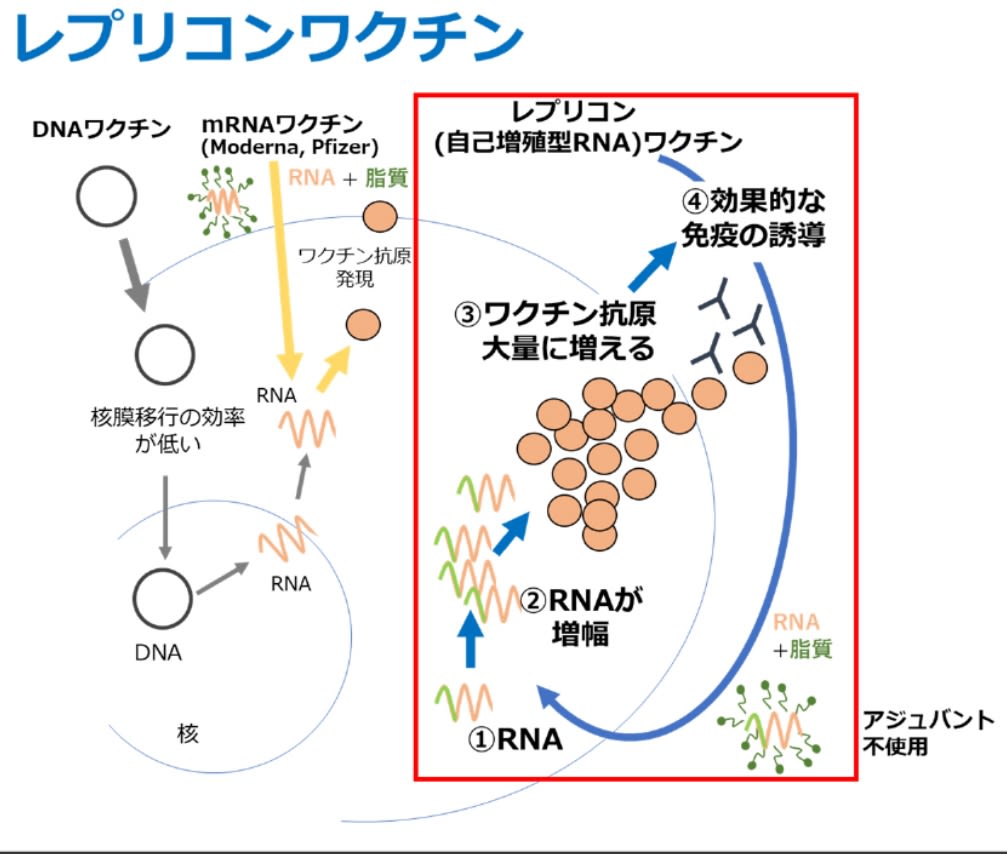
レプリコンワクチンを接種すると、長期間、体内でmRNAが複製されていくのだそうです。今までのコロナワクチンがあんな感じだっただけに、安全性には問題がないのか、心配になります。
最も怖いことは、人から人にワクチンが伝染していく可能性です。だって、体内でmRNAが量産されるわけですから。大丈夫だという説明もありますが、村上名誉教授は可能性ありだと恐れているようです。
「新規自己増殖型RNAワクチンはCOVID-19に対する持続的な予防効果を示し、霊長類試験においてウイルス排出を減少させた」News-Medical
by Pooja Toshniwal Paharia Apr 23 2023
PLOS Pathogens誌に掲載された最近の研究で、米国の研究者らは、コロナウイルス疾患2019(COVID-19)を発症したブタマカザルを用いて、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する新規の自己増殖型レプリコンリボ核酸(RNA)ワクチンを評価した。
COVID-19の大流行による前例のない罹患率と死亡率から、SARS-CoV-2に対するワクチンの開発が急速に進んだ。広範なワクチン接種が行われているにもかかわらず、COVID-19の健康上の負担は増大し続けている。これは、感染性が高まり、免疫侵襲性の懸念されるSARS-CoV-2亜型(VOCs)の継続的な出現と、COVID-19ワクチンや以前のSARS-CoV-2感染で得られた体液性免疫の衰えによるものである。したがって、COVID-19の治療法を広げるために新規治療薬が必要とされている。
研究結果 レプリコンRNAワクチンは、中和抗体が弱まった後も、非ヒト霊長類においてSARS-CoV-2からの持続的な防御免疫を誘導することができる。画像出典:NIAIDStudy: レプリコンRNAワクチンは、中和抗体が弱まった後でも、非ヒト霊長類においてSARS-CoV-2から持続的な防御免疫を誘導することができる。
研究について
今回の研究で、研究者らはヒト以外の霊長類を対象に、新しい自己増幅型レプリコンRNA(repRNA)COVID-19ワクチンの有効性を評価した。
研究チームは、SARS-CoV-2スパイク(S)糖タンパク質をコードするα-ウイルス抽出レプリコンリボ核酸(repRNA)ワクチン(repRNA-CoV2S)が、中和抗体(nAb)反応がピークであったとき、および中和抗体(nAb)反応が減弱した後に、ワクチン接種を受けたブタオマキザルの免疫防御を調べた。研究チームは、ヒトで最も有効であろう最小投与量、投与量、投与間隔を評価した。ある研究コホートで得られたデータを次のグループのワクチン接種レジメンの決定に役立てるため、個人の登録時期をずらすという用量デスカレーション戦略が用いられた。
50.0μg投与群の免疫学的応答を、20.0週間の間隔をおいて25.0μg投与でブーストした別のワクチン接種非ヒト霊長類群の免疫学的応答と比較した。さらに、6週間の間隔で投与した5.0μgワクチン用量によるプライミングとブースティングを検討した。SARS-CoV-2 VoCのS蛋白に対する交差防御結合抗体(bAb)反応は、酵素結合免疫吸着法(ELISA)を用いて測定した。nAb力価は、80.0%プラーク還元中和試験(PRNT80)を用いて測定した。
血清学的抗Sインターフェロンγ(IFN-γ)分泌Tリンパ球応答は、末梢血単核球(PBMC)分離株を用いてELISPOTアッセイを行うことにより測定した。ウイルス量は、1.0日目、3.0日目、5.0日目、7.0日目に採取した鼻腔スワブ検体、3.0日目、5.0日目、7.0日目に採取した気管支肺胞洗浄(BAL)検体、SARS-CoV-2チャレンジ後7.0日目に採取した肺組織検体を用いて測定した。サブゲノムSARS-CoV-2 RNAレベルは、定量的逆転写ポリメラーゼ連鎖反応(qRT-PCR)を用いて測定した。
結果
自己増幅型repRNAワクチンは、相同SARS-CoV-2株に対して強力なbAbおよびnAb反応を誘導した。さらに、祖先株といくつかのVOCに対して広範なbAbが観察されたが、nAb力価は主に祖先株であるWuhan-Hu-1株に対して観察された。ワクチン接種後7ヵ月以内にnAb力価は無視できるレベルまで低下したにもかかわらず、持続的なbAb力価と迅速なアナムネティックリコール反応が観察され、これはウイルスチャレンジ後のSARS-CoV-2感染と肺疾患に対する免疫防御を媒介する可能性がある。
研究結果は、SARS-CoV-2ワクチン接種に対する防御的免疫記憶が持続し、検出可能なnAb力価がない場合でも、迅速な免疫学的想起応答がSARS-CoV-2を防御する可能性を示した。研究チームは、SARS-CoV-2の増殖が抑制され、呼吸器官の病理学的変化も重篤でなくなったこと、鼻腔におけるSARS-CoV-2の排出が減少したこと、肺組織における炎症性サイトカインレベルが低下したことを証明した。
SARS-CoV-2感染に対して、様々なワクチン投与量と異なるワクチン接種レジメンで霊長類を防御することができた。さらに、SARS-CoV-2感染時に中和抗体がない場合でも、数頭のサルでは防御された。したがって、SARS-CoV-2への曝露時に検出可能なnAb力価が欠如していたとしても、Tリンパ球や結合抗体を含む他の免疫学的経路が免疫レベルを調節している可能性がある。
250.0μgのワクチン投与量は、1回のワクチン接種のみで強固な免疫学的応答を誘発した。この用量は、当初、実現可能な最高用量でワクチンの免疫原性と安全性を評価するために用いられた。25.0μgのブースター用量を1回接種すると、ワクチン接種後6週目に抗SARS-CoV-2 S免疫グロブリンG(IgG)抗体が誘導され、28.0日間隔で50.0μgの用量を2回接種した場合と同様の体液性免疫防御をマカクに与えた。1回接種後のAb力価は上昇を続けたため、初回接種から4週間以内にブースター投与を行った場合、さらなる免疫効果は得られない可能性があった。
プライムワクチンとブースターワクチンの投与間隔を長くすれば、より強固な免疫学的応答が得られる可能性がある。さらに、プライムワクチン接種後のサルでは、SARS-CoV-2 VOCのSタンパク質であるアルファVOC、ベータVOC、デルタVOC、オミクロンBA.2 VOC、BA.5 VOC、およびBQ.1.1 VOCに対して交差防御結合抗体が観察されたが、オミクロンBA.4/5およびオミクロンBQ.1.1 VOCに対しては観察されなかった。さらに、5.0μgのプライムワクチンとブースターワクチン接種の2週間後に測定したIgG力価は同等であった。
25.0μgの用量は最大Tリンパ球応答を十分に誘導し、ブースターワクチン接種はTリンパ球応答を改善するが、5.0μg用量は末梢血中のTリンパ球を有意に誘導するのに必要なカットオフ値を下回っている可能性がある。解析の結果、5.0μgの用量はnAb応答を誘導するのに最適な用量ではなく、プライムワクチン接種とブースターワクチン接種の間隔を長くすれば、より持続的で強固な免疫防御が得られることが示された。
全体として、霊長類以外の動物において、nAb反応がごくわずかであっても、repRNAワクチンはSARS-CoV-2に対する長期的な免疫防御をもたらすことが示された。
参考文献
O'Connor MA, Hawman DW, Meade-White K, Leventhal S, Song W, Randall S, et al. (2023) A replicon RNA vaccine canduce durable protective immunity from SARS-CoV-2 in non-human primates after wanned neutralizing antibodies. PLoS Pathog 19(4): e1011298. DOI: https://doi.org/10.1371/journal.ppat.1011298, https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1011298
by Pooja Toshniwal Paharia Apr 23 2023
PLOS Pathogens誌に掲載された最近の研究で、米国の研究者らは、コロナウイルス疾患2019(COVID-19)を発症したブタマカザルを用いて、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する新規の自己増殖型レプリコンリボ核酸(RNA)ワクチンを評価した。
COVID-19の大流行による前例のない罹患率と死亡率から、SARS-CoV-2に対するワクチンの開発が急速に進んだ。広範なワクチン接種が行われているにもかかわらず、COVID-19の健康上の負担は増大し続けている。これは、感染性が高まり、免疫侵襲性の懸念されるSARS-CoV-2亜型(VOCs)の継続的な出現と、COVID-19ワクチンや以前のSARS-CoV-2感染で得られた体液性免疫の衰えによるものである。したがって、COVID-19の治療法を広げるために新規治療薬が必要とされている。
研究結果 レプリコンRNAワクチンは、中和抗体が弱まった後も、非ヒト霊長類においてSARS-CoV-2からの持続的な防御免疫を誘導することができる。画像出典:NIAIDStudy: レプリコンRNAワクチンは、中和抗体が弱まった後でも、非ヒト霊長類においてSARS-CoV-2から持続的な防御免疫を誘導することができる。
研究について
今回の研究で、研究者らはヒト以外の霊長類を対象に、新しい自己増幅型レプリコンRNA(repRNA)COVID-19ワクチンの有効性を評価した。
研究チームは、SARS-CoV-2スパイク(S)糖タンパク質をコードするα-ウイルス抽出レプリコンリボ核酸(repRNA)ワクチン(repRNA-CoV2S)が、中和抗体(nAb)反応がピークであったとき、および中和抗体(nAb)反応が減弱した後に、ワクチン接種を受けたブタオマキザルの免疫防御を調べた。研究チームは、ヒトで最も有効であろう最小投与量、投与量、投与間隔を評価した。ある研究コホートで得られたデータを次のグループのワクチン接種レジメンの決定に役立てるため、個人の登録時期をずらすという用量デスカレーション戦略が用いられた。
50.0μg投与群の免疫学的応答を、20.0週間の間隔をおいて25.0μg投与でブーストした別のワクチン接種非ヒト霊長類群の免疫学的応答と比較した。さらに、6週間の間隔で投与した5.0μgワクチン用量によるプライミングとブースティングを検討した。SARS-CoV-2 VoCのS蛋白に対する交差防御結合抗体(bAb)反応は、酵素結合免疫吸着法(ELISA)を用いて測定した。nAb力価は、80.0%プラーク還元中和試験(PRNT80)を用いて測定した。
血清学的抗Sインターフェロンγ(IFN-γ)分泌Tリンパ球応答は、末梢血単核球(PBMC)分離株を用いてELISPOTアッセイを行うことにより測定した。ウイルス量は、1.0日目、3.0日目、5.0日目、7.0日目に採取した鼻腔スワブ検体、3.0日目、5.0日目、7.0日目に採取した気管支肺胞洗浄(BAL)検体、SARS-CoV-2チャレンジ後7.0日目に採取した肺組織検体を用いて測定した。サブゲノムSARS-CoV-2 RNAレベルは、定量的逆転写ポリメラーゼ連鎖反応(qRT-PCR)を用いて測定した。
結果
自己増幅型repRNAワクチンは、相同SARS-CoV-2株に対して強力なbAbおよびnAb反応を誘導した。さらに、祖先株といくつかのVOCに対して広範なbAbが観察されたが、nAb力価は主に祖先株であるWuhan-Hu-1株に対して観察された。ワクチン接種後7ヵ月以内にnAb力価は無視できるレベルまで低下したにもかかわらず、持続的なbAb力価と迅速なアナムネティックリコール反応が観察され、これはウイルスチャレンジ後のSARS-CoV-2感染と肺疾患に対する免疫防御を媒介する可能性がある。
研究結果は、SARS-CoV-2ワクチン接種に対する防御的免疫記憶が持続し、検出可能なnAb力価がない場合でも、迅速な免疫学的想起応答がSARS-CoV-2を防御する可能性を示した。研究チームは、SARS-CoV-2の増殖が抑制され、呼吸器官の病理学的変化も重篤でなくなったこと、鼻腔におけるSARS-CoV-2の排出が減少したこと、肺組織における炎症性サイトカインレベルが低下したことを証明した。
SARS-CoV-2感染に対して、様々なワクチン投与量と異なるワクチン接種レジメンで霊長類を防御することができた。さらに、SARS-CoV-2感染時に中和抗体がない場合でも、数頭のサルでは防御された。したがって、SARS-CoV-2への曝露時に検出可能なnAb力価が欠如していたとしても、Tリンパ球や結合抗体を含む他の免疫学的経路が免疫レベルを調節している可能性がある。
250.0μgのワクチン投与量は、1回のワクチン接種のみで強固な免疫学的応答を誘発した。この用量は、当初、実現可能な最高用量でワクチンの免疫原性と安全性を評価するために用いられた。25.0μgのブースター用量を1回接種すると、ワクチン接種後6週目に抗SARS-CoV-2 S免疫グロブリンG(IgG)抗体が誘導され、28.0日間隔で50.0μgの用量を2回接種した場合と同様の体液性免疫防御をマカクに与えた。1回接種後のAb力価は上昇を続けたため、初回接種から4週間以内にブースター投与を行った場合、さらなる免疫効果は得られない可能性があった。
プライムワクチンとブースターワクチンの投与間隔を長くすれば、より強固な免疫学的応答が得られる可能性がある。さらに、プライムワクチン接種後のサルでは、SARS-CoV-2 VOCのSタンパク質であるアルファVOC、ベータVOC、デルタVOC、オミクロンBA.2 VOC、BA.5 VOC、およびBQ.1.1 VOCに対して交差防御結合抗体が観察されたが、オミクロンBA.4/5およびオミクロンBQ.1.1 VOCに対しては観察されなかった。さらに、5.0μgのプライムワクチンとブースターワクチン接種の2週間後に測定したIgG力価は同等であった。
25.0μgの用量は最大Tリンパ球応答を十分に誘導し、ブースターワクチン接種はTリンパ球応答を改善するが、5.0μg用量は末梢血中のTリンパ球を有意に誘導するのに必要なカットオフ値を下回っている可能性がある。解析の結果、5.0μgの用量はnAb応答を誘導するのに最適な用量ではなく、プライムワクチン接種とブースターワクチン接種の間隔を長くすれば、より持続的で強固な免疫防御が得られることが示された。
全体として、霊長類以外の動物において、nAb反応がごくわずかであっても、repRNAワクチンはSARS-CoV-2に対する長期的な免疫防御をもたらすことが示された。
参考文献
O'Connor MA, Hawman DW, Meade-White K, Leventhal S, Song W, Randall S, et al. (2023) A replicon RNA vaccine canduce durable protective immunity from SARS-CoV-2 in non-human primates after wanned neutralizing antibodies. PLoS Pathog 19(4): e1011298. DOI: https://doi.org/10.1371/journal.ppat.1011298, https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1011298