コロナ新タイプmRNAワクチン「レプリコンワクチン」国内承認
2023年11月28日 19時24分
新型コロナワクチン(日本国内)
海外で開発された、「レプリコンワクチン」と呼ばれる、新型コロナウイルスに対する新しいタイプのmRNAワクチンが、28日、国内で承認されました。申請した製薬会社は、今後、変異ウイルスに対応したワクチンを開発した上で、来年の秋や冬の接種を目指すとしています。
承認されたのは、製薬会社の「Meiji Seika ファルマ」が申請していた、従来株の新型コロナウイルスに対する「レプリコンワクチン」と呼ばれるタイプのワクチンです。
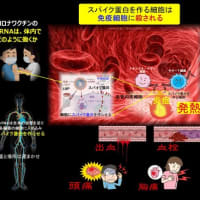
このワクチンは海外で開発されたもので、接種した新型コロナウイルスのmRNAが体内で複製される新たな技術を使っているため、少量で効果が長続きするということです。
会社などによりますと、このタイプのワクチンが承認されるのは世界で初めてだということです。
会社では今後、変異ウイルスに対応したこのタイプのワクチンを開発した上で、来年の秋や冬の接種での供給を目指すということで、製造は福島県南相馬市の工場などで進める計画だということです。
会見した「Meiji Seika ファルマ」の小林大吉郎社長は、「今後、変異ウイルスに対応させる必要はあるが、世界に先駆けて新世代のワクチンの実用化の道が開けたと考えている」と話していました。
新型コロナウイルス感染症に対する次世代mRNAワクチン(レプリコン) 「コスタイベ筋注用」の国内製造販売承認取得に関するお知らせ ~次世代mRNAワクチン(レプリコン)として世界で初めての承認~
MeijiSeikaファルマ株式会社(本社:東京都中央区、代表取締役社長:小林大吉郎、以下Meiji Seikaファルマ) はArcturus Therapeutics Inc.が開発した新型コロナウイルス感染症に対する次世代mRNAワクチン (レプリコン)「コスタイベ筋注用」(開発コード:ARCT-154) について、本日、「SARS-CoV-2による感染症の予防」を適応とした成人の初回免疫および追加免疫における国内製造販売承認を取得しましたのでお知らせします。今回の承認は、次世代mRNAワクチン(レプリコン)として世界で初めての承認となります。
「コスタイベ筋注用」は、新規sa-mRNA技術を使用したワクチンであり、細胞内にmRNAが送達されると自己増幅されるよう設計されています。そのため、既存ワクチンよりも少ない接種量で高い中和抗体価が持続するのが特徴です。なお、増幅期間は短期であり、安全性に問題は認められていません。
国内で実施した追加免疫第III相臨床試験では、起源株及びオミクロンBA.4-5株に対する中和抗体価が対照とした既存ワクチンよりも高いことが確認され(p<0.05)、さらに、それぞれの中和抗体価は6ヵ月間持続することが確認されております。また、接種量が少ないため安全性プロファイルも良好な結果が得られています。有害事象の多くが軽度又は中等度で一過性のものであり、本剤接種と因果関係がある重度又は重篤な有害事象は認められませんでした。
Meiji SeikaファルマはCSL Seqirusと日本国内における供給・販売提携に関する契約を締結しており、製造については、株式会社ARCALISと連携し、福島県南相馬市の製造施設で原薬から製剤まで国内で一貫して製造できる体制の構築を進めています。現在、変異株対応の追加的な臨床試験を進めており、来年の秋冬接種に向け1日も早い実用化を目指してまいります。
Booster dose of self-amplifying SARS-CoV-2 RNA vaccine vs. mRNA vaccine: a phase 3 comparison of ARCT-154 with Comirnaty
Oda et al. (2023) medRxiv
https://www.medrxiv.org/content/10.1101/2023.07.13.23292597v1.full.pdf
自己増幅型SARS-CoV-2 RNAワクチンのブースター投与とmRNAワクチンの比較:ARCT-154とComirnatyの第3相比較試験
ARCT-154は、SARS-CoV-2の最も早く検出された変異型の一つであるD614G変異を持つB.1のSタンパク質をコードしている。
ARCT-154試験用ワクチンは、脂質ナノ粒子に封入されたsa-mRNA (自己増殖型mRNA) から構成されている。このRNAはベネズエラウマ脳炎ウイルス (VEEV) に基づくレプリコンで、VEEVの構造蛋白をコードするRNAがSARS-CoV-2 D614G変異体の完全長スパイク (S) 糖蛋白をコードするRNAに置き換えられている。
2023.12.1武見敬三厚生労働大臣定例会見
https://x.com/hide_Q_/status/1730931739063947310?s=20
「今般承認したレプリコンワクチンは国内外の臨床試験において一定の発症予防効果や中和抗体価の上昇が確認された事、また有害事象の種類や発現割合などにファイザー社ワクチンと比べて明確な差が認められず安全性は許容可能と判断できた事から薬事承認を行いました。レプリコンワクチンは接種後に抗原タンパクをコードするmRNAが細胞内で複製をされて持続的に抗原タンパクが作られるワクチンである事からご指摘のようなワクチンの被接種者から当該ワクチンに含まれる物質等が他の物に伝播するような事象は今のところ確認されておりません。」
このたびの製造販売承認申請は、ベトナムで実施された16,000人以上を対象とした初回免疫における安全性、免疫原性、有効性を評価した第III相臨床試験(NCT05012943)において、主要評価項目であるCOVID-19の発症予防効果が評価基準を達成した成績に基づいた申請です。なお、追加免疫に関しては、2022年12月13日よりMeiji Seikaファルマが安全性と免疫原性を評価するため日本国内での追加免疫第III相臨床試験を実施しており、2023年2月に登録を完了しています。













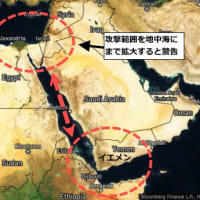


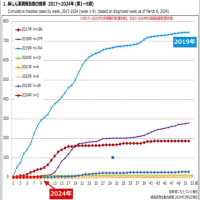







※コメント投稿者のブログIDはブログ作成者のみに通知されます