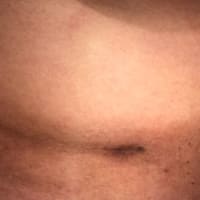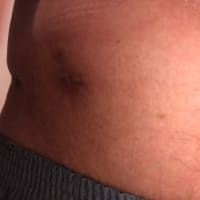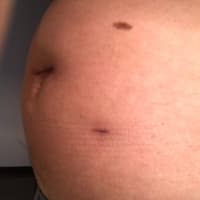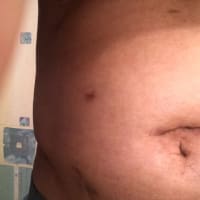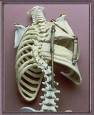
米国VEPTR.COMの History of the Deviceのページより :
http://www.veptr.com/wiki/History%20of%20the%20device.ashx
このVEPTRというデバイスの歴史 (2008年3月12日改訂)
このデバイスの開発は1987年にさかのぼります。胸部外科研究所のスタッフであり
健康科学センターの小児外科教授のD.Smith医師が、胸壁欠損の新生児である
Christopher Cardenasのレントゲン写真を携えてCampbell先生を訪れたときがその
第一歩ということになります。この赤ん坊を救う唯一の方法は、人工の胸壁を作る
ことであり、そしてそれは成功することができました。さらに2年後、工学部の生徒
として大学で再び学びだしていたCampbell医師は、チタン製人工肋骨を開発し、2歳
になっていたChristopherにインプラントする準備ができていました。手術は成功し
Christopherはいまは17歳となり、サンアントニオに住んでいます。
チタン製人工肋骨は、胸郭(肋骨に囲まれた胸)のような形状をしており、外来で
六ヶ月ごとにデバイス延長が出来るような構造となっています。この人工肋骨は
生後6ヶ月から骨未成熟のこども、およそ14歳程の女子あるいは16歳程の男子を
対象として手術することができます。Campbell医師によれば、「できるだけ早い
時期に手術することがベターである」と述べています。「肺(細胞の数の)増大は2歳
までに最大になるからです」。この人工肋骨はチタンでできており、非常に軽く、
生体適合性に優れ、またMRI検査でも画像が大きく乱れることがありません。
「私たちは、このベプターを挿入したこども達が成長し骨成熟時期に至るまで様子
を見る、という段階にきています。」「そして、もしベプターが有効に機能して
他のいかなる障害になっていないことが確認できたときは、私たちはベプターを
患者から取り外すことなく、そのままにしておく、という治療方法もとりはじめて
います」「それはあくまでも患者ごとのケースバイケースであり、いつが取り出す
時期の標準だ、というものはありません」とCampbell先生は述べています。
いかなる外科手術においても同様ですが、感染というリスクはあります。しかし、
ベプターが他の手術以上に感染率が高いということはなく、そのリスクには差は
ありません。「骨に取り付けたデパイスが骨から外れるというリスクはあります。
また、こどもが十分な体躯でない場合には、ベプターを取り付けた肋骨部位の皮膚
がベプターを覆いかぶせておくには十分な厚さがなく、皮膚にトラブルが起こる
こともありえます。しかし、私たちはそのようなリスクを踏まえてでもこどもの命
を救うことのほうが大切であると信じています」とCampbell医師は語っています。
Campbell医師とSmith医師は、このチタン製人工肋骨ベプターを用いた5種類の新しい
手術方法を開発してきました。そして、Thoracic Insufficiency Syndrome胸郭形成
不全症候群という病態について整形外科専門4誌にて説明してきました。彼らはこの
チタン製人工肋骨手術方法を米国中のそして世界中の小児外科病院に教育してきま
した。先週はアルゼンチンのBuenos Aires小児病院にでかけ、先月は、英国の
Birmingham小児病院で手術をしてきました。
Campbell医師は数年間にわたり個人的に研究を続けていましたが、プロジェクトを
進展させるために、健康科学分野での大学の協力を必要としていました。1992年に
健康科学センターに勤務したCampbell先生は後に、「健康科学センターはこの研究
を推進し、成功に導く大きな力になってくれた」「サンアントニオにある、この
CHRISTUS Santa Rosa病院が、チタン製人工肋骨手術の核である」と述べています。
1990年代半ば、Canpbell医師、Smith医師、健康科学センター、Santa Rosa病院が
FDAの承認のもと、このチタン製人工肋骨に関する多施設臨床試験をコーディネイト
することになりました。Santa Rosa病院で約210人が手術を受け、90人が他の7つの
小児病院、ピッツバーグ、ボストン、ソルトレイク、ロサンジェルス、シアトル、フィラデルフィア、で手術を受けました。
「FDAから、このベプターの認可を得るのに13年間という長い年月を要しました。
というのも、このベプターが適用となる病気が非常にまれなものであるために、
臨床試験に患者を集めるのにまず時間がかかった、という事情があります」「また
FDAは新しい脊椎デバイス、特に小児用デバイスに対しては、非常に慎重に審査を
進めた、という事情もあります」とCampbell医師は説明しています。
(当シリーズはさらに続きます)
http://www.veptr.com/wiki/History%20of%20the%20device.ashx
このVEPTRというデバイスの歴史 (2008年3月12日改訂)
このデバイスの開発は1987年にさかのぼります。胸部外科研究所のスタッフであり
健康科学センターの小児外科教授のD.Smith医師が、胸壁欠損の新生児である
Christopher Cardenasのレントゲン写真を携えてCampbell先生を訪れたときがその
第一歩ということになります。この赤ん坊を救う唯一の方法は、人工の胸壁を作る
ことであり、そしてそれは成功することができました。さらに2年後、工学部の生徒
として大学で再び学びだしていたCampbell医師は、チタン製人工肋骨を開発し、2歳
になっていたChristopherにインプラントする準備ができていました。手術は成功し
Christopherはいまは17歳となり、サンアントニオに住んでいます。
チタン製人工肋骨は、胸郭(肋骨に囲まれた胸)のような形状をしており、外来で
六ヶ月ごとにデバイス延長が出来るような構造となっています。この人工肋骨は
生後6ヶ月から骨未成熟のこども、およそ14歳程の女子あるいは16歳程の男子を
対象として手術することができます。Campbell医師によれば、「できるだけ早い
時期に手術することがベターである」と述べています。「肺(細胞の数の)増大は2歳
までに最大になるからです」。この人工肋骨はチタンでできており、非常に軽く、
生体適合性に優れ、またMRI検査でも画像が大きく乱れることがありません。
「私たちは、このベプターを挿入したこども達が成長し骨成熟時期に至るまで様子
を見る、という段階にきています。」「そして、もしベプターが有効に機能して
他のいかなる障害になっていないことが確認できたときは、私たちはベプターを
患者から取り外すことなく、そのままにしておく、という治療方法もとりはじめて
います」「それはあくまでも患者ごとのケースバイケースであり、いつが取り出す
時期の標準だ、というものはありません」とCampbell先生は述べています。
いかなる外科手術においても同様ですが、感染というリスクはあります。しかし、
ベプターが他の手術以上に感染率が高いということはなく、そのリスクには差は
ありません。「骨に取り付けたデパイスが骨から外れるというリスクはあります。
また、こどもが十分な体躯でない場合には、ベプターを取り付けた肋骨部位の皮膚
がベプターを覆いかぶせておくには十分な厚さがなく、皮膚にトラブルが起こる
こともありえます。しかし、私たちはそのようなリスクを踏まえてでもこどもの命
を救うことのほうが大切であると信じています」とCampbell医師は語っています。
Campbell医師とSmith医師は、このチタン製人工肋骨ベプターを用いた5種類の新しい
手術方法を開発してきました。そして、Thoracic Insufficiency Syndrome胸郭形成
不全症候群という病態について整形外科専門4誌にて説明してきました。彼らはこの
チタン製人工肋骨手術方法を米国中のそして世界中の小児外科病院に教育してきま
した。先週はアルゼンチンのBuenos Aires小児病院にでかけ、先月は、英国の
Birmingham小児病院で手術をしてきました。
Campbell医師は数年間にわたり個人的に研究を続けていましたが、プロジェクトを
進展させるために、健康科学分野での大学の協力を必要としていました。1992年に
健康科学センターに勤務したCampbell先生は後に、「健康科学センターはこの研究
を推進し、成功に導く大きな力になってくれた」「サンアントニオにある、この
CHRISTUS Santa Rosa病院が、チタン製人工肋骨手術の核である」と述べています。
1990年代半ば、Canpbell医師、Smith医師、健康科学センター、Santa Rosa病院が
FDAの承認のもと、このチタン製人工肋骨に関する多施設臨床試験をコーディネイト
することになりました。Santa Rosa病院で約210人が手術を受け、90人が他の7つの
小児病院、ピッツバーグ、ボストン、ソルトレイク、ロサンジェルス、シアトル、フィラデルフィア、で手術を受けました。
「FDAから、このベプターの認可を得るのに13年間という長い年月を要しました。
というのも、このベプターが適用となる病気が非常にまれなものであるために、
臨床試験に患者を集めるのにまず時間がかかった、という事情があります」「また
FDAは新しい脊椎デバイス、特に小児用デバイスに対しては、非常に慎重に審査を
進めた、という事情もあります」とCampbell医師は説明しています。
(当シリーズはさらに続きます)