『東京大学大学院医学系研究科の畠山昌則教授らは、タンパク質チロシンホスファターゼ(SHP1)が、ピロリ菌が産生するタンパク質CagAの発がん活性を抑制する酵素であることを突き止めました。さらに、エプスタイン・バール(EB)ウイルスが感染した胃の細胞内ではSHP1の発現が抑制され、ピロリ菌CagAタンパク質の発がん活性が増強することを見出しました。この成果は、細菌とウイルスが連携してヒトのがん発症を促す仕組みを世界で初めて明らかにしたものです。本研究は、千葉大学大学院医学系研究科、東京大学大学院医学系研究科の研究者との共同によるものです。
ピロリ菌は胃がん発症の危険率を高めるとされ、また、日本で検出されるものはほぼ全てタンパク質CagAを作り出すCagA陽性ピロリ菌であると報告されています。ピロリ菌が胃の細胞内に注入したCagAは、リン酸化酵素(Src ファミリーキナーゼやAbl キナーゼ)によりチロシンリン酸化された後、チロシン脱リン酸化酵素(ホスファターゼ)SHP2と結合すると胃がんの発症を促進します。CagAの脱リン酸化はがん化抑制の点で重要ですが、SHP2はCagAに対して脱リン酸化の能力がありません。
今回、ピロリ菌タンパク質CagA を脱リン酸化する酵素として、SHP2の兄弟分子である SHP1を同定しました。SHP1 によるチロシン脱リン酸化の結果、CagA タンパク質の発がん活性は中和されたことから、 SHP1 は胃がんの発症を抑制する分子と考えられます。一方、胃がん症例の約10%で、がん細胞に対するEB ウイルス感染が知られており、この共感染によりSHP1遺伝子のプロモーターという部位が高度にメチル化された結果、SHP1の発現が抑制されて、ピロリ菌 CagA タンパク質の発がん活性が増強することが分かりました。ヒトのがん発症における発がん細菌と発がんウイルスの連携の解明は世界で初めてとのことです。』
これもツーヒット
『胃の粘膜に感染して胃がんを引き起こす細菌「ヘリコバクター・ピロリ」(ピロリ菌)について、日本など東アジアに流行するピロリ菌が作る発がん物質の型を調べたところ、欧米などのピロリ菌よりも発がん性が高いとの研究結果を畠山昌則・東京大教授(感染腫瘍学)らの研究チームが20日、米科学誌電子版に発表した。日本など東アジアで胃がん発生率が高い要因とみられ、胃がん予防や早期治療法の開発への応用が期待される。
ピロリ菌は胃の細胞に取り付くと、針を差し込んで発がん物質「CagA」を注入する。CagAは、細胞を増殖させる酵素と結びつき、異常に活発にすることでがんの発症を促す。
チームがCagAと酵素の結合の仕組みを調べたところ、欧米などでのピロリ菌が出すCagAは1本の爪で酵素に結び付くタイプだったのに対し、東アジアの型は別にもう1本、爪を持っていた。結び付きの力は欧米型より約100倍強く、東アジアで胃がんの発症率が高い原因の一つと考えられるという。
東アジアでの胃がん発症率は世界的にも高い。特に日本は最多発生国とされ、胃がんによる死亡者は年約5万人に上る。ピロリ菌は抗生物質で除菌できるものの、効果が少ない人もいるという。畠山教授は「爪による結合を阻むような薬を作れば、日本人などの胃がん予防に役立つだろう」と話している。【斎藤有香】
【ことば】ピロリ菌
胃の中にいる細菌。名称は、初めて発見された場所が胃の出口(幽門部=ピロルス)だったことに由来する。胃や十二指腸の潰瘍を起こすことを豪州の研究者が解明し、2005年にノーベル医学生理学賞を受賞した。数本のべん毛を持ち、胃の中を移動する。』

死滅検査結果を確認。除菌により何故か肩の痛みが取れた。不思議。五十肩は感染症なのか?歯周炎からの細菌侵入が想定できる。
『ある日突然、肩に激痛が走り、動かせなくなる。腕が上がらなくなる。一般の肩凝りとは異なる、日常生活にも支障をきたすようなつらい痛みの正体は? 中年以上の人に多い五十肩』
Gastric cancers, with gastric adenocarcinoma (GAC) as the most common histological type, impose a considerable global health burden. Although the screening strategies for early detection have been shown to be successful in Japan and South Korea, they are either not implemented or not feasible in most of the world, leading to late diagnosis in most patients. Helicobacter pylori infection contributes to the development of many endemic GACs, and pre-emptive eradication or early treatment of this bacterial infection might provide effective primary prevention. GACs are phenotypically and genotypically heterogeneous. Localized (clinical stage I) GAC is best treated either endoscopically or with limited surgical resection, but clinical stage II or stage III tumours require multidisciplinary adjunctive approaches in addition to surgery. Although GAC is highly treatable in its early stages, advanced (clinical stage IV) GAC has a median survival of just ∼9–10 months. However, detailed molecular and immune profiling of GAC is yielding promise; early studies with immune checkpoint inhibitors suggest that GAC is amenable to immune modulation. Molecular studies have yielded a vast quantity of new information for potential exploitation. Nevertheless, advances against GACs have lagged compared with other tumours of similar incidence, and more research is necessary to overcome the obstacles to prolong survival.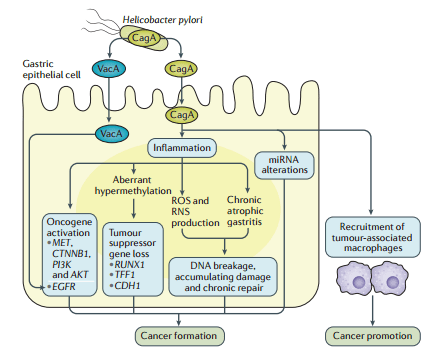
ピロリ菌は胃がん発症の危険率を高めるとされ、また、日本で検出されるものはほぼ全てタンパク質CagAを作り出すCagA陽性ピロリ菌であると報告されています。ピロリ菌が胃の細胞内に注入したCagAは、リン酸化酵素(Src ファミリーキナーゼやAbl キナーゼ)によりチロシンリン酸化された後、チロシン脱リン酸化酵素(ホスファターゼ)SHP2と結合すると胃がんの発症を促進します。CagAの脱リン酸化はがん化抑制の点で重要ですが、SHP2はCagAに対して脱リン酸化の能力がありません。
今回、ピロリ菌タンパク質CagA を脱リン酸化する酵素として、SHP2の兄弟分子である SHP1を同定しました。SHP1 によるチロシン脱リン酸化の結果、CagA タンパク質の発がん活性は中和されたことから、 SHP1 は胃がんの発症を抑制する分子と考えられます。一方、胃がん症例の約10%で、がん細胞に対するEB ウイルス感染が知られており、この共感染によりSHP1遺伝子のプロモーターという部位が高度にメチル化された結果、SHP1の発現が抑制されて、ピロリ菌 CagA タンパク質の発がん活性が増強することが分かりました。ヒトのがん発症における発がん細菌と発がんウイルスの連携の解明は世界で初めてとのことです。』
これもツーヒット
『胃の粘膜に感染して胃がんを引き起こす細菌「ヘリコバクター・ピロリ」(ピロリ菌)について、日本など東アジアに流行するピロリ菌が作る発がん物質の型を調べたところ、欧米などのピロリ菌よりも発がん性が高いとの研究結果を畠山昌則・東京大教授(感染腫瘍学)らの研究チームが20日、米科学誌電子版に発表した。日本など東アジアで胃がん発生率が高い要因とみられ、胃がん予防や早期治療法の開発への応用が期待される。
ピロリ菌は胃の細胞に取り付くと、針を差し込んで発がん物質「CagA」を注入する。CagAは、細胞を増殖させる酵素と結びつき、異常に活発にすることでがんの発症を促す。
チームがCagAと酵素の結合の仕組みを調べたところ、欧米などでのピロリ菌が出すCagAは1本の爪で酵素に結び付くタイプだったのに対し、東アジアの型は別にもう1本、爪を持っていた。結び付きの力は欧米型より約100倍強く、東アジアで胃がんの発症率が高い原因の一つと考えられるという。
東アジアでの胃がん発症率は世界的にも高い。特に日本は最多発生国とされ、胃がんによる死亡者は年約5万人に上る。ピロリ菌は抗生物質で除菌できるものの、効果が少ない人もいるという。畠山教授は「爪による結合を阻むような薬を作れば、日本人などの胃がん予防に役立つだろう」と話している。【斎藤有香】
【ことば】ピロリ菌
胃の中にいる細菌。名称は、初めて発見された場所が胃の出口(幽門部=ピロルス)だったことに由来する。胃や十二指腸の潰瘍を起こすことを豪州の研究者が解明し、2005年にノーベル医学生理学賞を受賞した。数本のべん毛を持ち、胃の中を移動する。』

死滅検査結果を確認。除菌により何故か肩の痛みが取れた。不思議。五十肩は感染症なのか?歯周炎からの細菌侵入が想定できる。
『ある日突然、肩に激痛が走り、動かせなくなる。腕が上がらなくなる。一般の肩凝りとは異なる、日常生活にも支障をきたすようなつらい痛みの正体は? 中年以上の人に多い五十肩』
Gastric cancers, with gastric adenocarcinoma (GAC) as the most common histological type, impose a considerable global health burden. Although the screening strategies for early detection have been shown to be successful in Japan and South Korea, they are either not implemented or not feasible in most of the world, leading to late diagnosis in most patients. Helicobacter pylori infection contributes to the development of many endemic GACs, and pre-emptive eradication or early treatment of this bacterial infection might provide effective primary prevention. GACs are phenotypically and genotypically heterogeneous. Localized (clinical stage I) GAC is best treated either endoscopically or with limited surgical resection, but clinical stage II or stage III tumours require multidisciplinary adjunctive approaches in addition to surgery. Although GAC is highly treatable in its early stages, advanced (clinical stage IV) GAC has a median survival of just ∼9–10 months. However, detailed molecular and immune profiling of GAC is yielding promise; early studies with immune checkpoint inhibitors suggest that GAC is amenable to immune modulation. Molecular studies have yielded a vast quantity of new information for potential exploitation. Nevertheless, advances against GACs have lagged compared with other tumours of similar incidence, and more research is necessary to overcome the obstacles to prolong survival.


























