土壌を構成する粘土鉱物の種類が、土壌pHに応じて変化するのはなぜなのか。それを知るためには、粘土鉱物を形成するアルミニウムとケイ酸の性質を理解する必要がある。
先ず、アルミニウムについて。
アルミニウムは土壌中で三価の陽イオンAl3+として存在する。アルミニウムイオンは酸性条件下では、塩化物イオンCl-や硫酸イオンSO42-などの陰イオンと対を成す。例えば、塩化物イオンとの組み合わせによってできる塩化アルミニウムは化学式でAlCl3と書けるが、土壌水中における実際の存在形態は、下図のようにアルミニウムイオンが6個の水分子H2Oをまとった形になっている。このように陽イオンに結合した水分子を「配位水」と呼び、アルミニウムイオンのように6個まとう場合を「六座配位」と言う。配位水を踏まえて化学式を書き直せば、AlCl3・6H2Oとなる。なお、六座配位したアルミニウムは八面体構造を持つ。

次に、アルカリ性条件下におけるアルミニウムイオンの存在形態を考える。アルカリ性条件下で、アルミニウムイオンと対を成すのは水酸化物イオンOH-である。水酸化物イオンには酸素原子があり、水分子の代わりとしてアルミニウムイオンに配位できるため、水酸化アルミニウムの化学式はAl(OH)3・3H2Oとなる。ところが、水酸化アルミニウムには、配位水を更に捨てて、隣り合うアルミニウムイオン同士が水酸化物イオンを共有しようとする性質があり、下図のような脱水重合を起こす。

そして、脱水重合が連鎖的に生じると、下図のような集合体形が生まれる。粘土鉱物に見られるアルミニウムシート(二次元平面状に集合したもの)は、このような反応によって作り出される構造である。重合によって生じる大きな構造体は水となじみにくいため、アルカリ性条件下のアルミニウムイオンは、水に溶けずに沈殿することになる。

続いて、ケイ酸について。
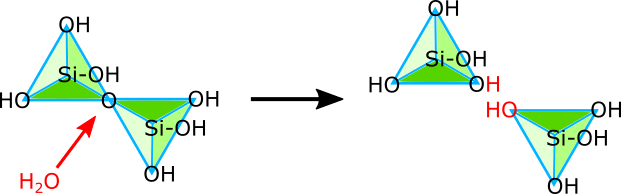
ケイ酸もまたpHによって形態を様々に変化させる物質である。アルカリ性条件下において、ケイ酸は四価の陰イオンSiO44-として単体で存在し、4つの水素イオンを引き付けてH4SiO4となっている。しかし、pHが酸性に傾いたり、ケイ酸を溶かす水が蒸発して少なくなったりすると、重合反応が起きて連結する。
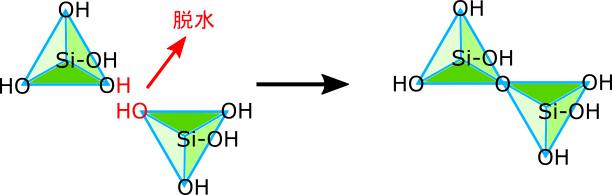
幾つかのケイ酸が一次元の鎖状に連なったものは、流動性を持った「ゲル」の性質を示す(シリカゲル)。
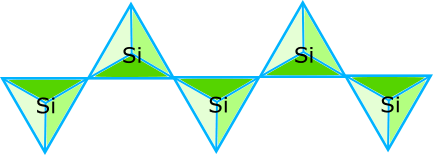
複数の一次元鎖が、更に隣同士で連結すると、アルミニウムシートと同様の二次元平面構造を作る。

二次元平面が積層して更に面間でも連結すると、三次元立体構造となる。結晶性(高い規則性)の三次元構造は石英などの鉱物に見られ、非結晶性(アモルファス、低い規則性)の三次元構造はガラスである。
重合反応によって連結したケイ酸は、アルカリ性条件下に戻されると、加水分解されて再びばらばらになる。
さて、以上のようなアルミニウムとケイ酸の特性を踏まえ、粘土鉱物形成の仕組みを考えてみる。
先ず、2:1型粘土鉱物(ケイ酸とアルミニウムの比率が2対1)について。
この型の粘土鉱物が生じるのは、アルカリ性条件下と言われる。アルカリ性条件下では、アルミニウムは水酸化アルミニウムの形態、すなわち、アルミニウムシートを形成する。一方、ケイ酸は加水分解を受けて、単体構造もしくは短い一次元鎖構造をとっていると考えられる。
2:1型粘土鉱物が生成するためのもう一つの条件に「乾燥」があり、ケイ酸を溶かす水が蒸発して少なくなっていくと、ケイ酸が次第に連結し始める。その際にアルミニウムシートとの間にも脱水重合が生じ、最終的に、2枚のケイ酸シートが1枚のアルミニウムシートを挟み込んだ構造が完成する。

先ず、アルミニウムについて。
アルミニウムは土壌中で三価の陽イオンAl3+として存在する。アルミニウムイオンは酸性条件下では、塩化物イオンCl-や硫酸イオンSO42-などの陰イオンと対を成す。例えば、塩化物イオンとの組み合わせによってできる塩化アルミニウムは化学式でAlCl3と書けるが、土壌水中における実際の存在形態は、下図のようにアルミニウムイオンが6個の水分子H2Oをまとった形になっている。このように陽イオンに結合した水分子を「配位水」と呼び、アルミニウムイオンのように6個まとう場合を「六座配位」と言う。配位水を踏まえて化学式を書き直せば、AlCl3・6H2Oとなる。なお、六座配位したアルミニウムは八面体構造を持つ。

次に、アルカリ性条件下におけるアルミニウムイオンの存在形態を考える。アルカリ性条件下で、アルミニウムイオンと対を成すのは水酸化物イオンOH-である。水酸化物イオンには酸素原子があり、水分子の代わりとしてアルミニウムイオンに配位できるため、水酸化アルミニウムの化学式はAl(OH)3・3H2Oとなる。ところが、水酸化アルミニウムには、配位水を更に捨てて、隣り合うアルミニウムイオン同士が水酸化物イオンを共有しようとする性質があり、下図のような脱水重合を起こす。

そして、脱水重合が連鎖的に生じると、下図のような集合体形が生まれる。粘土鉱物に見られるアルミニウムシート(二次元平面状に集合したもの)は、このような反応によって作り出される構造である。重合によって生じる大きな構造体は水となじみにくいため、アルカリ性条件下のアルミニウムイオンは、水に溶けずに沈殿することになる。

続いて、ケイ酸について。
ケイ酸もまたpHによって形態を様々に変化させる物質である。アルカリ性条件下において、ケイ酸は四価の陰イオンSiO44-として単体で存在し、4つの水素イオンを引き付けてH4SiO4となっている。しかし、pHが酸性に傾いたり、ケイ酸を溶かす水が蒸発して少なくなったりすると、重合反応が起きて連結する。

幾つかのケイ酸が一次元の鎖状に連なったものは、流動性を持った「ゲル」の性質を示す(シリカゲル)。

複数の一次元鎖が、更に隣同士で連結すると、アルミニウムシートと同様の二次元平面構造を作る。

二次元平面が積層して更に面間でも連結すると、三次元立体構造となる。結晶性(高い規則性)の三次元構造は石英などの鉱物に見られ、非結晶性(アモルファス、低い規則性)の三次元構造はガラスである。
重合反応によって連結したケイ酸は、アルカリ性条件下に戻されると、加水分解されて再びばらばらになる。

さて、以上のようなアルミニウムとケイ酸の特性を踏まえ、粘土鉱物形成の仕組みを考えてみる。
先ず、2:1型粘土鉱物(ケイ酸とアルミニウムの比率が2対1)について。
この型の粘土鉱物が生じるのは、アルカリ性条件下と言われる。アルカリ性条件下では、アルミニウムは水酸化アルミニウムの形態、すなわち、アルミニウムシートを形成する。一方、ケイ酸は加水分解を受けて、単体構造もしくは短い一次元鎖構造をとっていると考えられる。
2:1型粘土鉱物が生成するためのもう一つの条件に「乾燥」があり、ケイ酸を溶かす水が蒸発して少なくなっていくと、ケイ酸が次第に連結し始める。その際にアルミニウムシートとの間にも脱水重合が生じ、最終的に、2枚のケイ酸シートが1枚のアルミニウムシートを挟み込んだ構造が完成する。


























※コメント投稿者のブログIDはブログ作成者のみに通知されます