日本はロシアのように、安心なペプチドワクチンを作らないのかな?
イベのメルクの新薬はこれ?
COVID-19ワクチン候補ペプチドの同定
細胞性免疫誘導を特徴とする画期的ワクチンの開発へ
COVID-19ワクチン候補ペプチドの同定|国立がん研究センター (ncc.go.jp)
https://www.ncc.go.jp/jp/information/pr_release/2020/0730/index.html
2020年7月30日
国立研究開発法人国立がん研究センター
ブライトパス・バイオ株式会社
発表のポイント
- 国立がん研究センターとブライトパスは、COVID-19の原因ウイルスに対する細胞性免疫(T細胞)の誘導を特徴とするペプチドワクチン*1候補を同定しました。
- 今回同定したペプチドで日本人に多いHLA型が広くカバーされ、日本人での高い有効性が期待されます。
この度、国立研究開発法人国立がん研究センター(理事長:中釜 斉、所在地:東京都中央区、以下国立がん研究センター)とブライトパス・バイオ株式会社(代表取締役社長:永井 健一、所在地:東京都千代田区、以下ブライトパス)は、共同研究において新型コロナウイルス感染症(COVID-19)の予防ワクチンとなり得る複数の候補ペプチドを同定しましたのでお知らせいたします。
COVID-19の世界的大流行は依然として収束する兆しが見えてきません。国立がん研究センター先端医療開発センター(センター長:落合 淳志、所在地:千葉県柏市)中面哲也免疫療法開発分野長らとブライトパスは、がん細胞の遺伝子変異(ネオアンチゲン*2)に着目したがんワクチンの臨床応用を目指す共同研究を進めています。さらにこのネオアンチゲン・ワクチン候補を同定する技術を応用し、COVID-19をもたらすウイルス(SARS-CoV-2)に対するペプチドワクチン候補を同定し、パンデミック収束の一翼を担えるCOVID-19ワクチンの開発を共同研究で進めてまいりました。
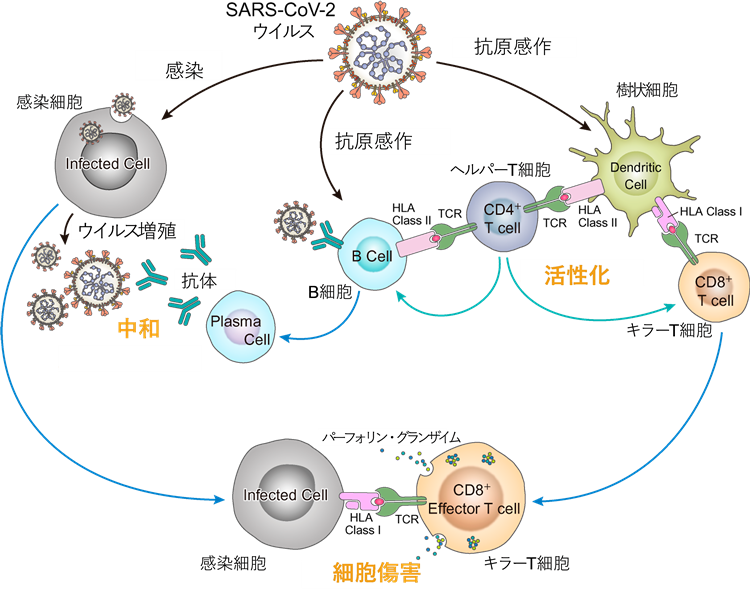
現在世界で開発が進んでいるCOVID-19ワクチンのほとんどが、ウイルスを細胞感染前に捕捉する中和抗体*3(液性免疫)の誘導を目指すものですが、ウイルス感染に対する免疫反応は、抗体反応だけではありません。ウイルスに対するT細胞(細胞性免疫*4)反応が重要な鍵を握っています。ウイルスを中和する抗体反応が誘導されるためにはT細胞(CD4+ T細胞:ヘルパーT細胞*5)の助けが必要です。さらにウイルス感染が進行してしまった細胞は細胞内でウイルスを増殖させるため、T細胞(CD8+ T細胞:キラーT細胞*6)によって殺傷しなくてはいけません【図1】。このようなウイルス特異的T細胞を誘導できるワクチン開発が、ウイルス防御において有効であることを示唆する研究報告*7が、昨今続々と発表されています。
国立がん研究センターとブライトパスがこれまで開発してきたのは、がん細胞を殺傷するT細胞(細胞性免疫)の誘導を作用機序とするがんワクチンであり、この開発経験を活かし、ウイルスに対するT細胞を、ペプチド*8という短く絞り込まれた断片を用いてピンポイントで強力に誘導するワクチンの開発に取り組み、複数のワクチン候補ペプチドを同定するに至りました。
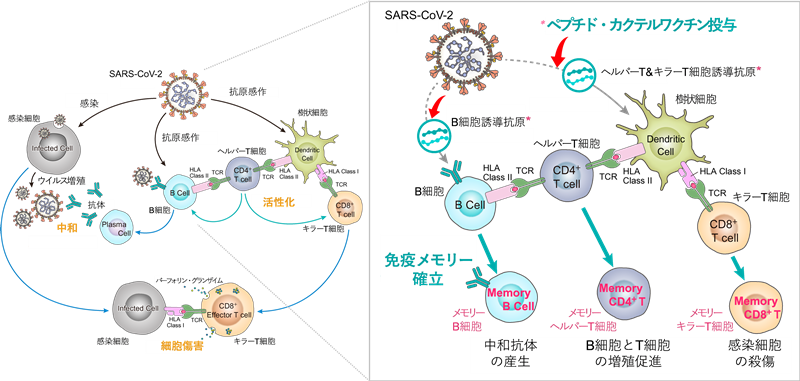
T細胞がウイルス抗原(ウイルスのタンパク質から切り出される短いペプチド)に反応するためには、このペプチドがヒト主要組織適合性遺伝子複合体(HLA)*9と一緒に感染細胞の表面で提示されていなければなりません。HLAは一人が複数の型をもち、その組み合わせは一人ひとりで大きく異なります。今回同定したペプチドは、HLA-A24とHLA-A2を合わせて日本人の85%をカバーするHLAに結合するため、日本人での有効性が期待されます。さらに中和抗体の誘導を図るペプチドも含む製剤デザインがなされています【図2】。
【図1】SARS-CoV-2に対する免疫の成立
【図2】複合的免疫メモリー*10を成立させるワクチン
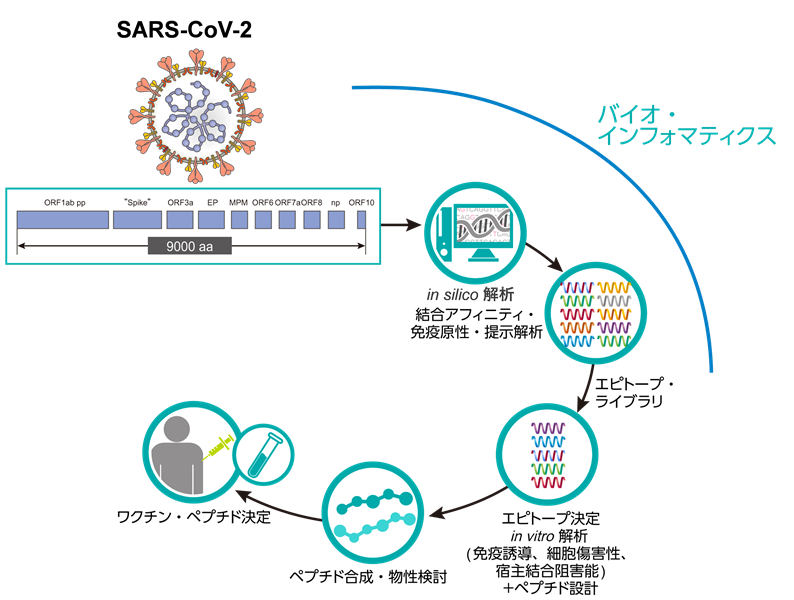
本COVID-19ワクチンの設計は、これまでに登録されている約11,000株のSARS-CoV-2のゲノムデータを参照し、ウイルスがコードするタンパク質から切り出されると予測されるペプチドを、HLAへの結合能、細胞表面へHLA複合体として提示されるか等の観点から検討しました。ネオアンチゲン・ワクチン設計に用いる予測アルゴリズムを用いたin silico解析*11によってリストアップし、HLA遺伝子導入マウスモデルで実際の免疫原性の有無を確認するスクリーニング法によって、絞り込みを行いました【図3】。
【図3】COVID-19ワクチン候補ペプチド同定のフロー
本共同研究は国立がん研究センター先端医療開発センターの中面哲也免疫療法開発分野長らを中心にブライトパスとの間で進められています。中面分野長は、本邦におけるがん免疫療法*12のサイエンスを牽引するとともに、グリピカン3を始め、多くのがんペプチドワクチンの探索研究から臨床試験までを一貫して推進してまいりました。ブライトパスは、日本人で一番多いHLA-A24拘束性ペプチドワクチンを、前立腺がんを対象とするテーラーメイド型がんワクチンITK-1として国内で第3相臨床試験まで進めた経験を有し、現在は米国人で一番多いHLA-A2拘束性4種ペプチド・ミックス・ワクチンGRN-1201を、非小細胞肺がんを対象に米国で第2相臨床試験を進めています。
ペプチド製剤は、化学的な合成によって製造できることから、今後COVID-19ワクチンの普及に必須となる大量製造、安定した薬剤供給にも対応できる可能性があります。国立がん研究センターとブライトパスは、本共同研究の成果を第三者の開発パートナーやアカデミア、大学病院などとの協業も視野に入れ、臨床応用と早期実用化へと進める機会を探ってまいります。
ペプチドリーム、新型コロナには3つのアプローチで創薬研究中:日経バイオテクONLINE (nikkeibp.co.jp)
画像のクリックで拡大表示
ペプチドリームの決算説明会の資料より
ペプチドリームは、2020年8月7日、2020年12月期第2四半期の決算説明会を電話会議で開催。新型コロナウイルス感染症(COVID-19)に対しては、スパイク蛋白質を標的として、3つのアプローチで抗コロナ薬の研究開発を進めており(上図)、2021年中には臨床試験入りできるとの見通しを示した。
2020年12月期第2四半期は、創薬共同研究と戦略的提携による自社パイプラインの拡充において、それぞれ幾つかの進捗があった。
創薬共同研究では、2020年5月、参天製薬と眼科領域で進めている包括的創薬共同研究開発の2つ目のプログラムで、見いだされた特殊環状ペプチドがヒット化合物のクライテリアを達成。また、2020年5月、ドイツBayer社と進めている創薬共同研究開発について拡大契約を締結し、複数の標的蛋白質を対象に特殊環状ペプチドを探索・最適化し、放射線を用いた診断薬や新規の治療薬への応用などを目指すことになった。さらに、2020年6月には、米Merck社と、将来発生し得る変異型も含め、抗コロナ薬の共同研究開発契約を締結した。
COVID-19に関しては、抗抗体ができにくく、変異のスピードが速いスパイク蛋白質を標的とし、変異型の新たなコロナウイルスに対しても有効な、汎用性の高い抗コロナ薬の研究開発を進めていることを紹介。ペプチドリームとして、(1)スパイク蛋白質のS1領域に結合し、ヒト細胞のACE2(受容体)との結合を阻害する薬剤、(2)S1領域またはS2領域に結合し、免疫細胞を誘導するペプチド薬物複合体(PDC)、(3)コロナウイルス全般で高度に保存されているS2領域に結合、ウイルスを阻害する薬剤――の3つのアプローチで創薬を進めていると説明した上で、一部のアプローチについてMerck社と共同研究開発を進めていると明らかにした。
現在、最も進んでいるアプローチは、「in vivoでのPOC取得に近いところにある」(金城聖文副社長)といい、早いものは、2021年中に臨床試験入りできるとの見通しを示した。それがMerck社と共同研究開発を進めているプログラムであれば、契約に基づく枠組みで臨床試験を、また、ペプチドリームが自社で進めているプログラムであれば、自社で臨床試験を行う。なお、いずれのアプローチについても、開発対象となるのは、COVID-19と診断された陽性患者や軽症患者になるとみられ、「重症患者に対しては、他の薬剤との併用になるのではないか」(金城副社長)という。
戦略的提携による自社パイプラインの拡充に向けては、2020年2月、米Kleo Pharmaceuticals社と共同で研究開発しているプログラムに進捗があった他、2020年4月に三菱商事と合弁会社のぺプチグロース(東京・千代田、杉本二朗代表取締役)を立ち上げ、ぺプチグロースと細胞医薬や再生医療向けに成長因子を代替するペプチドを共同開発する契約を締結した。
Kleo社とは現在、多発性骨髄腫を対象に、がん抗原であるCD38に特異的に結合するペプチドと、ヒト体内のIgG抗体と特異的に結合する低分子化合物を組み合わせ、免疫細胞にがん細胞を攻撃させるPDC(開発番号:KP1237)を開発中(通称『CD38-ARM』)。
2020年2月には、多発性骨髄腫で自家幹細胞移植の治療を受けた後、微小残存病変(MRD)を認める患者を対象として、米国で、KP1237と自家NK細胞による治療の臨床試験開始届(IND)が承認された。COVID-19の影響で、試験開始が遅れていたものの、「2020年第3四半期にも、第1/2相臨床試験が開始される予定だ」(金城副社長)という。また、ダラツムマブに再発・難治性の多発性骨髄腫患者を対象にKP1237(旧開発番号:KP1196)を投与する治療についても、2020年第3四半期に臨床試験入りできる見通しだという。
ぺプチグロースとは、成長因子を代替できる特殊環状ペプチドを探索・開発する、再生・細胞治療向け成長因子事業を進める。具体的には、動物血清由来や組換え技術で製造され、培地に添加されている数十種、数百種の成長因子を代替できる特殊環状ペプチドを探索し、培地を開発・販売する企業へ販売したり、細胞医薬・再生医療の開発を手掛ける製薬企業、アカデミアなどと共同開発したりすることを検討している。スクリーニングで、ヒット化合物の特殊環状ペプチドが見いだされ、そのプロパティが診断薬や成長因子を代替できる医薬品に向いていれば、培地向けではなく、ペプチドリームが医薬品や診断薬として自社開発することも考えているという。


















