筆者の手元に米国連邦保健福祉省(HHS)傘下の食品医薬品局(FDA)のリコール通知が届いた。筆者は、かつてブログでオーストラリアの競争・消費者委員会(ACCC)によるエアバックの安全リコールを取る上げたことがあるが、今回のリコール対象は医療機器である。
このリコール制度は各国を比較してもかなり複雑である。今回のブログは(1)米国FDAサイトからリコール通知内容を解説し、(2)米国リコール制度の概要をなるべく正確に理解できるよう工夫する, (3) 今回のオリンパスのリコール通知のこれまでの経緯、(4)わが国のリコール制度の概観を試みるものである。
なお、本ブログを読まれた方は気が付かれると、米国の重大なリコール通知(class Ⅰ)と比較して、はたしてオリンパスのリコール通知の正確な受け止め方はどうすべきであろうか。
Ⅰ.FDAのリコール通知
FDAはオリンパス北米・中南米の地域統括会社たるオリンパス・コーポレーションが販売した「気管支ファイバースコープ(bronchofiberscopes)」と「気管支ビデオスコープ(bronchovideoscopes)」を「クラスⅠリコール」すなわち、最も深刻なタイプのリコールとして識別した。これらのデバイスを使用すると、重大な怪我や死を引き起こす可能性があるとした。
このリコールは修正(correction)であり、製品の削除(removal)ではない。
1.リコールされた製品
①製品名:オリンパス気管支ファイバースコープと気管支ビデオスコープ
②製品コード:参照 データベースエントリをリコール
③モデル番号: 完全なリスト添付
④販売期間:2001年1月1日から2023年9月11日
⑤米国でリコールされたデバイス数:17,691台
➅オリンパスがリコールを開始した日付:2023年10月12日
2.使用デバイス
気管支ファイバースコープ(bronchofiberscopes)と気管支ビデオスコープ(brochovideoscopes)は、カメラやライトなどのアクセサリを使用して人の気道を調べたり処理したりする管状の医療デバイスである。

オリンパスのサイトから引用
3.リコールの理由
オリンパス北米および中南米における地域統括会社たるオリンパスコーポレーション(オリンパス)は、特定の気管支ファイバースコープと気管支ビデオスコープをリコールしている。
リコールの対象となる影響を受けた気管支ビデオスコープを使用すると、人の気道や肺の重大な火傷、気道の出血、呼吸困難、無呼吸、意識喪失、死亡など、深刻な健康への悪影響が生じる可能性がある。またけがは、長期の処置、追加の医療、長期入院、ICUケア、および死亡につながる可能性がある。さらに燃焼により、デバイスの一部が損傷または破損する可能性があり、患者に怪我をさせたり、意図せずに残ったりする可能性があり、けがの回復(retrieval)または外科的切除(surgical removal)が必要になる場合がある。
〇この問題に関しては、4人の負傷者を含め、192件の苦情があった。なお、報告された死者いない。
〇次の場合、デバイスが燃焼するリスクが発生する。高周波焼灼(high-frequency cauterization)が酸素の供給中に行われたとき、または電気外科用アクセサリの電極セクションが内視鏡の端に近づきすぎたとき。
4.リコールで誰が影響を受ける可能性があるか。
オリンパス気管支ファイバースコープまたは気管支ビデオスコープで治療を受けている人およびスコープを使用する医療従事者
5.前記影響を受ける人は何をすべきか
2023年10月12日、オリンパスは影響を受けるすべての顧客に 緊急医療機器の是正措置につき書簡通知した。
この書簡では、デバイスの操作マニュアルの警告条項、特に次の内容を確認するよう顧客に求めていた。
①酸素を供給しながら高周波焼灼の実行を停止させる。
②内視鏡で使用する電気外科用デバイスを内視鏡から十分離してください。
③操作マニュアルに記載されているように、オリンパス気管支鏡と互換性のある高周波機器のみを使用してください。
6.連絡先情報
このリコールについて質問がある米国のお客様は、1-800-848-9024(オプション1)のオリンパスに連絡する必要がある。
影響を受けるオリンパスのデバイスの完全なリスト
Bronchovideoscope Olympus BF Type 1T150 Evis Exera II Bronchovideoscope Olympus BF Type 1T180
OES気管支ファイバースコープオリンパスBFタイプ1T60 Evis Exera III Bronchovideoscope Olympus BF-1TH190
Evis Exera II Bronchovideoscope Olympus BF Type 1TQ180 Evis Exera III BronchovideoscopeオリンパスBF-H190
以下、略す。
Ⅱ.FDAのリコール制度概要
FDAサイトの解説を仮訳する。
リコールは、食品医薬品局 (FDA) が管理する法律に違反する製品を削除または修正する方法である。リコールは、製造業者や販売業者が、傷害や重大な欺瞞の危険性がある製品、またはその他の欠陥がある製品から公衆の健康と福祉を守る責任を負っているために行われる自主的な措置である。連邦規則集(Code of Federal Regulations: CFR)のうち 「21 CFR PART 7—ENFORCEMENT POLICY」(筆者注)は、責任ある企業が効果的なリコールを実施できるようにするためのガイダンスを提供している。
21 CFR Part 7
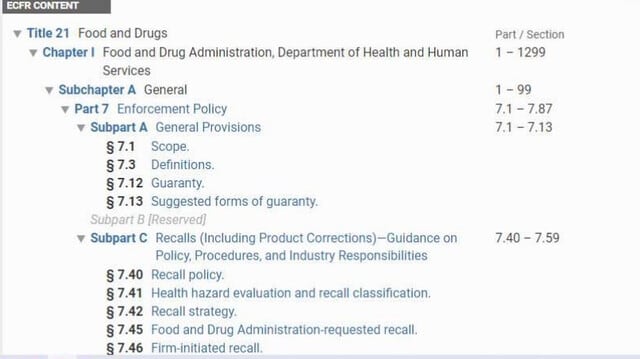
医療機器のリコールは、通常、21 CFR 7 に基づいてメーカーによって自主的に行われる。まれに、メーカーまたは輸入業者が健康へのリスクがある機器を自主的にリコールしない場合、FDA は 21 CFR 810 に基づいて医療機器リコール当局がメーカーにリコール命令を発行する場合がある。21 CFR 810 には、連邦食品医薬品化粧品法 の第 518 条(e) に基づいて医療機器のリコール権限を行使する際に FDA が従う手順が記載されている。
21 CFR 806「医療機器の修正(correction)と除去(removals)」に基づき、製造業者および輸入者は、医療機器の修正または除去が健康へのリスクを軽減する目的で開始された場合、デバイスを除去したり、健康に危険を及ぼす可能性のあるデバイスに起因する法律違反を是正したりするため、医療機器の修正または除去について FDA に報告する必要がある。
【各用語の定義】
① 修正(correction)とは、製品を他の場所に物理的に移動せずに、製品の修理(repair)、改良(modification)、調整(adjustment )、ラベルの貼り直し(relabeling)、破壊(destruction)、または綿密な検査 (inspection)(患者の監視を含む) を意味する。
② 市場からの撤退(Market withdrawal)とは、FDA による法的措置の対象とならない軽微な違反を伴う流通製品、または通常の在庫ローテーションの実施、日常的な機器の調整や修理などの違反を伴わない、企業による流通製品の除去または修正を意味する。
③ リコール(recall)とは、FDA が管轄する法律に違反していると見なし、FDA が差し押さえなどの法的措置を開始する対象となる、企業が市販製品を削除または修正することを意味する。 リコールには、市場からの撤退や在庫の回収は含まれない。
④リコール戦略(Recall strategy)とは、特定のリコールを実施する際に取られる計画的な行動方針を意味し、リコールの深さ、公衆への警告の必要性、およびリコールの有効性チェックの程度に対処する。
⑤リコール会社(recalling firm)とは、リコールを開始した会社、または食品医薬品局の要請によるリコールの場合は、リコール対象製品の製造および販売に主な責任を負う会社を意味する。
➅ 除去(removal)とは、修理、改良、調整、再ラベル付け、破壊、または綿密な検査のために、デバイスを使用場所から他の場所に物理的に移動することを意味する。
⑦ 健康に対するリスク(risk to health)とは、(1) 製品の使用または製品への曝露により、重大な健康への悪影響または死亡が引き起こされる合理的な確率があること。または (2) 製品の使用または製品への曝露が、一時的または医学的に回復可能な健康への悪影響、または重大な健康への悪影響の可能性が低い結果を引き起こす可能性があること。
⑧ 定期保守(Routine servicing)とは、デバイスの通常の耐用年数が終了したときの部品の交換 (校正、バッテリーの交換、通常の磨耗への対応など) を含む、定期的に計画されたデバイスのメンテナンスを意味する。予期せぬ性質の修理、通常の寿命よりも早い部品の交換、またはデバイスの複数ユニットの同一の修理または交換は、定期的なサービスではない。
⑨ 在庫回収(Stock recovery)とは、市販されていないデバイス、または製造業者の直接の管理下にないデバイスの修正または削除を意味する。つまり、デバイスが製造業者の所有または管理下にある敷地内にあり、一部が含まれていないもの。 今回、修正または除去措置に関係するロット、モデル、コード、またはその他の関連ユニットが販売または使用のためにリリースされた。
⑩ 分類Classification
リコールは、リコール対象の製品によってもたらされる健康被害の相対的な程度を示すために、FDA によって以下のとおり、数値指定 (I、II、または III) に分類される。
クラス I - 違反製品の使用または曝露が重大な健康への悪影響または死亡を引き起こす合理的な確率がある状況をいう。
クラス II - 違反製品の使用または曝露が、一時的または医学的に回復可能な健康への悪影響を引き起こす可能性がある状況、または重大な健康への悪影響の可能性が低い状況をいう。
クラス III - 違反製品の使用または曝露が有害事象を引き起こす可能性が低い状況をいう。
Ⅲ.オリンパスのリコール通知のこれまでの経緯
以下のとおり抜粋する。
1.2023年7月4日「米国における気管支内視鏡とレーザー治療機器を使用する際の医療機関への自主的な注意喚起について」
OCAは、一死亡例の他重篤な患者さんの傷害に関連する事象を受けて、気管支内視鏡と適合するレーザータイプを明記し、適合しないレーザータイプを使用した際に生じるリスクについて通知します。また既存のレーザー使用に関する注意喚起を強化するために、気管支内視鏡の取扱説明書の更新を行います。これは市場からの製品回収ではありません。なお、アルゴンプラズマ凝固療法(APC)使用による気管支内で気管支内視鏡が燃焼する事象が1件発生しましたが、燃焼の原因が特定できていないため、APC使用に関する取扱説明書の更新は行っておりません。患者さんと医療従事者の安全、そして潜在的なリスクを軽減することが当社の最優先事項です。
オリンパスの気管支内視鏡は、気道および気管支内の内視鏡診断・治療に使用することを目的としています。今回の注意喚起では、日本を含む全世界で発売している気管支内視鏡(BFシリーズ内視鏡)32機種が対象の製品になります。そのうち19機種は米国で販売されており、米国食品医薬品局(FDA)およびその他の規制当局に通知をしています。
OCAは、2023年6月8日付の注意喚起レターで当社の気管支内視鏡を使用する全ての医療従事者の方々に対し、当社のレーザー対応の気管支内視鏡がNd:YAGレーザーまたは810nmダイオードレーザーのみに対応していることを理解いただき、徹底するよう要請しました。
さらに、オリンパスは、当社の気管支内視鏡とレーザー治療機器の組み合わせに関する取扱説明書の警告に十分注意するよう促しています。取扱説明書では、発火の恐れがあるため、酸素を供給しながらレーザー焼灼を行わないよう警告しています。患者さんの傷害(火傷、出血、穿孔)や装置の破損を避けるため、内視鏡検査に使用するモニター上でレーザープローブの先端が確認できましたら、レーザー焼灼の治療を行うこと、またその際に気管支内視鏡と体内の壁面の距離を可能な限り確保することの周知徹底を依頼しています。
なお、これらの製品の使用で発生した副作用や品質上の問題は、FDAのMedWatchプログラム(英文のみ)12/19(46)にオンラインで報告することができます。
2.2020年9月3日「2020年8月25日発表の『内視鏡製品の自主回収に関するお知らせ』に関して国内における自主回収の補足説明」
このたび、自主回収の対象となる2製品の内、気管支ビデオスコープ「OLYMPUS BF TYPE Q180」は、主に欧米で販売されている製品のため、国内での回収対象製品はございません。一方、胆道ファイバースコープ「OLYMPUS CHF TYPE CB30S」(以下、CHF-CB30S)は、グローバルで販売されている製品のため、国内も対象となります。
当社は、当社の品質基準に照らし合わせ、患者様の安全確保を最優先に考え、「CHF-CB30S」を所有・使用している国内の医療機関に案内の上、自主回収を実施します。
3.2023年11月10日「米国における気管支内視鏡と高周波治療器の併用に関する医療機関への自主的な注意喚起について」
当社の気管支内視鏡は、推奨された高周波治療器と使用した場合の安全性が確認されており、取扱説明書に記載されている指示および警告に従って引き続き使用することができます。患者さんと医療従事者の安全、そして潜在的なリスクを軽減することが、当社の最優先事項です。
取扱説明書では、気管支内視鏡と高周波治療機器を併用する際、焼灼中に発火する恐れがあるので、酸素を供給しながら高周波焼灼を行わないよう警告しています。さらに、患者さんの健康被害(火傷、出血、穿孔)や気管支内視鏡の破損を避けるため、高周波治療機器の電極部を内視鏡先端部から十分離してご使用いただくよう記載しています。
オリンパスの気管支内視鏡は、気道および気管支内の内視鏡診断・治療に使用することを目的としています。今回の注意喚起は、日本を含む全世界で発売している気管支内視鏡(BFシリーズ内視鏡)28機種が対象となります。
本件は、気管支内視鏡とレーザー治療装置での気管支鏡使用に関して2023年7月3日(現地時間)にプレスリリースで公表された「米国における気管支内視鏡とレーザー治療機器を使用する際の医療機関への自主的な注意喚起について」とは別の措置になります。
Ⅳ.わが国のリコール制度の概要
弁護士 西村裕一氏の解説が体系的かつ分かりやすいので一部抜粋する。(なお、リンクと補足は筆者が行った)
日本の法律上、「リコール」について明確な定義はなく、様々な製品について横断的にリコール制度を定めた法律はありません。
各種製品ごとに異なったリコール制度があり、それぞれ別の法律に根拠があることから、リコール制度の内容も製品ごとに異なることになります。
1.自動車
自動車については、「道路運送車両法」にリコール制度が定められており、国土交通省が所管しています。
(1)自動車メーカー等による自主的なリコール
自動車メーカー等が、自動車の設計・製作過程に基づく不具合を発見した場合、その不具合の状況・原因・改善措置・使用者への周知方法を届け出ることが求められます(道路運送車両法63条の3 )。
自動車メーカー等が、不具合を把握していたにもかかわらず、この届出を行っていなかった場合は、1年以下の懲役または300万円の罰金を科される可能性があります。
(2)国土交通大臣の勧告によるリコール
自動車のリコールは、基本的には自動車メーカー等の自主的な届出によって行われますが、国土交通大臣は、自動車の設計・製作過程の不具合を把握した場合、自動車メーカー等に対して、必要な改善措置を講ずるよう勧告することができます(同法63条の2)。
自動車メーカー等がこのリコール勧告を無視した場合、国土交通大臣はリコール勧告に従わない旨を公表することができ、それでもなお自動車メーカー等がリコールを行わない場合は、リコールを命令することができます。
このリコール命令に違反すると、1年以下の懲役または300万円以下の罰金が科され、法人に対しても2億円以下の罰金が併科される可能性があります。
2.医薬品、医薬部外品、化粧品、医療機器
医薬品、医薬部外品、化粧品、医療機器については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)にリコール制度が定められており、厚生労働省が所管しています。
*本法に関し、筆者なりに厚生労働省の「自主回収報告関連情報」サイトにより補足する。
【自主回収のクラス分類について】
クラス分類とは、回収される製品によりもたらされる健康への危険度の程度により、以下のとおり個別回収ごとに、I、II又はIIIの数字が割り当てられるものです。
クラスI:クラスIとは、その製品の使用等が、重篤な健康被害又は死亡の原因となりうる状況をいう。
クラスII:クラスIIとは、その製品の使用等が、一時的な若しくは医学的に治癒可能な健康被害の原因となる可能性があるか又は重篤な健康被害のおそれはまず考えられない状況をいう。
クラスIII:クラスIIIとは、その製品の使用等が、健康被害の原因となるとはまず考えられない状況をいう。
(危害の防止)
第六十八条の九 医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造販売業者又は外国特例承認取得者は、その製造販売をし、又は第十九条の二、第二十三条の二の十七若しくは第二十三条の三十七の承認を受けた医薬品、医薬部外品、化粧品、医療機器又は再生医療等製品の使用によつて保健衛生上の危害が発生し、又は拡大するおそれがあることを知つたときは、これを防止するために廃棄、回収、販売の停止、情報の提供その他必要な措置を講じなければならない。
2 薬局開設者、病院、診療所若しくは飼育動物診療施設の開設者、医薬品、医薬部外品若しくは化粧品の販売業者、医療機器の販売業者、貸与業者若しくは修理業者、再生医療等製品の販売業者又は医師、歯科医師、薬剤師、獣医師その他の医薬関係者は、前項の規定により医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造販売業者又は外国特例承認取得者が行う必要な措置の実施に協力するよう努めなければならない。
( 回収の報告 )
第六十八条の十一 医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造販売業者、外国特例承認取得者又は第八十条第一項から第三項までに規定する輸出用の医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造業者は、その製造販売をし、製造をし、又は第十九条の二、第二十三条の二の十七若しくは第二十三条の三十七の承認を受けた医薬品、医薬部外品、化粧品、医療機器又は再生医療等製品を回収するとき ( 第七十条第一項の規定による命令を受けて回収するときを除く。 ) は、厚生労働省令で定めるところにより、回収に着手した旨及び回収の状況を厚生労働大臣に報告しなければならない。
***************************************************************
(筆者注) CFR の 21 章(Title 21)は、「Food and Drug」に関する章であり、医薬品や食品、添加物、医療機器、規制薬物等に関する規定です。「21 CFR」と呼ばれ、Part 1 から 1,499 まで用意されており、その内容によりアメリカ食品医薬品局(Food and Drug Administration、FDA)、アメリカ麻薬取締局、そして国家薬物取締政策局によって管理されています。
(米国研究製薬工業協会サイトから一部抜粋)
************************************************************:
Copyright © 2006-2024 芦田勝(Masaru Ashida).All Rights Reserved.You may reproduce materials available at this site for your own personal use and for non-commercial distribution.