がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
488)ミトコンドリア・ダイナミクスとがん
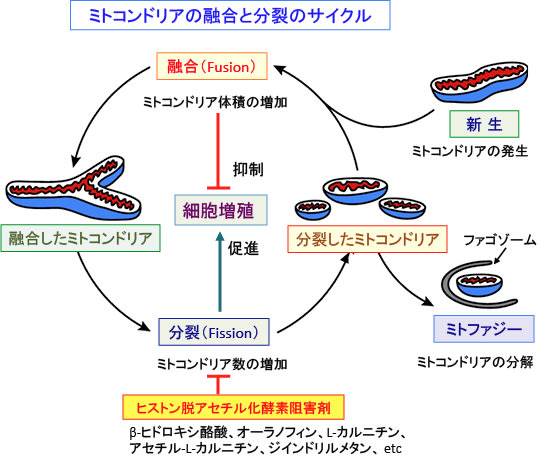
図:細胞内のミトコンドリアの数や体積や形態や機能は、ミトコンドリアの新生(発生)、融合、分裂、分解(ミトファジー)のバランスで制御されている。融合が進行すると大きな管状のネットワークを形成し、分裂が進むと小さなミトコンドリアが増える。ミトコンドリアの融合と分裂のバランスの異常が、様々な疾患の原因となっている。(参考:Journal of Cell Science 123: 2533-2542, 2010)
488)ミトコンドリア・ダイナミクスとがん
【ミトコンドリアは元は細菌だった】
ミトコンドリアは赤血球以外の全ての細胞に存在する細胞小器官です。1個の細胞当たり平均で300~400個のミトコンドリアが存在します。肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。全部で体重の約10%を占めると言われています。
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。
そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
大気中に増える酸素による悪影響に苦しんでいた嫌気性の原始真核生物にとって、酸素を使ってATPを作り出す好気性細菌との共生は好都合でした。
好気性細菌は生体にダメージを与える酸素をグルコースに結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができるからです。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。(下図)

図:嫌気性の原始真核細胞に好気性細菌のαプロテオバクテリアが食作用で取り込まれ、共生するようになり、ミトコンドリアになった。αプロテオバクテリアに存在していた遺伝子の多くは真核細胞の核内に移動し、ミトコンドリアのたんぱく質の多くは核の遺伝情報によって作られる。
このように、ミトコンドリアはかつて細菌であったため、見かけは細菌に似ています。直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1~4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。
内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。
マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。たんぱく質合成のためにリボソームも持っていてミトコンドリア内でたんぱく合成もできます。そして、ミトコンドリア自身が増殖もします。(下図)
図:細胞内には機能を分担するために、様々な小器官が存在する。ミトコンドリアは酸素を使ってグルコースや脂肪酸やアミノ酸を燃焼してATPを産生する働きや、物質代謝やアポトーシスの制御など多彩は機能を持っている。
【ミトコンドリアは細胞の生存と死の両方を制御している】
ミトコンドリアは酸素を使ってグルコース(ブドウ糖)や脂肪酸やアミノ酸を燃焼してエネルギーのATP(アデノシン3リン酸)を産生する働きがあります。つまり、細胞の発電所のような器官です。
ヒトの血液100ml中にはおよそ80~100mgのグルコース(ブドウ糖)が存在します。これを血糖と言います。
グルコースは血液中から細胞に取り込まれ、1)解糖、2)TCA回路(クエン酸回路やクレブス回路とも呼ばれる)、3)電子伝達系における酸化的リン酸化を経て、二酸化炭素と水に分解され、ATPが取り出されます。
解糖は細胞質において酸素を使わないでブドウ糖に保存されているエネルギーのうち少量が使用可能なATPとして取り出され、TCA回路と酸化的リン酸化はミトコンドリアで酸素を使って行われます。
グルコース1分子当たり、解糖では2分子のATPが産生され、ミトコンドリアで完全に代謝されるとさらに36分子のATPが産生されます。
ミトコンドリアはATPの産生以外に、カルシウム代謝の制御、様々な物質の合成、アポトーシス(細胞死)の制御など重要な細胞機能を担っています。
アポトーシスは、形態学上は核の凝集と細胞収縮、それにDNAの断片化などによって特徴づけられる細胞死の一種です。個体の発生段階で、過剰にできた細胞を選択的に除去し、器官形成を完成するのに必要なプロセスです。
また、老化した細胞や修復不能なダメージを受けた細胞を除去する際にも、アポトーシスのメカニズムで細胞死が起こります。
このアポトーシスの過程は極めて複雑ですが、ミトコンドリアに存在するたんぱく質が重要な役割を果たしています。
たとえば、電子伝達系で働く「チトクロームC」というたんぱく質は、ミトコンドリアから放出されると、たんぱく分解酵素群が次々に活性化されて、細胞死へと導きます。
アポトーシスは多数のタンパク質によって制御されていますが、中心になるのがBcl-2やBaxと呼ばれるタンパク質群(Bcl-2ファミリー蛋白質)です。
Bcl-2 ファミリー蛋白質には、アポトーシスを抑制するBcl-2-サブファミリー(Bcl-2, Bcl-XLなど)と、アポトーシスを促進する Baxサブファミリー(Bax、Bakなど) および BH3-onlyサブファミリー (Bid、Bim、Badなど)があります
Bcl-2およびそのファミリー蛋白質の主な作用部位はミトコンドリア膜で、このミトコンドリア膜の透過性を制御することにより、細胞の生死を決定しています。
ミトコンドリアの膜透過性が亢進すると、膜間スペースに存在するアポトーシス誘導蛋白質(シトクロムCなど)が細胞質に漏出します。漏出したシトクロムCはカスパーゼと呼ばれる蛋白分解酵素群を段階的に活性化してアポトーシスが実行されます。
Baxはアポトーシス実行時のミトコンドリアの膜透過性亢進に必須の分子として働き、
Bcl-2はBaxと直接結合してBaxの働きを阻止します。
Bcl-2のようなアポトーシス促進蛋白質の活性が、Baxのような抑制蛋白質の活性を凌駕した場合に、ミトコンドリア膜透過性亢進が誘導され、アポトーシスが実行されます。
Bcl-2サブファミリー蛋白質(Bcl-2やBcl-xL)を過剰発現したがん細胞は多くのアポトーシス刺激(抗がん剤治療など)に対して強い抵抗性を示します。したがって、Bcl-2サブファミリー蛋白質の活性や発現量を抑制したり、Baxサブファミリー蛋白質の活性や発現量を高める効果は、がん細胞の抗がん剤感受性を高め、死滅しやすくなります。
このように、ミトコンドリアは細胞の生存と死の両方の制御に重要な働きを担っています。
原始真核細胞とαプロテオバクテリアが共生を開始したとき、バクテリアの遺伝子の多くを原始真核生物の核に移行させる一方、αプロテオバクテリアは細胞の生存と死の決定権を握る事にって、お互いの共生関係を強化したのかもしれません。
いずれにしろ、この点が、がん治療のターゲットとしてミトコンドリアが注目されている理由です。ミトコンドリアが細胞の生死のカギを握っているからです。
ミトコンドリアを理解すると、有効ながん治療のヒントが得られます。

図:Bcl-2はBaxと結合してBaxの活性を抑制している。抗がん剤や放射線照射などによって細胞を傷害されるとBH3ドメインをもつ蛋白質がBcl-2に結合してBcl-2を不活性化する。その結果フリーになったBaxはミトコンドリア外膜にて二量体(ダイマー)になって内腔を形成してミトコンドリアからシトクロム C を含む様々なタンパク質が細胞質内に流出し、蛋白分解酵素のカスパーゼ(Caspases)が活性化されアポトーシスが実行される。 Bcl-2の活性が阻害されていないときにはBcl-2はBaxに結合してBaxが二量体を形成するのを阻止してミトコンドリア膜の透過性を抑制することによってアポトーシスを阻止している。
【ミトコンドリアは融合と分裂を繰り返す】
ミトコンドリアは固有の DNA を持ち、固有のタンパク質合成機能を有しています。これは、ミトコンドリアが元々は細菌で、真核生物に取り込まれて共生してからも、一部のDNAとたんぱく質合成装置が残ったからです。
細胞内でミトコンドリアが新しく生じることをミトコンドリア新生 (Mitochondrial biogenesis)と言います。
ミトコンドリアは約1100種類のたんぱく質で構成されています。
ミトコンドリアを構成するタンパク質には、核内DNA にコードされているものと、ミトコンドリア内 DNAにコードされているものがあります。核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されます。ミトコンドリアDNAにコードされているたんぱく質はごく少数です。
ミトコンドリアは常に融合(fusion)過程により結合し、分裂(fission)過程により分割しています。融合が活性化すると長くつながった構造が形成され、逆に分裂が活性化すると小さな断片化した形状が増えます。このようにミトコンドリアの形態はダイナミックに変化しています。
ミトコンドリア(mitochondria)はギリシャ語の「糸」を意味する「mitos」と「小さい粒」を意味する「chondrion」をつなげた用語です。線状になったり球状になったりする状態を観察して「mitochondria」と命名されたようです。
顆粒状・桿状・糸状のいずれの形のミトコンドリアも、他のミトコンドリアと融合して1本になったり、分裂して数個のミトコンドリアになるというミトコンドリア・ダイナミクスの存在は100年以上前から知られています

図:ミトコンドリアは融合(fusion)と分裂(fission)によって形態をダイナミックに変化させる。融合が活性化すると長くつながった構造が形成され、逆に分裂が活性化すると小さな断片化した形状が増える。ミトコンドリアの融合は、3 種類の GTPase(Mfn1、Mfn2、Opa1)の働きにより引き起こされる。Mitofusion タンパク質である Mfn1 および Mfn2 はミトコンドリア外膜の膜融合に、Opa1 はミトコンドリア内膜の膜融合に関わっている。一方ミトコンドリアの分裂は、ミトコンドリア外膜タンパク質 Fis1 (fission protein 1 )とMff (mitochondrial fission factor)、GTPase である Drp1(dynamin-related protein 1) の働きにより引き起こされる。Drp1は通常は細胞質に存在し、ミトコンドリア分裂のときに、ミトコンドリア外膜にリクルートされる。Fis1とMffはDrp1のアダプターたんぱく質として機能する。(参考:Research Reports in Clinical Cardiology. 5: 111-122, 2014)
【ミトコンドリア・ダイナミクスががん治療のターゲットとして注目されている】
細胞内のミトコンドリアの数や体積や形態や機能は、ミトコンドリアの新生(発生)、融合、分裂、分解(ミトファジー)のバランスで制御されています。
近年、ミトコンドリア・ダイナミクスの分子機構が明らかになり、ミトコンドリアの分裂と融合が細胞生存の本質的な過程に関与していること、それが疾患発症に重要であることが明らかになりつつあります。
ミトコンドリア・ダイナミクスの障害(分裂と融合の異常)が発症に関連している疾患として、がん、心血管疾患、神経変性疾患などが指摘されています。
「細胞のがん化はDNA(=遺伝子)の変異によって起こる」というのが一般的な考え方です。すなわち、活性酸素や発がん物質によってDNAに変異が蓄積し、正常細胞の増殖や分化や死を制御している遺伝子(がん遺伝子やがん抑制遺伝子)に異常が起こることによって、自律増殖や転移といった悪性腫瘍の性質を獲得して、がん細胞になると考えられています。
がんの研究者のほとんどが、この「がん発生の体細胞変異説」を発がんメカニズムの基本原理と考えています。
しかし、がん細胞の発生は、遺伝子の異常だけで起こっているわけではありません。ミトコンドリアの異常が細胞のがん化に重要な役割を果たしていることが多くの研究で明らかになっています。(485話参照)
しかし、がんとミトコンドリアとの関係における考え方は相反する意見が存在し、極めて複雑です。まだ、コンセンサスが得られていない点は数多く存在します。
例えば、「がん細胞はミトコンドリアでの酸化的リン酸化が抑制されている」というワールブルグ効果が知られています。そこで「ジクロロ酢酸でミトコンドリアを活性化するとがん細胞は死滅する」という意見がある一方、「がん細胞のミトコンドリアを活性化してATP産生を増やすと、がん細胞の増殖や転移が促進される」という実験結果も報告されています。
これは、温熱療法で、がん組織の温度を確実に42℃以上に上げればがん細胞を死滅できますが、中途半端に38℃とか39℃の上昇だと却って増殖が促進されるのと似ています。温度が上がれば酵素反応は促進されるからです。
ミトコンドリアも活性酸素の産生が細胞を死滅させるレベルに発生できればがん細胞を死滅できますが、それに達しないレベルだと、中等度の酸化ストレスはがん細胞の増殖や転移を促進することが知られています。
がん予防では活性酸素の害を軽減する抗酸化物質や抗酸化酵素の活性を高めるものは、DNAの酸化傷害を軽減してがん予防効果を発揮します。
がん治療においては、がん細胞の抗酸化力を高めると放射線治療や抗がん剤治療に抵抗性になるので、むしろ酸化ストレスを高める治療が有効と考えられています。
つまり、がん治療においては、ミトコンドリアを活性化するのが良い場合と、ミトコンドリアの活性を阻害する場合が良い場合があることになります。
この点について相反する意見があるので、現時点ではミトコンドリアをターゲットにした治療には慎重になる必要があります。今後、コンセンサスを得られている情報を積み重ねることが大切です。
【がん細胞ではミトコンドリアの分裂が亢進している】
一般的にがん細胞ではミトコンドリアの分裂が亢進しています。
ミトコンドリアは分裂によって小さい断片になると、より多くの活性酸素種を産生する能力を発揮し、細胞増殖を促進するという実験結果が報告されています。また融合することによって、ミトコンドリアネットワークが形成されると、増殖が抑制されることが報告されています。以下のような論文があります。
Mitochondrial dynamics regulates migration and invasion of breast cancer cells.(ミトコンドリア・ダイナミクスが乳がん細胞の移動と浸潤を制御する)Oncogene. 32(40):4814-24. 2013
【要旨】
ミトコンドリアは高度に動的(ダイナミック)で、融合と分裂を絶えず繰り返しており、これが細胞の正常機能を維持する上で重要な役割を果たしている。
ミトコンドリアの機能異常ががん細胞の発生に重要な要因となっていることが知られているが、がん死の主要な原因である転移の過程におけるミトコンドリア・ダイナミクスの役割についてはほとんど知られていない。
本研究では、ヒトの浸潤性乳がん細胞とリンパ節転移において、ミトコンドリアの分裂に関与するダイナミン関連たんぱく質1(dynamin-related protein 1:Drp1)の発現が高度に亢進していることを明らかにした。
転移していない乳がん細胞に比較して、転移している乳がん細胞においては、ミトコンドリアはより分裂して断片化しており、Drp1たんぱく質の発現量と活性が亢進しており、ミトコンドリア融合たんぱく質1(mitochondrial fusion protein 1:Mfn1)の発現と活性は低下していた。
Drp1を欠損させるかMfn1を過剰発現させて融合を促進すると、ミトコンドリアは延長・密集し、乳がん細胞の転移能が抑制された。
これとは対照的にMfn1たんぱく質の発現を阻害するとミトコンドリアの分裂と断片化が促進され、乳がん細胞の転移能が亢進した。
興味深いことに、このようなミトコンドリア・ダイナミクスの調整は乳がん細胞におけるミトコンドリアの細胞内分布を変えた。例えば、Drp1の発現抑制かMfn1の過剰発現は、がん細胞の転移の重要なステップである膜状仮足(lamellipodia)形成を阻害し、膜状仮足領域へのミトコンドリアの移動を抑制した。
逆に、Mfn1たんぱく質の発現を阻害すると膜状仮足形成を亢進し、膜状仮足領域にミトコンドリが集積し、細胞の移動能が促進された。
さらに重要なことは、ミトコンドリア脱共役剤(mitochondrial uncoupling agent)やATP合成阻害剤で細胞を処理すると、膜状仮足形成が低下し、乳がん細胞の移動と浸潤が抑制された。これは乳がん細胞の転移にミトコンドリアの機能が重要であることを示唆している。
以上の結果から、がん細胞の移動と浸潤の制御にミトコンドリア・ダイナミクスの関与が明らかになった。Drp1依存性のミトコンドリア分裂の亢進をターゲットにした治療が乳がんの転移の抑制の新たな方法になる可能性が示唆された。
ミトコンドリアの分裂と融合には幾つかのたんぱく質が関与しています。
分裂はDrp1(dynamin-related protein 1)が細胞質からミトコンドリア外膜に移行することによって起こります。移行したDrp1は多量体を形成し、輪のようになってミトコンドリアを締め付けて分裂させます。
ミトコンドリアの融合には、外膜に存在するmitofusin-1やmitofusin-2および内膜に存在するOPA1(optic atrophy 1)が必要です。Mitofusin(mitochondrial fusion protein)は、膜貫通およびC端ドメインによってミトコンドリアに結合し、ホモダイマーまたはヘテロダイマーのアンチパラレルな結合を介して隣り合っているミトコンドリアを融合させます。
この論文では、ミトコンドリア分裂を亢進するDrp1の発現や活性が亢進している乳がん細胞は転移を起こしやすく、ミトコンドリアの融合が亢進すると転移が抑制されることを示しています。
つまり、がん細胞のミトコンドリア分裂を阻害し、融合を亢進すると、がん細胞の増殖や転移を抑制できるということです。
がん細胞が移動したり浸潤したり転移するにはエネルギー(ATP)が必要です。
細胞が移動するときは、細胞が広がって、足のように延ばして移動します。この仮足の部分にミトコンドリアを移動させて集めるために、ミトコンドリアを分裂させる必要があると言う訳です。
がん細胞はミトコンドリアでの酸化的リン酸化によるエネルギー産生を抑えて、解糖系でのエネルギー産生が主体になっています。しかし、ミトコンドリアでのエネルギー産生を完全に抑えているわけではなく、ある程度はミトコンドリアでのエネルギー産生は行われています。
がん細胞においてミトコンドリアが分裂して小さくなることは増殖促進に作用するようです
ミトコンドリアの分裂に関与するdynamin-related protein 1(Drp1)ががん細胞で過剰発現していることは、多くの研究で明らかになっています。以下のような総説があります。
The role of dynamin-related protein 1 in cancer growth: a promising therapeutic target? (がん細胞の増殖におけるダイナミン関連たんぱく質1の役割:有望な治療ターゲット?)Expert opinion on therapeutic targets. 2013;17(9):997-1001.
ダイナミン関連たんぱく質1(Dynamin-related protein 1 :Drp1)はミトコンドリア分裂に必須のGTPase活性をもったダイナシン・ファミリーのたんぱく質で、肺がんや乳がん細胞で発現が亢進していることが報告されています。
ヒト肺がんではミトコンドリアの融合過程が障害され、分裂して断片化に至る過程が促進されていることが報告されています。
細胞が分裂する過程で、ミトコンドリアも分裂が亢進します。
細胞分裂時にミトコンドリアが正しく分裂することは、分裂後の娘細胞に均等にミトコンドリアが分配されるために重要です。
細胞周期を進めるときにミトコンドリアの分裂が必要なので、ミトコンドリアの分裂を阻害すると細胞分裂も阻害されます。
細胞分裂の時に重要な微小管の重合阻害剤ががん治療に使われるのと同じです。
ミトコンドリアの分裂阻害や融合促進ががん治療に有用であることが指摘されています。以下のような報告があります
Inhibition of mitochondrial fission prevents cell cycle progression in lung cancer(肺がん細胞においてミトコンドリア分裂の阻害は細胞周期の進行を阻止する)The FASEB Journal. 2012;26(5):2175-2186.
肺がん細胞では、周囲の正常細胞に比べて、ミトコンドリア分裂を促進するDrp-1の発現が増加し、融合を促進するMfn-2の発現が低下していることが示されています。
肺がん細胞でDrp-1活性の阻害や発現を阻止するとがん細胞の増殖が著明に抑制され、アポトーシスが誘導されました。
Drp-1を阻害すると細胞周期のS期(DNA合成期)のがん細胞が、32.4%から6.4%に減少しました。
Mfn-2を過剰発現すると、がん細胞の増殖は抑制され、ミトコンドリアの活性酸素の産生を増やし、アポトーシスを誘導しました。
つまり、ミトコンドリアの分裂を阻害すると、がん細胞は増殖を抑制され、細胞死が誘導されるという結果です。
Drp1の阻害剤が有望ながん治療薬になる可能性が指摘されています。Drp1活性とその多量体化を阻害するmitochondrial division inhibitor 1 (mdivi-1)などが知られています。
【ミトコンドリア分裂を阻害するがん治療】
がん細胞のミトコンドリアの分裂を阻害するか、融合を促進すると、がん細胞の増殖を抑制できるというのが最近の多くの研究で指摘されています。
このミトコンドリア・ダイナミクスの制御には、その上流のシグナル伝達系の段階で制御する方法と、分裂・融合の実行過程で制御する方法があります。
増殖因子によって活性化されるシグナル伝達系は、細胞分裂のための準備をし、その一つがミトコンドリア分裂です。したがって、増殖シグナル伝達系の阻害がミトコンドリア分裂の阻害につながります。
細胞外シグナル調節キナーゼ(Extracellular Signal-regulated Kinase、ERK)1/2はDrp1をリン酸化して活性化します。つまり、ERK1/2はミトコンドリアの分裂を亢進し、細胞分裂を促進します。
ERK1/2はセリン/スレオニンキナーゼの一つで、何らかの刺激(酸化ストレス、サイトカインなど)を受けて活性化されます。
つまり、細胞成長因子の活性やERK1/2シグナル伝達系を阻害することはミトコンドリア分裂を阻害して増殖や転移を抑制します。
ヒストン脱アセチル化酵素阻害剤がミトコンドリア融合を促進することが報告されています。以下のような報告があります。
Histone deacetylase inhibitors induce mitochondrial elongation.(ヒストン脱アセチル化酵素阻害剤はミトコンドリア延長を誘導する)J Cell Physiol. 2012 Jul;227(7):2856-69. doi: 10.1002/jcp.23027.
この論文では、ミトコンドリアの融合と分裂の均衡状態に対する7種類のヒストン脱アセチル化酵素阻害剤の効果を検討しています。
ヒストン脱アセチル化酵素阻害剤はヒストンのアセチル化を亢進して様々な遺伝子の発現を亢進して細胞機能に影響します。
この研究では、7種類のヒストン脱アセチル化酵素阻害剤の全てがミトコンドリアの分裂に関するたんぱく質(Fis1)の発現を減少させ、Drp1のミトコンドリアへの移行を減少させました。
ヒストン脱アセチル化酵素阻害剤は様々な機序で抗腫瘍効果を発揮しますが、ミトコンドリアの分裂阻害も機序の一つと言えそうです。
ヒストン脱アセチル化酵素のクラスIとIIを阻害する方法として、β-ヒドロキシ酪酸(ケトン食で体内で産生される内因性のヒストン脱アセチル化酵素阻害剤)、オーラノフィン(リュウマチの治療薬)、L-カルニチン、アセチル-L-カルニチン、ジインドリルメタン、酪酸(水溶性食物繊維の腸内発酵によって産生)、抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)などが利用できます。(475話、476話参照)
| « 487)メラトニ... | 489)がん細胞... » |



