がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
909)mTORC1阻害はがん細胞のフェロトーシスを促進する
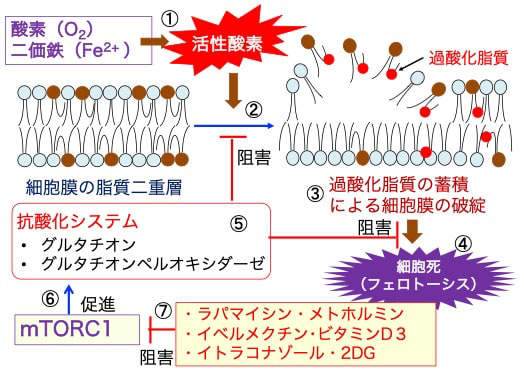
図:酸素(O2)とニ価鉄(Fe2+)が反応して活性酸素が発生する(①)。活性酸素が細胞膜の脂質二重層を酸化し(②)、過酸化脂質が蓄積すると細胞膜が破綻し(③)、フェロトーシス誘導によって細胞死が起こる(④)。細胞はグルタチオンやグルタチオンペルオキシダーゼなどによる抗酸化システムによって、細胞膜の脂質酸化とフェロトーシスを阻止する(⑤)。哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:mTORC1)は、細胞のグルタチンやグルタチオンペルオキシダーゼの産生を促進する作用によってフェロトーシスを阻止する(⑥)。ラパマイシン、メトホルミン、イベルメクチン、ビタミンD3、イトラコナゾール、2-デオキシ-D-グルコース(2-DG)はmTORC1の活性を阻害する作用によって、フェロトーシス誘導を促進する(⑦)
909)mTORC1阻害はがん細胞のフェロトーシスを促進する
【酸素と鉄が細胞膜を傷害する】
フェロトーシスによる細胞死は、細胞膜の過酸化脂質の蓄積によって起こります。細胞はグルタチオンやグルタチオン・ペルオキシダーゼなどの抗酸化システムを使って脂質の酸化を防いでいます。細胞膜の脂質の酸化を防ぐメカニズムについて説明します。
地球上の初期の生物は酸素のない状態で進化しました。地球が誕生したのは約46億年前で、その地球に最初の生命(=生物)が出現するのは8億年後の今から約38億年前です。最初の生物は、はっきりした核を持たない(核膜をもった核が無い)原核生物です。これらの生物は海の中を漂う有機物を利用し、酸素を使わずに生息していました。
約25億年前に光合成を行う藍藻(シアノバクテリア)が登場します。それまで地球上には酸素は存在しませんでしたが、そこに太陽光エネルギーを使って無機物である二酸化炭素と水からグルコース(ブドウ糖)などの有機物を作り出し、酸素を放出するという光合成を行う真正細菌の藍藻(シアノバクテリア)が出現したのです。
この酸素放出型光合成を行う生物の出現によって、それまで無酸素状態だった地球大気に大量の酸素分子が放出され、最終的に現在の大気は21%の酸素濃度に達しています。
初期の生物の細胞膜は単純な飽和脂肪酸で構成されていたと思われますが、やがて不飽和脂肪酸が細胞膜に利用されるようになります。細胞膜の不飽和脂肪酸は膜流動性を高めることを可能にし、生物が進化するために必要だったためです。
飽和脂肪酸は常温で固体です。温度が低い状態で細胞膜の流動性を維持するためには不飽和脂肪酸が必要なのです。
しかし、不飽和脂肪酸を有する細胞膜で構成される生物にとって大気中の大量の酸素の出現は、極めて困難な出来事でした。なぜなら、不飽和脂肪酸は酸素の存在下で脂質過酸化を受けやすいからです。そしてこの過酸化反応は2価金属、特に2価の鉄イオン(Fe2+)によって劇的に加速されます。
そこで、生物は酸素と鉄イオンによる細胞膜の酸化傷害を阻止するために、グルタチオン(GSH)とグルタチオンペルオキシダーゼ(GPx)による抗酸化システムを発達させました。(下図)

図:飽和脂肪酸は常温で固体なので、飽和脂肪酸の多い細胞膜は流動性が低い(①)。不飽和脂肪酸は常温で液体なので、不飽和脂肪酸の多い細胞膜は流動性が高い(②)。しかし、不飽和脂肪酸は酸素(O2)と2価鉄(Fe2+)の存在下で酸化されやすい(③)。細胞膜に過酸化脂質が蓄積すると、細胞膜が破綻してフェロトーシスによる細胞死が誘導される(④)。細胞はグルタチオン(GSH)やグルタチオンペルオキシダーゼ(GPx)などの抗酸化システムによって細胞膜の酸化を防いでいる(⑤)。
【還元型グルタチオンが活性酸素やフリーラジカルを消去する】
グルタチオン(Glutathione)というのは、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したペプチドです。γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成します。
引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。グルタチオンの合成にはATPが必要です。
つまり、グルタミン酸やシステインやグリシンが不足したり、ATPが十分に産生できなかったり、γ-グルタミルシステイン合成酵素やグルタチオン合成酵素の活性が阻害されれば、グルタチオンの濃度は低下して、酸化ストレスに対する抵抗力が低下することになります。(下図)。

図:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)がATPを使って結合して合成される。
グルタチオンは細胞内に0.5〜10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
還元型のグルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。つまり、酸化型は、2分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。
細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオン還元酵素で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。このNADPHはペントースリン酸経路で産生されます。(下図)

図:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。NADPHはペントースリン酸経路から供給される。
がん細胞のグルコース取り込みや解糖系やペントースリン酸経路を阻害するケトン食や2-デオキシ-D-グルコースやジクロロ酢酸ナトリウムはNADPHの供給を減らすことによって、グルタチオンの合成を低下させ、酸化ストレスに対する抵抗性を減弱させることができます。ATP産生低下はグルタチオン合成をさらに低下させます。また、NADPHの産生低下は脂肪酸合成を抑制して細胞増殖を低下します。
【グルタチオンペルオキシダーゼ4が過酸化水素や過酸化脂質を消去する】
グルタチオンペルオキシダーゼ(glutathione peroxidase: GPx)は活性中心にセレンを有する酵素で、グルタチオン(GSH)の存在下で 過酸化水素(H2O2)を水(H2O)に還元するほか、過酸化脂質(LOOH)を還元する機能を有し、 スーパーオキサイドジスムターゼ、カタラーゼとともに生体内において重要な抗酸化作用を担っていると考えられています。(下図)
図:グルタチオンペルオキシダーゼは、過酸化水素(H2O2)を還元型グルタチオン(GSH)の存在下で水(H2O)に代謝させ、酸化型グルタチオン(GSSG)を生成する。酸化型グルタチオンはペントースリン酸経路から供給されるNADPHを使ってグルタチオン還元酵素によって還元型グルタチオンに還元される。過酸化脂質(LOOH)の還元もグルタチオンペルオキシダーゼが担う。
グルタチオンペルオキシダーゼにはいくつかのサブタイプが存在しますが、細胞内の脂質過酸化物を還元する役割で重要なのがグルタチオンペルオキシダーゼ4(GPx4)です。GPx4は特に脂質過酸化物を還元することに特化しており、鉄依存性細胞死(フェロトーシス)の調節においても中心的な役割を果たしています。
GPx4の活性が低下するとフェロトーシスが発生しやすくなります。このため、GPx4は神経変性疾患、がん、およびその他の健康問題の研究において重要なターゲットとなっています。
細胞膜の過酸化脂質を還元できるのはグルタチオンペルオキシダーゼ4(GPx4)だけです。したがって、グルタチオン、グルタチオンペルオキシダーゼ4、グルタチオン還元酵素、NADPH(ペントース・リン酸回路から供給)、ビタミンB2(グルタチオン・ペルオキシダーゼの補酵素)のどれかが不足しても過酸化脂質が増えます。(下図)

図:グルタチオンペルオキシダーゼにはいくつかのサブタイプが存在するが、細胞内の脂質過酸化物を還元できるのはグルタチオンペルオキシダーゼ4(GPx4)だけ。したがって、GPx4の活性が低下するとフェロトーシスが発生しやすくなる。
グルタチオンペルオキシダーゼ4を阻害するとがん細胞の治療抵抗性を阻止できることが報告されています。
以下のような報告があります。Natureの論文です。
Dependency of a therapy-resistant state of cancer cells on a lipid peroxidase pathway(がん細胞の治療抵抗性状態は脂質ペルオキシダーゼ経路に依存する)Nature. 2017 Jul 27; 547(7664): 453–457.
がん細胞の治療抵抗性の要因としてグルタチオンペルオキシダーゼ4(GPx4)が重要であることを報告しています。
GPx4 はセレノシステイン含有酵素で、脂質過酸化物を消散させ、鉄を介した過酸化物の産生を阻止してフェロトーシス細胞死を阻止します。
GPx4を阻害すると、フェロトーシスが起こりやすくなって治療抵抗性が阻止できるという報告です。
【mTORC1がフェロトーシス誘導を阻害する】
栄養やエネルギーの供給が減少すれば増殖速度は低下し、栄養やエネルギーの供給が停止すれば細胞は増殖できません。栄養源の取込みを促進し、細胞の増殖を亢進する働きを担っているのが、哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)です。
mTORC1がグルタチオンやグルタチオンペルオキシダーゼ4の産生を促進し、フェロトーシス誘導を阻止します。つまり、がん細胞のmTORC1活性を阻害するとフェロトーシス誘導を亢進できます。以下のような報告があります。
mTORC1 couples cyst(e)ine availability with GPX4 protein synthesis and ferroptosis regulation.(mTORC1はシステインの利用可能性とGPX4タンパク質合成およびフェロトーシス調節を結びつける)Nat Commun. 2021 Mar 11;12:1589.
【要約】
グルタチオンペルオキシダーゼ4(GPX4)は、グルタチオン(GSH)を利用して脂質過酸化を解毒し、フェロトーシスの阻害に重要な役割を果たす。セレンタンパク質であるGPX4タンパク質合成は、非常に非効率的でエネルギーコストがかかる。この研究では、SLC7A11を介したシスチン取り込みがGSH合成だけでなくGPX4タンパク質合成も促進することを明らかにした。
機構的には、システインが哺乳類ラパマイシン標的タンパクし複合体1(mTORC1)を活性化し、少なくとも部分的にRag-mTORC1-4EBPシグナル伝達軸を介してGPX4タンパク質合成を促進することを明らかにした。
mTORC1 の薬理学的阻害により、GPX4 タンパク質レベルが低下し、がん細胞がフェロトーシスに対して敏感になり、フェロトーシス誘導剤と相乗効果を発揮して、生体内での患者由来異種移植腫瘍の増殖が抑制されることが示された。
これらの結果を総合すると、GPX4 タンパク質合成とシステインの利用可能性を調整する制御メカニズムが明らかになり、がん治療において mTORC1 阻害剤とフェロトーシス誘導剤の併用療法が推奨される。
この論文の詳細は専門的なので省きますが、「mTORC1を阻害すると脂質酸化を阻止するグルタチオンペルオキシダーゼ4のタンパク質レベルが低下し、フェロトーシスが促進される」ということです。
アルテスネイト+5-アミノレブリン酸+鉄剤などを用いたがん細胞のフェロトーシス誘導療法にmTORC1を阻害する方法はがん細胞のフェロトーシス誘導を促進できるということです。(下図)

図:酸素(O2)とニ価鉄(Fe2+)が反応して活性酸素が発生する(①)。活性酸素の細胞膜の脂質二重層を酸化し(②)、過酸化脂質が蓄積すると細胞膜が破綻し(③)、フェロトーシス誘導によって細胞死が起こる(④)。細胞はグルタチオンやグルタチオンペルオキシダーゼなどによる抗酸化システムによって、細胞膜の酸化とフェロトーシスを阻止する(⑤)。哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:mTORC1)は細胞のグルタチンやグルタチオンペルオキシダーゼの産生を促進する作用によってフェロトーシスを阻止する(⑥)。
PI3K-AKT経路の下流エフェクターであるmTORC1は、フェロトーシス制御因子です。フェロトーシスに対する防御因子として機能するmTORC1は、複数のメカニズムを通じてがん細胞におけるフェロトーシスのプロセスの阻害に関与しています。
重要なメカニズムの1つは、脂質過酸化を防ぐことでフェロトーシスを防ぐ重要な酵素であるGPX4タンパク質合成をmTORC1は促進することです。
したがって、mTORC1の発現や活性を阻害すると、フェロトーシスを起こしやすくできます。
【ラパマイシンは哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)を阻害する】
ラパマイシン(Rapamycin)は1970年代にイースター島の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物で、シロリムス(Sirolimus)という別名で呼ばれることもあります。
イースター島は、チリ領の太平洋上に位置する火山島で、現地語名はラパ・ヌイ(Rapa Nui)と呼ばれています。「ラパ・ヌイ」とはポリネシア系の先住民の言葉で「広い大地」を意味します。モアイ像の建つ島として有名です。
ラパマイシンはラパ・ヌイにちなんで名付けられました。(下図)

図:ラパマイシンはモアイ像で有名なイースター島の土壌から発見された放線菌(Streptomyces hygroscopics)が産生する有機化合物
ラパマイシンは免疫抑制作用があり、米国では臓器移植の際の拒絶反応を防ぐために使用されています。さらに、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。
平滑筋細胞増殖抑制作用に関しては、狭心症や心筋梗塞の治療に使われる血管内ステントに冠動脈再狭窄予防効果を目的としてラパマイシンを配合したステントが製品化され、心臓カテーテル治療において使用されています。また、リンパ脈管筋腫症の治療薬としても使用されています。
ラパマイシンの生体内のターゲット分子が、哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)というタンパク質です。 mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
最初に酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
mTORにはmTOR複合体1(mTORC1)とmTOR複合体2(mTORC2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しており、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御を担っています。
インスリンやインスリン様成長因子(IGF-1)によって活性化されるのはmTORC1の方で、ラパマイシンで阻害されるのもmTORC1です(下図)。

図:哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)は複数のタンパク質から構成されるセリン・スレオニン・リン酸化酵素で、インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖因子によって活性化される。mTORC1はタンパク質合成・脂質合成・核酸合成を亢進する。ラパマイシンはFKBP12と結合し、mTORC1の活性を阻害する。
【mTORC1は栄養と増殖シグナルを感知して増殖を制御する】
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスです。
したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を分解して得られるATP)が必要です。
増殖因子や成長因子やホルモンなどによって細胞増殖のシグナルが来たときに、栄養素とエネルギーの供給が十分にある条件で、タンパク質や脂質の合成を促進して細胞増殖を実行するのが哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)です。
インスリン、インスリン様成長因子-1、成長ホルモンなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。
活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存の調節を行います。このAktのターゲットの一つがmTORC1です。
AKTは結節性硬化症の原因遺伝子産物であるTSC1/TSC2複合体のTSC2をリン酸化して活性を低下させ、small GTPaseの一種である Rheb (Ras Homolog enriched in Brain)の活性を高めます。活性化したRhebは mTORのキナーゼ触媒ドメインに直接結合してmTORC1のキナーゼ活性を高めます。
アミノ酸は別の経路でmTORC1の活性を高めます。mTORC1の活性化においてアミノ酸(哺乳類では特にロイシン)が必須であり,これはアミノ酸が十分である場合に限り細胞がタンパク合成を開始できる仕組みと言えます。
このようにして、栄養源と増殖シグナルを感知して細胞の成長や分裂を促進するのがmTORC1です。
一方、細胞内のエネルギー低下を感知するのがAMP依存性プロテインキナーゼ(AMPK) です。グルコース欠乏や低酸素などにより細胞内ATP量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはmTORC1活性を抑制して、異化の亢進や細胞周期の停止をもたらし、エネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせます。
AMPKはTSC2のリン酸化(活性化)によるmTORC1の間接的な抑制と、mTORC1構成ユニットのRaptorのリン酸化による直接的な阻害のメカニズムでmTORC1活性を低下させ、細胞の増殖を抑制します。
このように、mTORC1とAMPKは、細胞内の栄養素とエネルギーの状況を感知して増殖の制御に中心的な役割を担っています。
以上の観点から、mTORC1活性を抑制し、AMPK活性を亢進することは、がん細胞の増殖抑制に有効です(下図)。

図:インスリンやインスリン様成長因子-1などの増殖刺激が細胞に作用すると(①)、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する(②)。活性化したAktはTSC1/TSC2を阻害してRheb(Ras homolog enriched in brain)を活性化し(③)、mTORC1を活性化する(④)。低栄養の場合は、ATPの産生が低下してAMP/ATP比が上昇し、AMP依存性プロテインキナーゼ(AMPK)が活性化される(⑤)。AMPKは、TSC1/TSC2の活性化(⑥)やmTORC1の直接的な阻害作用によってmTORC1活性を抑制する(⑦)。このようにmTORC1とAMPKは栄養状態と増殖シグナルを感知して細胞の増殖や生存を制御している。ラパマイシンはFKBP12と結合し、mTORC1の活性を阻害する(⑧)。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
AMP活性化プロテインキナーゼ(AMPK)の活性化は、mTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を阻害します。
一方、2-デオキシ-D-グルコース(2-DG)はグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
さらに、ケトン食やビタミンD3もAMPKを活性化し、mTORC1を抑制します。イベルメクチンはAktの活性化を抑制します。これらを組み合わせると、がん細胞のmTORC1活性を相乗的に抑制して、増殖を抑えることができます。(下図)

図: インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖刺激が細胞に作用すると、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する(①)。活性化したAktは哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)をリン酸化して活性化する(②)。mTORC1は栄養素取込み、エネルギー産生、細胞分裂・増殖、細胞生存を促進してがん細胞の増殖を促進する(③)。運動、絶食、カロリー制限、ケトン食はAMP:ATP比を高めてAMP活性化プロテインキナーゼ(AMPK)を活性化する(④)。メトホルミンとビタミンD3はAMPKを活性化する(⑤)。活性化したAMPKはmTORC1を抑制する(⑥)。イベルメクチンはPI3K/Akt/mTORC1シグナル経路を阻害し(⑦)、ラパマイシンとイトラコナゾールはmTORC1を直接阻害する(⑧)。2-デオキシグルコースは解糖系を阻害する作用によって、がん細胞のエネルギー産生を阻害する(⑨)。
以上から、ラパマイシン、メトホルミン、イベルメクチン、ビタミンD3、イトラコナゾール、2-デオキシ-D-グルコース(2-DG)は哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:mTORC1)の活性を阻害することによって、フェロトーシス誘導を促進することができます。(トップの図)
上記の内容は以下のスライドにも解説しています。
| « 908) マラリア... | 910)がん治療... » |



