がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
907)アルテミシニン誘導体のフェロトーシス誘導作用(その2):ヘムがエンドペルオキシド架橋を開裂する
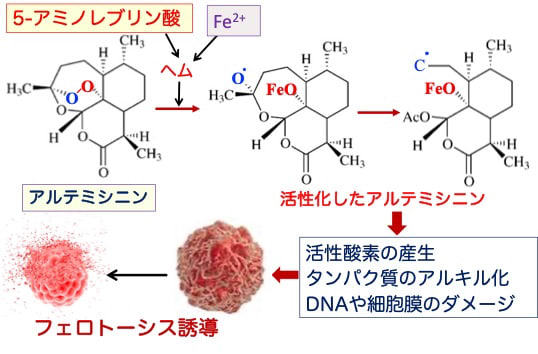
 図:5-アミノレブリン酸と鉄(Fe2+)はヘムの合成を増やし、ヘムと鉄(Fe2+)がアルテミシニンおよびアルテミシニン誘導体のエンドペルオキシド架橋を開裂する。エンドペルオキシド架橋が開裂して活性化したアルテミシニンは、活性酸素の産生を増やし、タンパク質をアルキル化し、DNAや細胞膜の酸化傷害を引き起こし、がん細胞のフェロトーシスを誘導する。
図:5-アミノレブリン酸と鉄(Fe2+)はヘムの合成を増やし、ヘムと鉄(Fe2+)がアルテミシニンおよびアルテミシニン誘導体のエンドペルオキシド架橋を開裂する。エンドペルオキシド架橋が開裂して活性化したアルテミシニンは、活性酸素の産生を増やし、タンパク質をアルキル化し、DNAや細胞膜の酸化傷害を引き起こし、がん細胞のフェロトーシスを誘導する。
907)アルテミシニン誘導体のフェロトーシス誘導作用(その2):ヘムがエンドペルオキシド架橋を開裂する
【放射線と抗がん剤は活性酸素でがん細胞を死滅する】
放射線治療にも活性酸素が大きく関与しています。がん細胞に対する放射線治療の効果は、細胞のDNA分子の傷が多く蓄積することによって現れます。DNA傷害に際しては、放射線がDNA鎖を直接傷害する直接作用と、水の放射線分解によって発生するヒドロキシルラジカルがDNA鎖を傷害する間接作用の二つが関係していると考えられています。
多くの抗がん剤においても、細胞に傷害を与え細胞死が実行される過程で活性酸素種が関与しています。(図)

図:放射線がDNAを構成する分子の電子をはじき飛ばす(電離)ことによって、分子間の結合を切断して直接的にDNAを傷害する(①)。さらに、放射線は組織の水分子(H2O)を電離してヒドロキシルラジカル(OH・)を発生し、このヒドロキシルラジカルがDNA分子に間接的にダメージを与える(②)。抗がん剤の多くも、細胞死を誘導する過程で活性酸素の発生が関与している(③)。
放射線治療や抗がん剤治療ががん細胞に酸化傷害を引き起こして死滅させるというメカニズムから、フェロトーシスを誘導する治療法は、放射線や抗がん剤によるがん治療に対する抵抗性(耐性)を逆転させる治療戦略として注目されています。
【酸化ストレスを高めるがん治療法】
放射線治療も抗がん剤治療も、がん細胞に酸化ストレスを高める方向で作用します。したがって、放射線治療や抗がん剤治療を行っているときには抗酸化剤の併用は治療効果を妨げます。むしろ、酸化ストレスを高めることを併用すれば、治療効果を高めることができます。
「がんと酸化ストレスと抗酸化剤」に関する議論は相反する2つの意見があります。
「抗がん剤治療中や放射線治療中に抗酸化剤を併用すると副作用が軽減し効果も高まる」という意見と「抗酸化剤は抗がん剤や放射線治療の効き目を阻害する」という、全く相反する意見で、それぞれ実験データなどでともに根拠があるので、議論は長い間平行線でした。
抗酸化剤ががん治療を妨げる可能性については、今までも多くの議論が行われているので、抗酸化性サプリメントががんを悪化させるという意見の記事や論文をみてもあまり驚くことはありません。
抗がん剤や放射線治療中に抗酸化剤を併用すると副作用の軽減と抗腫瘍効果を高めるというメリットを補完医療を専門に行っている医療関係者は主張しています。一方、標準治療の立場の多くの人は、抗酸化剤がこれらの治療効果を妨げる可能性を指摘しています。
しかし、最近の考えは、「抗酸化剤は抗がん剤や放射線治療の効き目を阻害する」「がん細胞の抗酸化力を阻害する抗-抗酸化剤ががん治療薬として有望」という抗酸化剤有害説が優位に立っています。
実際に、最近のがん研究の傾向として、「がん細胞に酸化ストレスを高めるがん治療法」に関する研究論文が増えています。(下図)

図:放射線や多くの抗がん剤は活性酸素種を産生してがん細胞にダメージを与えて死滅させる(①)。したがって、このような治療を行っているときに抗酸化剤を併用すると細胞を死滅させる効果が減弱する(②)。がん細胞、特にがん幹細胞は、活性酸素種を消去するグルタチオンやチオレドキシンの細胞内レベルが高く、抗酸化酵素の発現を誘導する転写因子のNrf2の活性が高いので、活性酸素種によるダメージに抵抗性を示す(③)。したがって、がん細胞の抗酸化力を減弱させる抗-抗酸化剤(Anti-antioxidant)はがん治療薬として有望視されている(④)。
がん細胞は恒常的な増殖活性を示すために、グルコースの取込みと解糖系の亢進という特徴を持ちます。さらに、抗酸化システムを増強して酸化ストレスに対する抵抗性を高めて細胞死を防いでいます。そのため、がん細胞はグルコースの取り込みや解糖系の阻害や、抗酸化システムの阻害で死滅するという特徴があります。
たとえば、ミトコンドリアでの酸化的リン酸化を亢進すると活性酸素の産生が増えて酸化ストレスが増大し、細胞死を誘導できます。細胞内の酸化還元バランスを破綻させてがん細胞を死滅させる治療法が注目されています。(図)
図:ミトコンドリアで酸素呼吸によって活性酸素が発生する(①)。活性酸素は細胞に酸化傷害を引き起こすが、細胞内には活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力(活性酸素消去能)が存在する(②)。細胞内には活性酸素の産生増加に応じて、抗酸化酵素の発現や活性を亢進することによって抗酸化力を高めるメカニズムが存在し、酸化還元のバランスを維持することによって酸化傷害の発生を防いでいる(③)。しかし、細胞内の活性酸素の産生量が増えたり、抗酸化力が低下すると、酸化還元バランスが破綻して(④)、酸化ストレスが亢進し(⑤)。細胞の増殖が抑制され、細胞死が誘導される(⑥)。
【フェロトーシスは鉄介在性の細胞死】
細胞死のメカニズムとしてアポトーシスやネクローシスなどがあります。
アポトーシス(Apoptosis)は正常細胞が老化して新しい細胞に置き換わるような、生体の細胞回転で使われる細胞死のパターンです。免疫細胞や炎症細胞が気づかないような死に方をします。
一方、脳梗塞や心筋梗塞のような虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。ネクローシスの場合は組織の傷害を生体に知らせて、防御と修復を起こす必要があるからです。
最近、フェロトーシス(Ferroptosis)という細胞死が提唱されています。「フェロ(Ferro)」は鉄という意味で、「ptosis」は「下垂する」という意味で、「枯れ葉が枝から落ちる様から細胞の死を意味」します。
フェロトーシスでは,鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって,細胞死が起こります。細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。

図:二価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で、脂質の酸化が強く起こり、脂質二重層の破綻によって誘導される細胞死をフェロトーシスという。
アルテスネイト服用の数時間前に鉄剤を服用するとアルテスネイトの抗腫瘍作用が増強することが報告されています。服用した鉄の多くががん細胞に取り込まれるためです。
がん細胞では鉄の取込みが亢進しており、この細胞内の鉄にアルテスネイトが反応して細胞内で活性酸素を産生させ、脂質過酸化などの細胞傷害を引き起こすと考えられています。2015年頃から、「アルテミシニン誘導体は腫瘍細胞に鉄依存性細胞死(フェロトーシス)を誘導する」 という内容の研究結果が複数報告されています。
正常細胞は鉄の含有量が少なく、がん細胞では鉄の含有量が多いので、アルテスネイトはがん細胞に選択的にフェロトーシスによる細胞死を誘導することが示されています。
この場合、抗酸化剤を投与すると細胞死が阻止されます。つまり、がん細胞内に多く含まれる鉄イオンとアルテスネイトが反応して活性酸素が産生されることが細胞死のメカニズムだからです。

図:がん細胞はトランスフェリン受容体(①)の発現が亢進し、鉄(②)の取り込みが増え、鉄を多く含む。2価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で活性酸素の産生が増え(③)、脂質の酸化が強く起こり(④)、細胞膜の脂質二重層が破綻し(⑤)、細胞死(フェロトーシス)が誘導される(⑥)。正常細胞は鉄の含有量が少ないのでフェロトーシスは起こりにくい(⑦)。
【アルテミシニン誘導体はヘムや鉄と反応して活性酸素を産生する】
1970年代から80年代にかけて中国の科学者らが、伝統的な薬草である青蒿(Artemisia annua)からアルテミシニンを単離し、その誘導体であるジヒドロアルテミシニン、アルテメーター、アルテスネネイトを製造しました。これらアルテミシニン誘導体はマラリアの化学療法の最も重要な成分となりました。

図:中国の屠呦呦(Tu Youyou)博士は、古くからマラリアの治療に利用されてきた青蒿(せいこう)という薬草から活性成分としてアルテミシニンを発見した。アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、マラリアの治療薬として世界中で使用されている。屠博士は、この業績により 2015年度のノーベル医学生理学賞を受賞した。
アルテミシニン誘導体にはトリオキサン(trioxane)という3つの酸素原子を含む環状構造を持ち、この構造がアルテスネイトの薬理作用と関連します。
すなわち、トリオキサン環のエンドペルオキシド華僑(-O-O-)がヘムや鉄(Fe2+)で開裂すると活性酸素種を生成します。
エンドペルオキシド華僑が開裂して活性化したアルテスネイトは、活性酸素種の生成だけでなく、様々なタンパク質のアルキル化やDNAのダメージによって抗腫瘍活性を示します。

図:トリオキサン(trioxane)は3つの酸素原子を含む環状構造を持つ化合物。この構造がアルテスネイトの薬理効果(抗マラリア作用、抗がん作用)と関連する。
エンドペルオキシド架橋(-O-O-)にヘムの鉄が反応することによって、活性酸素種や炭素ラジカルが発生します(下図)。
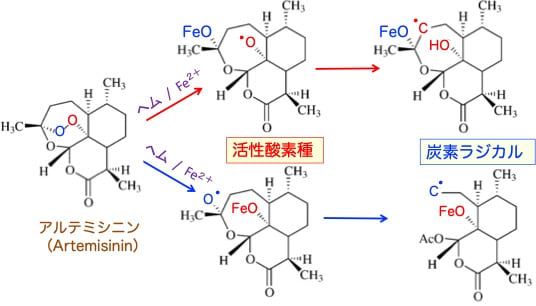
図:エンドペルオキシド架橋(-O-O-)の青い酸素(O)にヘムの鉄(Fe2+)がアタックすると、赤い酸素(O)がフリーラジカル(・O)になり、のちに炭素ラジカル(・C)が形成される(上のルート)。
エンドペルオキシド架橋(-O-O-)の赤い酸素(O)にヘムの鉄(Fe2+)がアタックすると、青い酸素(O)がフリーラジカル(・O)になり、のちに炭素ラジカル(・C)が形成される(下のルート)。
このようにしてアルテミシンおよびアルテミシニン誘導体は活性酸素種と炭素ラジカルを発生する。
アルテミシニンおよびアルテミシニン誘導体のエンドペルオキシド架橋が、鉄(Fe2+)とヘムによって開裂して活性酸素や炭素ラジカルが発生し、これらのフリーラジカルが、細胞膜やDNAやタンパク質にダメージを与えて、細胞を死滅します。正常細胞に比べてがん細胞はフリーの二価鉄(Fe2+)やヘムが多く含まれるので、がん細胞が比較的選択的にダメージを受けます。

図:アルテミシニンおよびアルテミシニン誘導体は、がん細胞に多く含まれるフリーのヘムと鉄(Fe2+)と反応してエンドペルオキシド架橋が開裂して活性化される。活性化したアルテミシニンは活性酸素の産生、タンパク質のアルキル化、DNAや細胞膜のダメージによって、がん細胞の増殖や転移を抑制し、細胞死を誘導する。
この活性酸素依存性の作用メカニズム以外に、エンドペルオキシドが関与しない作用メカニズムでの抗腫瘍効果も報告されています。これらの総合的な作用でアルテミシンおよびアルテミシニン誘導体は抗がん作用を発揮します。

図:アルテミシニンとその誘導体のエンドペルオキシド架橋が二価鉄(Fe2+)やヘムによって開裂して活性化された アルテミシニンは、活性酸素の産生増加、タンパク質のアルキル化、DNAや細胞膜のダメージによって抗腫瘍効果を発揮する。さらに、エンドペルオキシドとは関連しないメカニズムでも抗腫瘍効果を発揮する。
【5-アミノレブリン酸はヘムの前駆物質】
ヘモグロビンは、赤血球に含まれる鉄を含んだタンパク質で、酸素を肺から体の各部位に運ぶ役割を担っています。
ヘモグロビンは、4つのポリペプチド鎖(α鎖とβ鎖)から構成され、各鎖に1つのヘム基という鉄を含む分子が結合しています。この鉄が酸素と結びつくため、酸素運搬に重要な役割を果たします。

図:ヘモグロビンは赤血球内に存在する酸素運搬タンパク質。4つのポリペプチド鎖(サブユニット)から構成され、それぞれのサブユニットに1つのヘムが結合している。ヘムの中心にある鉄イオン(Fe2+)が酸素分子と結合する。
ミトコンドリアの中でグリシンとスクシニルCoAから生成された5-アミノレブリン酸は一度ミトコンドリアの外に出て行きます。細胞質内で何種類かのポルフィリンという物質に変化し、再びミトコンドリアに戻ってきます。そして、最終的にプロトポルフィリンIXに変わります。このプロトポルフィリンIXに鉄がくっついてできたのがヘムという物質です。(図)

図:ミトコンドリアの中でグリシンとスクシニルCoAから合成された5-アミノレブリン酸は、ミトコンドリアの外に出て、細胞質内で何種類かのポルフィリンに変化し、コプロポリフィリノーゲンになって再びミトコンドリアに取り込まれ、最終的にプロトポルフィリンIXに変わる。このプロトポルフィリンIXに鉄が結合してヘムという物質が作られる。
動物細胞では、8分子の5-アミノレブリン酸がポルフィリン環を形成して、中心に2価鉄が配位されてヘムになります。植物細胞ではプロトポルフィリンIXはマグネシウムと結合してクロロフィル(葉緑素)になります。クロロフィルは植物が光合成をする上でなくてはならない物質です。
ポルフィリンは、鉄・銅・亜鉛などの金属イオンと結合してヘムやクロロフィルなどを形成します。これらの化合物は、生物体内で酸素の運搬(ヘモグロビンとミオグロビン)、電子の移動(シトクロム)、光合成(クロロフィル)など生命維持に必要な多くの化学反応に関与しています。(図)

図:5-アミノレブリン酸はプロトポルフィリンIXになり、鉄(Fe)が結合してヘムになる。ヘムはヘモグロビンやシトクロム、カタラーゼ、P450など多くのヘムタンパク質を構成し、細胞内で重要な働きを担っている。植物では、プロトポルフィリンIXにマグネシウム(Mg)が配位されるとクロロフィル(葉緑素)となり、光合成に寄与する。
一般的に、ミトコンドリア機能を活性化する物質は、エネルギー(ATP)産生を増やすので正常細胞の生理機能を高めます。
しかし、がん細胞ではミトコンドリアを活性化すると活性酸素の産生が増加し、細胞の酸化傷害によって増殖抑制や細胞死が誘導されます。
体の老化に伴って体内の細胞のミトコンドリア機能が低下し、これが心臓や骨格筋や神経系やその他の臓器の機能低下の主な原因になっています。これらの臓器ではミトコンドリアで酸素呼吸(酸化的リン酸化)によってエネルギー(ATP)を産生しています。体の老化に伴う生理機能の低下を予防するには、ミトコンドリアの量と機能を維持することが重要です。ミトコンドリアの量と機能を高めることができれば、体を若返らせることができます。
5-アミノレブリン酸 (5-aminolevulinic acid:5-ALA) は、炭素数5で分子量131の動物および植物のミトコンドリアによって生合成される天然のアミノ酸です。5-アミノレブリン酸はミトコンドリアの中でアミノ酸の一種のグリシンと、クエン酸回路(TCA回路)で生成されるスクシニルCoAという2つの物質から作られます。
5-アミノレブリン酸はミトコンドリアを活性化する作用があり、抗老化作用を発揮するサプリメントとして人気があります。しかし、がん細胞に対してはミトコンドリアにおける活性酸素の産生を高めて酸化傷害を増強する作用が報告されています。つまり、「5-アミノレブリン酸は健康寿命を延ばし、がん細胞を死滅する」サプリメントと言えます。(図)

図:5-アミノレブリン酸はグリシンとスクシニルCoAからミトコンドリアで合成され、ミトコンドリア機能を活性化する作用がある。ミトコンドリア機能を高め、糖尿病や肥満など代謝性疾患を改善し、老化性疾患の進行を抑制し、健康寿命を延ばす抗老化作用を示す。一方、がん細胞に対しては、酸化ストレスを高め、がん細胞の増殖抑制とフェロトーシス誘導による抗がん作用を発揮する。
【5-アミノレブリン酸は光線力学療法に使われる】
5-アミノレブリン酸(5-ALA)はミトコンドリア機能を高める効果があり、抗老化、食後高血糖対策、脂質減少などの目的でサプリメントとして市販されています。5-ALAは抗老化のサプリメントとして使用される以外に、がんの診断や治療においても使用されています。
5-ALAはプロトポルフィリンIX (PpIX) という光感受性物質の前駆体として体内で利用されます。5-ALAを体内に投与すると、がん細胞内に多く取り込まれPpIXに変換されます。
プロトポルフィリンIX (PpIX)は青色可視光(375-445nm)で励起すると、赤色蛍光(600-740nm)を発光します。このように5-ALAを光感受性物質として用いてがん細胞を赤色に蛍光発光させるがん診断法を光線力学診断と言います。
また、PpIXは特定の波長の光(赤または近赤外光)を照射すると活性酸素種を生成し、がん細胞を破壊します。がん細胞に特異的に過剰集積したPpⅨに、赤色可視光(600-740nm)や緑色可視光(480-580nm)で励起し、がん細胞内で活性酸素を発生させて酸化傷害を与える治療法を光線力学療法と言います。
5-ALAを使った光線力学療法は、特に脳腫瘍、皮膚がん、頭頸部がん、膀胱がんなどの治療に利用されています。5-ALAはがん細胞により効率的に取り込まれ、健康な細胞にはほとんど影響を及ぼさないため、治療の副作用を最小限に抑えることができます。
がん細胞は 5-ALAを多く取り込み、ミトコンドリア内でプロトポルフィリンⅨ(PpⅨ)に生合成されます。がん細胞ではPpⅨが過剰に集積します。これは正常細胞に比べてがん細胞が5-ALAをより効率的に取り込み、PpIXに変換する能力が高いためです。
マウスの乳がん細胞に対する 5-アミノレブリン酸 (5-ALA) を使った光線力学療法の細胞毒性に対するアルテスネイトとアルテメーターの影響を検討した実験が報告されています。アルテスネイトやアルテメーターが5-ALAを使った光線力学療法の効果を増強する結果が報告されています。これらの結果は、5-アミノレブリン酸と鉄はアルテスネイトの抗腫瘍効果を増強する可能性を示唆しています。
(Antimalarial Drugs Enhance the Cytotoxicity of 5-Aminolevulinic Acid-Based Photodynamic Therapy against the Mammary Tumor Cells of Mice In Vitro.Molecules. 2019 Oct 29; 24(21): 3891.)
【フリーの鉄よりヘムの方がアルテスネイトの抗がん作用を増強する】
フリーの鉄よりヘムの方がアルテスネイトの抗がん作用を増強することが報告されています。
Heme activates artemisinin more efficiently than hemin, inorganic iron, or hemoglobin. (ヘムはヘミン、無機鉄、ヘモグロビンよりも効率的にアルテミシニンを活性化する)Bioorg Med Chem. 2008 Aug 15;16(16):7853-61.
アルテミシニン誘導体は、酸化還元反応を通じて抗マラリア活性を発揮すると考えられます。ヘム、無機鉄、ヘモグロビンは全て、アルテミシニンを活性化する重要な分子として関与していると考えられています。そこで、アルテミシニンと様々な酸化還元形態のヘム、第一鉄、脱酸素化ヘモグロビンおよび酸素化ヘモグロビンとの反応を分析しました。
その結果、ヘムは他の鉄含有分子よりもはるかに効率的にアルテミシニンと反応し、活性酸素の産生を高めました。
ヒトがん細胞株のHeLa細胞と、HeLa細胞のミトコンドリアDNAを欠損させた細胞(HeLaρ0)の2種類のがん細胞株を用いてアルテスネイトの抗腫瘍活性を比較した実験があります。
The Role of Heme and the Mitochondrion in the Chemical and Molecular Mechanisms of Mammalian Cell Death Induced by the Artemisinin Antimalarials.(抗マラリア薬アルテミシニンによって誘導される哺乳類細胞の細胞死の化学的・分子生物学的メカニズムにおけるヘムとミトコンドリアの役割)J Biol Chem. 2011 Jan 14; 286(2): 987–996.
ミトコンドリアは固有のDNA(ミトコンドリアDNA)を持ち、このミトコンドリアDNAには呼吸酵素複合体IからVを構成する85種類のサブユニットのうち13種類のタンパク質を作成する遺伝子が存在します。従って、ミトコンドリアDNAを欠失させるとミトコンドリアでの酸化的リン酸化によるATP産生が起こらなくなります。
ミトコンドリアDNAが欠損しても、酸化的リン酸化以外のミトコンドリアの機能は維持できます。がん細胞はミトコンドリアでの酸素を使ったATP産生を行わなくても、解糖系でATPを賄うことができるので、酸化的リン酸化が障害されても生存はできます。
アルテスネイト存在下で48時間培養した場合の50%細胞致死量はHeLa細胞が6±3μMで、ミトコンドリアDNAを欠損したHeLaρ0細胞では34±5μMでした。
つまり、ミトコンドリアでの酸化的リン酸化が低下しているとアルテスネイトの殺細胞作用が減弱するという結果です。これは、ミトコンドリアの酸化的リン酸化を亢進するとアルテスネイトの抗がん作用を増強できることを示しています。
また、アルテスネイトの殺細胞作用は、細胞のヘムの合成を亢進すると増強し、ヘムの合成を阻害すると減弱することがいます。つまり、アルテスネイトの殺細胞作用の活性化にはヘムの存在が重要であることを示しています。
以上の実験結果は、ミトコンドリアの酸化的リン酸化の活性化とヘム合成の亢進はアルテスネイトの殺細胞作用を増強できることを示しています。
これは、ミトコンドリアの酸化的リン酸化を亢進する5-アミノレブリン酸とジクロロ酢酸ナトリウムがアルテスネイトの抗腫瘍効果を増強する理由になります。

図:5-アミノレブリン酸とジクロロ酢酸ナトリウムはヘム合成と活性酸素産生を亢進して、アルテミシンの活性化を促進する
【5-アミノレブリン酸はがん細胞を酸化傷害で死滅する】
前述のように5-アミノレブリン酸はミトコンドリアを活性化して抗老化作用や美容効果を発揮するので、アンチエイジング(抗老化)のサプリメントとして人気があります。さらに、5-アミノレブリン酸はがん治療薬としても注目されています。
がん細胞では、ミトコンドリアの異常によって酸素を使ったエネルギー(ATP)産生の過程で活性酸素が発生しやすいという特徴があります。活性酸素の産生が増えると、がん細胞は酸化傷害によってダメージを受け、増殖が低下し、細胞死が誘導されます。
マウスに食道扁平上皮がんを移植する動物実験のモデルで、マウスに5-アミノレブリン酸(5-ALA)を投与するとがん細胞にフェロトーシスを誘導して抗腫瘍効果を発揮することが、鳥取大学医学部外科部門消化器・小児外科の研究グループから報告されています。
Antitumor Effect of 5-Aminolevulinic Acid Through Ferroptosis in Esophageal Squamous Cell Carcinoma.(食道扁平上皮がんにおけるフェロトーシスを介した5-アミノレブリン酸の抗腫瘍効果)Ann Surg Oncol. 2021 Jul;28(7):3996-4006.
体外から投与された5-ALAは、ヘム生合成経路を介してミトコンドリア内で酵素的にプロトポルフィリンIX(PpIX)に変換されます。蓄積したPpIXが活性酸素の産生を高めて抗腫瘍効果を発揮することが知られています。5-ALAはがん細胞に多く取り込まれる性質があるので、がん細胞に選択的に活性酸素の産生を高めて、がん細胞を死滅することができるという報告です。
5-ALAが前立腺がん細胞におけるミトコンドリアの活性酸素種の産生を促進することにより、放射線抵抗性を低下させることが奈良県立医科大学泌尿器科の研究グループから報告されています。
5-Aminolevulinic acid overcomes hypoxia-induced radiation resistance by enhancing mitochondrial reactive oxygen species production in prostate cancer cells.(5-アミノレブリン酸は、前立腺がん細胞におけるミトコンドリアの活性酸素種の生成を促進することにより、低酸素誘発性放射線抵抗性を克服する)Br J Cancer. 2022 Jul;127(2):350-363.
前述のように、5-アミノレブリン酸(5-ALA)は、ミトコンドリアで生合成されるプロトポルフィリン IX(PpIX)の前駆体です。蓄積された PpIX が光によって励起されると活性酸素種が生成されます。この研究では、光によって励起されなくても、5-ALA がその代謝物である PpIX を介して活性酸素種を生成することで、前立腺がん細胞の放射線療法に対する感受性を高めることを報告しています。
5-ALAは、放射線照射直後にミトコンドリア内の活性酸素種産生を増強し、ミトコンドリアの機能障害を引き起こして細胞死を増強しました。この結果は、5-ALA と放射線療法の併用療法が前立腺がんに対する放射線療法の抗がん効果を改善するための新しい戦略であることを示唆しています。
【5-アミノレブリン酸はヘムの合成を亢進してアルテスネイトの抗腫瘍効果を増強する】
アルテスネイトなどのアルテミシニン誘導体の殺細胞作用は正常細胞に比べてがん細胞に強く発現します。その理由として、がん細胞ではヘムの合成が亢進していることが指摘されています。実際に、ヘム合成の前駆物質の5-アミノレブリン酸を添加してがん細胞のヘム合成を亢進するとアルテミシニンの抗腫瘍活性が亢進することが示されています。
マウスの移植腫瘍を用いた実験でも、アルテミシニン単独よりもアルテミシニン+5-アミノレブリン酸の併用の方が抗腫瘍効果が高くなることを示しています。つまり、アルテミシニンと5-アミノレブリン酸の併用によるがん治療の可能性を示唆しています。
アルテスネイトは活性酸素を発生させてがん細胞を死滅します。鉄(クエン酸第一鉄ナトリウム)と5-アミノレブリン酸を併用すると活性酸素の産生量を増やし、アルテスネイトの抗腫瘍効果を高めることができます。
つまり、鉄剤(クエン酸第一鉄ナトリウムなど)と5-アミノレブリン酸をがん細胞に取り込ませてからアルテスネイトを服用すると、アルテスネイトによるフェロトーシス誘導を促進できます。(図)

図:がん細胞は低酸素誘導因子-1(HIF-1)の発現が亢進し(①)、HIF-1はトランスフェリン受容体の発現を亢進して(②)、がん細胞は鉄(Fe2+)を多く含む(③)。アルテスネイトは鉄と反応して活性酸素・フリーラジカルを産生し(④)、細胞膜の脂質を酸化して過酸化脂質が蓄積し(⑤)、フェロトーシスを誘導する(⑥)。HIF-1はヘム合成を亢進し(⑦)、ミトコンドリア内でヘムとアルテスネイトが反応して(⑧)、活性酸素・フリーラジカルを産生し(⑨)、ミトコンドリアの酸化傷害を増強してフェロトーシスを増強する(⑩)。
上記の内容は以下のスライドにまとめています。
https://www.youtube.com/watch?v=YQwF3rX9MGo
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
新刊
画像をクリックするとYouTubeの動画に移行します。
https://www.youtube.com/watch?v=7uYmvk3NlGw
| « 906)アルテミ... | 908) マラリア... » |





