がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
742)オールトランス・レチノイン酸(ATRA)と分化誘導療法(その1):ビタミンD3とベザフィブラートとの相乗効果
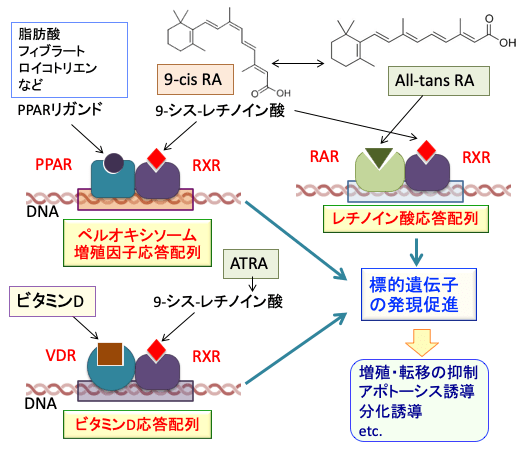
図: ペルオキシソーム増殖因子活性化受容体(PPAR)とビタミンD受容体(VDR)とレチノイン酸受容体(RAR)はそれぞれレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成して遺伝子のプロモーター領域の応答配列(ペルオキシソーム増殖因子応答配列とビタミンD応答配列とレチノイン酸応答配列)に結合して、それぞれの標的遺伝子の発現を誘導する。PPARとVDRとRARおよびRXRは細胞の増殖や細胞死(アポトーシス)や分化に関連する遺伝子の発現を調節しており、これらの核内受容体を活性化するリガンド(受容体に特異的に結合する物質)を複数組み合わせることによって抗がん作用や分化誘導作用を相乗的に高めることができる。
742)オールトランス・レチノイン酸(ATRA)と分化誘導療法(その1):ビタミンD3とベザフィブラートとの相乗効果
【幹細胞から様々な細胞に分化する】
私たちの体は、一つの受精卵が分裂して分かれた胚細胞が、神経細胞や心筋細胞や肝細胞や皮膚細胞など異なった機能を持つ細胞に分化していきます。「分化」というのは、単一あるいは同一であったものが、複雑化したり、異質化したりしていく現象で、未熟な胚細胞が異なった機能をもった細胞に成熟する過程が細胞分化です。

図:受精卵が胚盤胞となり、胚細胞は幹細胞となり、幹細胞から様々な細胞に分化する。
一般的に細胞分化は不可逆だと考えられていました。神経細胞や心筋細胞などへ最終分化した細胞は、分化後の細胞に必要な遺伝子以外の遺伝子の塩基配列がメチル化などのメカニズムで発現ができなくなり遺伝情報を失うためと考えられていました。
しかし、皮膚などの体細胞に少数の因子を導入して培養することによって、様々な組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力をもつ多能性幹細胞(iPS細胞)が、2006年に京都大学の山中伸弥教授の研究グループによって作成されました。
つまり、皮膚などに分化した細胞にある遺伝子を導入することで、あらゆる生体組織に成長できる万能な細胞を作れることが証明されたのです。これは、成熟した細胞を、多能性を持つ状態に初期化する、つまり「細胞の時間を巻き戻すことができる」ことを意味しています(下図)。

図:受精卵が胚細胞になり(①)、未熟な胚細胞が増殖と細胞分化を繰り返して体が完成する(②)。個体の体細胞(例えば皮膚の線維芽細胞)を採取し(③)、幾つかの多能性誘導因子(④)を加えて細胞培養すると、多能性を持ったiPS細胞(人工多能性幹細胞)が作成できる(⑤)。iPS細胞に他の体細胞への分化を誘導する因子を加えて培養すると心筋細胞や肝細胞など他の体細胞に分化誘導できる(⑥)。体細胞からiPS細胞への変換は「細胞の時間の巻き戻し」を実現したことになる(⑦)。
タイムマシンで過去に戻るような「物理的な時間の巻き戻し」は不可能ですが、体を若返らせるような「生物学的な時間の巻き戻し」は可能だと考えられています。病気になっても治療によって元の健康な状態に戻ることができます。トレーニングで筋力や持久力を若い時代のレベルに戻すことができれば、生物学的な時間を巻き戻したことになります。
【がん細胞は細胞の分化度が低下している】
前述の様に、「細胞分化」というのは、未熟な細胞(幹細胞)が、より成熟した方向に変化することです。一方、がん細胞は細胞分化が逆行して発生します。
がん細胞の病理組織分類で分化度というのがあります。分化の程度によって高分化、中分化、低分化、未分化と分けます。一般的に、分化度の高いがん細胞ほど増殖が遅く、転移が少なくおとなしいがんと言えます。
「分化度が高い」というのは、「より正常細胞に近い」ということを意味するからです。低分化や未分化のがん細胞はより悪性度が高いがん細胞です。
「がん細胞の分化を誘導する」というのは、がん細胞を正常細胞に近づけて、悪性度を低下させる方法です。
レチノイドX受容体やビタミンD受容体やペルオキシソーム増殖因子活性化受容体(PPAR)などの核内受容体の活性化を利用すれば、がん細胞の分化を誘導して、増殖や浸潤など悪性度を低下できる可能性があります。「がんの分化誘導療法」は「がん細胞を正常細胞に再分化させる」という方法であり、がん治療の理想であり、かなり昔から多くのがん研究者が注目しています。
このような分化誘導療法に、がん細胞の代謝異常(低酸素誘導因子の活性化、解糖系亢進、酸化的リン酸化の抑制)の正常化を併用する治療はがんとの共存を目指す方法として試してみる価値はあると思います。
この様ながん治療法は、細胞毒でがん細胞の死滅させる副作用の強い抗がん剤治療とは考え方が全く異なります。分化誘導療法単独で抗腫瘍効果が期待できますが、通常の抗がん剤治療と併用して相乗効果が期待できます。
【遺伝子発現を調節する核内受容体とリガンド】
DNAの遺伝情報は、まずRNAポリメラーゼによってRNAに転写され、さらにRNAからリボソームでタンパク質に翻訳されます。
DNAにはプロモーターやエンハンサーといった転写を制御する領域があり、この領域に結合して遺伝子の転写を促進したり抑制したりするタンパク質を転写因子と言います。転写因子は単独で機能する場合もありますが、他のタンパク質と複合体を形成して転写活性を実行する場合もあります。
このようにして、遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらにタンパク質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います。
つまり、転写因子というのは遺伝子発現を制御する機能を持つタンパク質です。
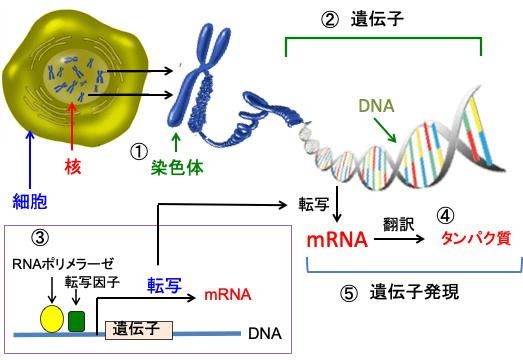
図:細胞の遺伝情報は核の中の染色体に記録されている(①)。遺伝子の本体はデオキシリボ核酸(DNA)で、一つの細胞には46個の染色体があり、合計で約30億塩基対の塩基配列情報がDNAに記録されている(②)。遺伝子DNAがメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域に結合する必要がある(③)。mRNAはリボソームでタンパク質に翻訳されてタンパク質が生成される(④)。このようにして遺伝子情報からmRNAとタンパク質が合成されて細胞の構造や機能に変化が生じる過程を「遺伝子発現」という(⑤)。
ホルモン(甲状腺ホルモンやステロイドホルモンなど)や脂溶性ビタミン(ビタミンAやビタミンD)や体内で生成される生理活性物質(脂肪酸やプロスタグランジンなど)によって遺伝子発現が調節される場合の転写因子として「核内受容体」というタンパク質があります。
核内受容体というのは、細胞核にあって、ホルモンなどが結合することでDNAの転写を調節している受容体タンパク質です。
核内受容体はリガンドが結合すると、構造の変化を起こして転写因子としての活性を持ちます。
リガンド(ligand)というのは、特定の受容体(レセプター)に特異的に結合する物質のことです。
核内受容体群は,1つの原初遺伝子から分子進化した遺伝子スーパーファミリーを形成しており,そのメンバーはヒトゲノム解読の結果,48種存在すると推定されています。
ステロイドホルモンやビタミンAやビタミンDが特定の遺伝子の発現を調節できるのは、これらが特定の核内受容体への結合を介して、そのリガンド依存的な転写制御を発揮するからです。
核内受容体には、リガンドが結合していないときに細胞質にいるものと細胞核にいるものの2種類があります。
前者はリガンドが結合すると核内に移行して遺伝子の転写調節領域に結合します。このクラスに分類される受容体としては、グルココルチコイド、アンドロゲン、プロゲステロン、エストロゲンなどの受容体があります。
後者はリガンド結合には関係なしに核内に局在し、核内でリガンドが結合すると構造の変化が起こり、標的遺伝子の転写を活性化します。甲状腺ホルモン、オールトランス・レチノイン酸、9-シスレチノイン酸、ビタミンDなどの受容体があります。
いずれにしても、体内の様々な生理活性物質がリガンドとして特定の受容体に結合することによって遺伝子発現が調節されることになります。
また、単なる栄養素と思われていた脂肪酸や、胆汁酸などの代謝産物も核内受容体に結合し、遺伝子転写を制御していることが明らかになっています。
リガンドと同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。つまり、核内受容体のアゴニストやアンタゴニストは特定の遺伝子の発現を調節する薬になります。

図:核内受容体にリガンドが結合すると受容体の構造に変化が起こり、核内に移行して遺伝子の転写調節領域に結合し、転写を調節する。
【がん細胞の分化を誘導する転写因子の活性化】
細胞の増殖や分化に関連した遺伝子を調節している転写因子を活性化することによって、細胞の増殖抑制や分化を制御できる可能性が指摘されています。
例えば、レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型であるAll-trans retinoic acid (ATRA:オールトランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイドによって発現が調節される遺伝子は細胞の分化や増殖や死(アポトーシス)の制御に重要は働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
Peroxisome Proliferator-activated Receptor (PPAR:ペルオキシソーム増殖因子活性化受容体)もレチノイド受容体と同じく核内受容体の一種です。
細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。PPARを活性化する物質は高脂血症や糖尿病の薬として古くから使用されていますが、これらの薬が一部のがん細胞に対して分化誘導やアポトーシス誘導などの抗腫瘍効果を示すことが報告されています。
ビタミンDも核内受容体に作用して遺伝子発現を調節することによって効果を発揮します。ビタミンD はレイチノイドやPPARのリガンドとの相乗効果がありますが、これはビタミンDの核内受容体がレチノイドX受容体(RXR)やPPARとヘテロ2量体を形成して転写因子として作用するからです。
レチノイド受容体やPPARやビタミンD受容体を刺激してがん細胞の分化を誘導し、増殖抑制やアポトーシス誘導を引き起こすことが一部のがんで可能であることが示されています。
【ビタミンAは遺伝子の発現を調節する】
ビタミンAは別名をレチノール(retinol)と言い、脊椎動物の発生過程、細胞分化、生殖、視覚、免疫系の調節などに重要な働きを行っている脂溶性ビタミンです。
レチノールは細胞内で代謝されてレチノイン酸に変換され、レチノイン酸が細胞核内の受容体に結合することによって遺伝子発現を誘導して様々な作用を発揮します。レチノイン酸によって細胞分化や増殖に関連する500以上の遺伝子が誘導されると言われています。
ベータカロテンは体内でビタミンAに変換されます。ベータカロテンやビタミンA(レチノール)は食品から摂取され、レチノールは肝臓で貯蔵されて必要に応じて血中に放出され、血清濃度は1~2μMの範囲で維持されています。
細胞内に取り込まれたレチノールはまずレチノール脱水素酵素によってレチナールアルデヒド(レチナール)に変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid:ATRA)になり、イソメラーゼで9-シス・レチノイン酸(9-cis RA)になります。ATRAと9-cis RAが遺伝子発現に関与します。(下図)

図:ベータカロテンとビタミンA(レチノール)は食品から摂取される。レチノールはレチノール脱水素酵素によってレチナールに変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid: ATRA)になり、さらに9-シス・レチノイン酸(9-cis RA)になる。ATRAはレチノイン酸受容体(RAR)に結合し、9-cis RAはレチノイドX受容体(RXR)に結合し、レチノイン酸応答配列に結合して標的遺伝子の発現を誘導する。レチノイドによって誘導される遺伝子は細胞分化やアポトーシスの誘導や、細胞増殖を抑制する働きに関与するので、がん細胞の増殖を抑制する方向で働く。
【レチノイドは細胞分化を誘導する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称で、生体内では活性型であるAll-trans retinoic acid (ATRA:オール・トランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやPPARやビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。
「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体です。
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物です。
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。
つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)
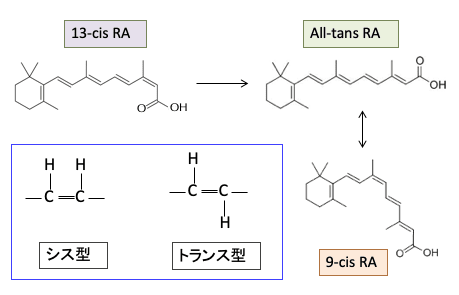
All-trans-RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis-RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。
この構造の違いによって分子式(C20H28O2)は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子は、細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でAll-trans レチノイン酸に変換されて効果を発揮します(下図)。All-trans レチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(ATRA)はレチノイン酸受容体(RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。ATRAの異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
オールトランス・レチノイン酸の分化誘導作用を強める方法としてビタミンD3とフェノフィブラートがあります。
【ビタミンD受容体の構造と機能】
ビタミンD受容体(VDR)は核内受容体スーパーファミリーの一員です。
ヒトのVDRは427個のアミノ酸からなる分子量50kDaのタンパク質です。
VDRに活性型ビタミンDが結合すると、9-cisレチノイン酸が結合したレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成し、ビタミンD標的遺伝子のプロモーター上流に存在する特異的エンハンサー配列であるビタミンD応答配列(vitamin D response element: VDRE)に結合します。
リガンドが結合して核内受容体の構造が変化するとコアクチベーター(転写共役活性化因子)が結合できるようになり、転写を促進できるようになります。
VDRE のコ ンセンサス配列は、AGGTCAの基本配列が2つ直列に並び、モチーフ間が3bp 離れたものであると考えられており、この配列の 5′上流側にRXRが、3′下流側にVDRが結合します。(下図)

図:活性型ビタミンD3(1α,25(OH)2ビタミンD3:Calcitriol)と結合したビタミンD受容体(VDR)は9-シス-レチノイン酸に結合したレチノイドX受容体(RXR)とヘテロ二量体を形成してビタミンD標的遺伝子の上流にあるビタミンD応答配列に結合する。このヘテロ二量体に転写共役活性化因子(コアクチベーター)などの多くのタンパク質が結合して転写活性が亢進する。ビタミンD標的遺伝子は細胞周期や細胞分化や細胞死の制御に関与する遺伝子が含まれ、その結果、がん細胞の増殖が抑制され、細胞分化が誘導され、細胞死が誘導される。
ビタミンD受容体の活性化による増殖抑制には、細胞周期の G0/G1停止とアポトーシスが関与するとの報告が多く、細胞分化も増殖抑制に伴って誘導されると考えられています。
ビタミンDは細胞周期をストップさせるがん抑制遺伝子のp21とp27タンパク質の発現を誘導します。この2つのタンパク質は細胞周期のG0/G1停止を引き起こすサイクリン依存性キナーゼ阻害因子です。
細胞周期は,サイクリン(cyclin)/サイクリン依存性キナー ゼ(cyclin dependent kinase: Cdk)やp21Cip1, p27Kip1, p57Kip2などのサイクリン依存性キナーゼの阻害因子などにより厳密に制御されています。
p21Cip1 遺伝子のプロモーター上流にビタミンD応答配列が存在し、ビタミンD受容体による直接的な遺伝子制御でp21Cip1遺伝子が発現誘導されることが明らかになっています。
【ペルオキシソームは細胞内の物質代謝に重要な役割を担っている】
ペルオキシソーム(Peroxisome)は酵母から哺乳動物までのほぼ全ての真核細胞が持つ直径0.1~2マイクロメートルの単層の膜で囲まれた球状の細胞小器官です。
哺乳類の細胞では1個の細胞に数百から数千個が存在し、多様な物質の酸化反応を行っています。
様々な物質を酸化する酸化酵素(オキシダーゼ)が多く含まれ、これらの酸化酵素は基質となる特定の有機化合物(R)から水素原子を奪う酸化反応を行います。
RH2 + O2 → R + H2O2
その結果、有害な過酸化水素(H2O2)が生じるので、この小器官の中には、過酸化水素を分解するカタラーゼが多く含まれています。
つまり、ペルオキシソームは過酸化水素が発生するような酸化反応を行う場所で、物質を酸化する酸化酵素(オキシダーゼ)が多く含まれ、発生した過酸化水素を消去する細胞内小器官という意味で「ペルオキシソーム」と命名されました。ソーム(-some)というのは細胞内小器官を表わす接尾語です。
ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリン体の代謝などが行われています。

図:真核細胞には様々な細胞内小器官が存在し、細胞内機能が分担されている。ペルオキシソームは、物質を酸化する様々な酸化酵素と、酸化反応によって生じる過酸化水素を消去するカタラーゼが多く存在する。
【糖や脂質の代謝に関与するペルオキシソーム増殖因子活性化受容体】
グルココルチコイドやエストロゲンやアンドロゲンのようなホルモンや、ビタミンAやビタミンDのような脂溶性ビタミンは、遺伝子発現を調節して生体機能を調節するのが本来の機能です。このような機能は、それぞれに特異的に反応する核内受容体と、標的遺伝子のDNAにそれらの受容体が結合する部位が存在するという仕組みで達成されます。48種類の核内受容体の存在が知られていますが、その中にはリガンド(受容体に特異的に結合して活性化する物質)がまだ明らかになっていないものも多数あります。食事から摂取する様々な成分や代謝産物や胆汁酸などがリガンドになる場合もあります。
栄養素として食事から摂取された脂質は、エネルギー産生や細胞膜の材料になるのが主な役割ですが、脂肪酸が代謝されてできる様々な物質が、遺伝子発現にも作用することが明らかになっています。
このような脂質代謝産物による遺伝子発現の調節に関わっている核内受容体としてペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptors:PPARs)が知られています。
ペルオキシソーム(Peroxisome)はほぼ全ての真核細胞が持つ直径0.1-2マイクロメートルの球状の細胞小器官で、多様な物質の酸化反応を行っています。ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリン体の代謝などが行われています。
ペルオキシソーム増殖因子あるいはペルオキシソーム増殖剤と呼ばれるペルオキシソームを増やす作用がある物質が古くから多数見つかっています。この中には、食事中の脂肪酸や、プラスチック可塑剤のフタル酸エステル類、除草剤のようなものも含まれています。
これらの物質がどのようにしてペルオキシソームを増やすのかという研究の結果、ペルオキシソーム増殖因子が結合する核内受容体が見つかり、「ペルオキシソーム増殖因子で活性化される受容体」という意味で「ペルオキシソーム増殖因子活性化受容体(PPAR)」という長い名前になっています。
このようにPPARは細胞内のペルオキシソームの増生を誘導する受容体として発見されましたが、その後の研究で、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群であることが明らかになりました。
脂質や糖質の代謝を促進するので、PPARを活性化する物質は高脂血症や糖尿病の治療薬として臨床で使用されています。
歴史的には、フィブラートのような抗高脂血症薬やインスリン抵抗性を改善するチアゾリジンジオン系の抗糖尿病薬は作用機序が不明なまま臨床的有効性が認められて使用されていましたが、これらの薬が細胞のペルオキシソームの数を増やすことが見つかり、その後にPPARを活性化することによって薬効を示すことが明らかになり、さらにPPARをターゲットにして新薬の開発を進められています。
さらに、PPARの活性化はがん細胞の増殖抑制やアポトーシスや分化の誘導作用などの抗がん作用を示すことが明らかになっています。PPARの活性化剤は糖尿病や高脂血症の治療薬として多くの種類が販売されているので、これらをがんの治療に応用する研究が行われています。
【PPARには3つのサブタイプがある】
ペルオキシソーム増殖因子活性化受容体(PPAR)はレチノイン酸受容体(RAR)やレチノイドX受容体(RXR)などと同じステロイドホルモン受容体スーパーファミリーに属する核内受容体の一種です。
このPPARには3種類のサブタイプがあります。主に肝臓や心臓や腎臓や消化管の細胞にあるアルファ型(PPARα)と、脂肪細胞に主にみられるガンマ型(PPARγ)、多くの組織で発現し脂肪酸燃焼とインスリン感受性を高めるデルタ型(PPARδ)です。
PPARαは大量のATPを必要とし脂肪酸酸化の盛んな臓器(肝臓・心臓・腎臓・消化管など)に多く存在します。PPARαは脂肪酸のβ酸化や細胞内外での脂質輸送に関与する多くの遺伝子の発現を誘導するので、高脂血症改善薬のターゲットになっており、フェノフィブラート(Fenofibrate)、ベザフィブラート(Bezafibrate)、クロフィブラート(Clofibrate)などのいわゆるフィブラート系の薬剤が高脂血症治療薬として使用されています。
ベザフィブラートはPPARαだけでなくPPARγやPPARδの活性化作用もありPPAPのpan-agonistと呼ばれています。
また、PPARαは炎症を促進するNF-κB(nuclear factor-kappa B)の活性を抑制し、TNF-α(tumor necrosis factor-α )などの炎症性サイトカインの発現を抑制する作用も報告されています。
PPARγは脂肪組織でインスリン感受性を高めるアディポネクチン遺伝子の発現を促進し、インスリン抵抗性を高める炎症性サイトカインのTNF-αの産生を抑制する作用があります。これらのインスリン抵抗性を改善する作用によって糖尿病を治療する効果を発揮します。薬としてはピオグリタゾンが使用されています。
PPARδは多くの組織で発現し、リノール酸やリノレン酸やアラキドン酸などの多価不飽和脂肪酸やアラキドン酸由来物質などが内因性のリガンドとなっています。インスリン抵抗性の改善や脂肪酸のβ酸化の亢進などの作用があります。PPARδに選択性の高い医薬品はありませんが(開発中の薬はいくつかある)、PPARのpan-agonist(一連の受容体を活性化する特異性の低い刺激剤)であるベザフィブラートはPPARδの活性作用があります。
以上のようにPPARは物質代謝やエネルギー産生に関与しており、摂食後はPPAR-γが作用して効率的に体内に脂肪を蓄え、空腹時はPPAR-αの作用により脂肪がエネルギーに変換され消費されます。これらのPPARの作用に異常が起こると糖尿病や高脂血症や肥満を引き起こします。
一般的に、糖尿病はPPAR-γ、高脂血症はPPARα、肥満はPPARδが深く関与しています。
また、糖尿病や高脂血症や動脈硬化を予防する効果が指摘されている大豆(イソフラボン)や赤ワイン(レスベラトロール)や青魚(ドコサヘキサエン酸やエイコサペンタエン酸)の作用の一部はPPARへの効果が関与している可能性も指摘されています。
PPARはレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成して遺伝子のペルオキシソーム増殖因子応答配列に結合します。リガンドが結合していない状態ではPPAR-RXRヘテロダイマーに核内受容体コリプレッサーが結合して転写活性が抑制されています。コリプレッサー(co-repressor)というのは、核内受容体に結合してその転写活性を抑制する因子です。
PPARとRXRにそれぞれのリガンドが結合するとPPAR-RXRヘテロダイマーからコリプレッサーが分離し、転写活性を促進するコアクチベーター(co-activator)が結合します。コアクチベーターはヒストンアセチル化を促進する作用があり、DNAとヒストンの結合を緩めて、他の転写因子やRNAポリメラーゼが標的遺伝子のプロモーター領域に結合しやすくなり、転写が開始されます。このようにPPAR の活性化から 遺伝子発現まで様々な因子が複雑に関与しています。

図:ペルオキシソーム増殖因子活性化受容体(PPARP)とレチノイドX受容体(RXR)はヘテロダイマー(PPAR-RXR)を形成して、コリプレッサーが結合してDNA結合は阻止されている。それぞれの受容体にリガンドが結合すると受容体の構造に変化が生じてコリプレッサーが離れ、コアクチベーターが結合して、標的遺伝子のDNAのペルオキシソーム増殖因子応答配列(AGGTCAの塩基配列が1塩基をはさんで同方向に並んだAGGTCA-n-AGGTCA のダイレクトリピート構造)に結合して転写を亢進する。
【PPARαを活性化すると低酸素誘導因子-1の活性を抑制する】
PPARの抗がん作用については、いずれのサブタイプも有効性が報告されていますが、主にPPARαとPPARγでの検討が多いようです。これはαとγのそれぞれに特異性の高い外因性リガンド(=医薬品)が存在するためかもしれませんが、特異性の低いベザフィブラートを使ったpan-agonistの抗腫瘍効果を検討した研究もあります。PPARδの活性化も抗がん作用が報告されています。
PPARを活性化する薬や食品成分は脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt/mTORC1)を抑制する作用や、抗炎症作用、血管新生阻害作用、分化誘導作用などの抗腫瘍効果も報告されています。
がん細胞のワールブルグ効果の根本的な原因である低酸素誘導因子-1(HIF-1)の活性をPPARの活性化によって抑制できることが報告されています。以下のような論文があります。
Activation of peroxisome proliferator-activated receptor α (PPARα) suppresses hypoxia-inducible factor-1α (HIF-1α) signaling in cancer cells.(ペルオキシソーム増殖因子活性化受容体αの活性化はがん細胞における低酸素誘導因子-1αシグナルを抑制する)J Biol Chem. 287(42): 35161-9, 2012年
【要旨】
ペルオキシソーム増殖因子活性化受容体α(PPARα)の活性化はがん細胞の増殖と血管新生を阻害することが報告されているが、その作用機序に関しては十分に解明されていない。
この研究では、ヒト乳がん細胞(MCT-7)とヒト卵巣がん細胞(A2780)を使って、低酸素誘導因子-1α(HIF-1α)シグナル伝達系に対するPPARα活性化の作用について検討した。
酸素濃度が1%の状態でがん細胞を16時間培養するとHIF-1αの発現量が著明に増加する。低酸素で培養する前にPPARαのアゴニスト(受容体を活性する物質)で処理すると、低酸素で誘導されるHIF-1αの発現と活性が抑制され、PPARαのアンタゴニスト(受容体の作用を阻害する物質)を投与するとPPARαのアゴニストによるHIF-1αシグナルの抑制作用が減弱した。このような作用はPPARγでは認めなかった。
PPARαの活性化は、低酸素で誘導されるHIF-1αタンパク質の量を減少させたが、変異したHIF-1αタンパク質の発現量には変化はなかった。このことは、PPARαの活性化はHIF-1αの分解を促進することを示している。この作用機序は、低酸素条件で誘導されるHIF-1α発現に対するPPARα活性化による抑制が、タンパク分解酵素を投与すると阻止されるという、タンパク分解酵素阻害剤を用いた実験で確かめられた。
共免疫沈降法(co-immunoprecipitation)を用いた実験で、HIF-1αのユビキチン-プロテアソーム経路での分解を促進するタンパク質であるvon Hippel-Lindauタンパク質とHIF-1αとの結合をPPARαの活性化によって促進されることを示した。
PPARαの活性化によってHIF-1αシグナル伝達経路が抑制されると、がん細胞からの血管内皮細胞増殖因子(VEGF)の分泌は著明に減少し、腫瘍血管の新生は阻害された。
以上の結果から、PPARαを活性化するとがん細胞における低酸素で誘導されるHIF-1αシグナル系が抑制されることが確かめられた。この結果は、PPARαのアゴニストの抗がん作用の新しい作用機序を提示している。
この論文は、低酸素誘導因子-1(HIF-1)の活性化のメカニズムを知らないと理解できないかもしれません。HIF-1の分解と活性化について簡単に解説します。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれる2種類のタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。(HIFのαサブユニットにはHIF-1α, -2α and -3α、βサブユニットにはHIF-1β, -2β and -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用)
すなわち、HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリルヒドロキシラーゼ(prolyl hydroxylase)により水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。
VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリルヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリルヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど、 多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
この論文では、PPARαの活性化がHIF-1αの分解を促進するという作用機序を示しています。分解を促進する機序として、HIF-1αとVHLとの結合を促進すると考察していますが、HIF-1αとVHLとの結合促進はプロリル・ヒドロキシラーゼの活性化によるものかもしれません。いずれにしても、PPARαの活性化はHIF-1αの分解を促進して低酸素で誘導されるHIF-1の活性を抑制するということです。
がん細胞の場合は、低酸素状態でなくてもHIF-1が恒常的に活性化しています。また、がん細胞ではVHLタンパク質が変異している場合もあり、この場合はPPARαの効果は期待できないかもしれません。
PPARγではHIF-1の活性を抑制する効果は認めなかったということです。
HIF-1の活性阻害を目的とする場合にはPPARαのリガンドであるフィブラート系薬剤の使用は有効かもしれません。PPARαの活性化が肺がん治療に有効であるという論文が出ています。
【PPARαの活性化は肺がん細胞の増殖を抑制する】
以下のような報告があります。
PPARα activation can help prevent and treat non-small cell lung cancer.(ペルオキシソーム増殖因子活性化受容体αの活性化は非小細胞性肺がんの予防と治療において有用である。)Cancer Res. 2014 Jan 15; 74(2): 621–631.
【要旨】
非小細胞肺がんに対する抗がん剤治療は有効性が低くかつ副作用も強いので、外科的切除の対象にならない非小細胞性肺がんの予後は極めて悪い。したがって、肺がんに対する有効性と安全性の高い治療法の開発が求められている。
この研究では、シトクロム P-450依存性アラキドン酸エポキシゲナーゼ(cytochrome P450 arachidonic acid epoxygenases)によって産生される血管新生促進作用のあるエポキシエイコサトリエン酸(epoxyeicosatrienoic acids)が、非小細胞性肺がんの増殖や進展を抑制する新規で安全な治療法のターゲットになることを示した。
K-rasを過剰発現させたトランスジェニックマウスの実験モデルとヒト非小細胞性肺がんの同所移植腫瘍の実験モデルにおいて、ペルオキシソーム増殖因子活性化受容体α(PPARα)のリガンドであるベザフィブラート(Bezafibrate)とWyeth-14,643によってPPARαを活性化すると、シトクロム P-450依存性アラキドン酸エポキシゲナーゼ(Cyp2c44)の発現量は減少した。これら2つの薬剤の投与は、原発性と転移性の両方の実験モデルにおいて、非小細胞性肺がん細胞の増殖と血管新生、血管内皮細胞のCyp2c44の発現、エポキシエイコサトリエン酸の血中濃度が減少することが認められた。
PPARαのリガンドの抗腫瘍効果は投与の時期とは関係なく、投与が原発腫瘍の発生の前からスタートした場合と発生後に投与をスタートした場合のどちらでも認められた。さらにPPARαリガンドの投与を中止したあとも継続し、PPARαリガンドの効果は長く続くことが示唆された。
これらの結果は、シトクロム P-450依存性アラキドン酸エポキシゲナーゼの発現や活性を抑制する治療法が、非小細胞性肺がんの治療に有効で安全性の高い新規の治療法となる可能性を示唆している。
さらに、ベザフィブラートは高脂血症の治療薬として臨床的に使用され比較的安全性の高いことが知られているので、我々の研究結果は、ヒトの肺がん治療におけるPPARαリガンドの有効性を検討する臨床試験を実施する必要性を示している。
アラキドン酸は代謝されて様々な生理活性物質を産生し、生理機能の調節に重要な働きを担っています。
アラキドン酸の代謝にはシクロオキシゲナーゼ(cyclooxygenase)とリポキシゲナーゼ(lipoxygenase)とチトクローム450依存性エポキシゲナーゼ(cytochrome P-450 dependent epoxygenase)の3系統が主な代謝経路になっています。それぞれの代謝産物ががん細胞の増殖や血管新生や転移などに関与しています。
例えば、シクロオキシゲナーゼで産生されるプロスタグランジンE2ががん細胞の増殖や転移や血管新生を促進するので、シクロオキシゲナーゼの阻害剤である非ステロイド性抗炎症剤(アスピリンやセレコックスなど)には抗腫瘍作用があります。
この論文では、シトクロームP-450依存性エポキシゲナーゼによって産生されるエポキシエイコサトリエン酸の産生を抑制すると、非小細胞性肺がんの増殖や転移や血管新生の抑制に有効であることを報告しています。そして、シトクロームP-450依存性エポキシゲナーゼの発現が、PPARαの活性化によって抑制されることを示しています。したがって、PPARαを活性化するベザフィブラートが肺がんの治療に有効である可能性を示唆しています。
エポキシエイコサトリエン酸は、血管拡張、血管新生、動脈硬化抑制、血圧低下、抗炎症などの作用や、心臓の虚血再還流障害を抑制する効果などが報告され、循環器領域では有益なアラキドン酸代謝産物として認識されています。
しかし、がん治療の領域では、エポキシエイコサトリエン酸はがんの進行を促進する作用が明らかになっており、エポキシエイコサトリエン酸の産生を抑制することががん治療に役立つと考えられています。
アラキドン酸からエポキシゲナーゼによって産生されるエポキシエイコサトリエン酸ががんを促進するのに対して、ドコサヘキサエン酸(DHA)からエポキシゲナーゼによって産生されるエポキシドコサペンタエン酸(epoxydocosapentaenoic acids)はがん細胞の増殖を抑制する作用があることが報告されています。
Epoxy metabolites of docosahexaenoic acid (DHA) inhibit angiogenesis, tumor growth, and metastasis.(ドコサヘキサエン酸のエポキシ代謝産物は血管新生と腫瘍増大と転移を阻害する)Proc Natl Acad Sci U S A. 2013 Apr 16;110(16):6530-5.
したがって、魚の脂に多く含まれるDHAの抗腫瘍効果はエポキシゲナーゼの代謝産物でも証明されており、ω3系不飽和脂肪酸を多く摂取することががん治療に有用であることは確かです。(351話参照)
ただし、PPARαを活性化するベザフィブラートはシトクロームP-450依存性エポキシゲナーゼの発現量を抑制することによってアラキドン酸のエポキシゲナーゼ代謝産物の産生を抑えるという機序であれば、ベザフィブラートはDHAのエポキシゲナーゼ代謝産物の産生も抑えることになります。
したがって、PPARαを活性化するためにベザフィブラートを服用するとDHAの抗腫瘍効果は減弱するかもしれません。(アラキドン酸摂取を減らし、DHA摂取を増やし、ベザフィブラートを服用することは、抗がん作用を高める上で有効であるとは思います)
【複数の核内受容体を活性化すると相乗効果が得られる】
PPARαもPPARγもそれぞれ抗がん作用があることが報告されています。したがって、PPARαに特異性の高いフェノフィブラートやPPARγに特異性の高いピオグリタゾンのように、それぞれの特異的なリガンドよりも、PPARαとPPARγの両方を活性化するベザフィブラートががん治療には有用かもしれません。
PPARの標的遺伝子の発現の亢進するためには、レチノイドX受容体(RXR)の活性化も必要です。PPARのリガンドとRXRのリガンドのレチノイドの併用が相乗効果を示すことは、その作用メカニズムから理論的には当たり前ですが、PPARのリガンド(αもγも)とレチノイドの相乗効果を示す実験結果は多数報告されています。
RXRの活性化には、オールトランスレチノイン酸(ATRA)と、にきびの治療薬のイソトレチノイン(13cis-レチノイン酸)が利用できます。イソトレチノインは体内でオールトランスレチノイン酸(ATRA)に変換され、ATRAは9cis-レチノイン酸に変化してRXRを活性化します。
さらに、ビタミンD受容体がRXRとヘテロダイマーを形成して細胞の分化や増殖の制御に作用することが明らかになっています。
がん研究の分野では、レチノイドやビタミンAを使ったがん細胞の分化誘導の研究は30年以上前から注目されています。しかし、培養がん細胞や動物実験では分化誘導作用が認められても、人間の腫瘍では有効性は証明できませんでした。
その当時は遺伝子のエピジェネシス(ヒストンアセチル化による転写活性化など)や核内受容体の存在など知られていませんでした。
近年の研究によって核内受容体のリガンドによる活性化のメカニズムが明らかになり、その知識を十分に理解すれば、がん細胞の分化誘導療法も有効性と実用性を高めることができます。
つまり、ヒストンのアセチル化に、レチノイド、ビタミンD、PPARのリガンド(フィブラート製剤など)の併用は効果が期待できるかもしれません。
PPARのリガンドとしてDHA(ドコサヘキサンエン酸)やEPA(エイコサペンタエン酸)やその他の脂肪酸やその代謝産物が関わっています。ケトン体のβヒドロキシ酪酸がヒストンアセチル化を促進することが報告されています(322話参照)。
脂肪摂取量を増やすケトン食は、ヒストンアセチル化促進とPPAR活性の亢進という観点からの抗がん作用の可能性もあるようです。
PPARを活性化するフィブラートも、RXRを活性化するレチノイドも、ビタミンDも極めて安価で、副作用も少ないので、このような分化誘導療法は試してみる価値はあると思います。
| « 741)断酒薬ジ... | 743)オールト... » |



