がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
872)抗がん剤治療はなぜ失敗するのか(その5): 競合解放によって増殖が促進する

図:がん組織に抗がん剤耐性のがん細胞集団が存在しているとき、抗がん剤感受性のがん細胞は抗がん剤耐性のがん細胞と競合することによって抗がん剤耐性がん細胞の増殖を抑える働きをしている。高用量の抗がん剤投与によって抗がん剤感受性がん細胞が消滅すると、競合状態から解放され、抗がん剤耐性のがん細胞の増殖をむしろ促進する結果となる。
872)抗がん剤治療はなぜ失敗するのか(その5): 競合解放によって増殖が促進する
【がん組織内では遺伝子変異の状態において不均一なクローンが競合している】
抗がん剤治療後に、がん細胞の増殖速度が、初めのがん細胞よりも速くなることがあります。その理由として競合開放という現象が関与していることがあります。
がん組織内の個々のがん細胞は、遺伝子変異のパターンや増殖速度や薬剤耐性の程度などにおいて極めて不均一なクローンが混在しています。
このような不均一な細胞集団(クローン)において、生存において有利な性質をもった細胞が生き残ってクローンを増やして行くというダーウィンの進化論と同様な自然選択(natural selection)が起こっています。
クローンというのは、細胞分裂を繰り返すことによって生ずる同一の遺伝子構成を持つ細胞群です。
抗がん剤治療を行うと、抗がん剤に感受性が高い細胞群(クローン)は死滅していき、抗がん剤に抵抗性を持った「死ににくい」細胞クローンが生き残るという選択圧が加わります。
さらに、環境の変化に適応するように進化する「進化的適応(Evolutionary adaptation)」と同様なことが起こります。つまり、新たな遺伝子変異の発生によって抗がん剤に耐性の性質を新たに獲得するようになり、そのような形質を獲得したがん細胞が選択されて増えていきます。
自然環境において個々の個体間で生存競争が起こっているのと同様に、がん組織内でも、がん細胞間で生存競争が起こっています。
生存競争というのは、生物の個体同士が生息域や食糧などを争うことです。
例えば、同じ地域に生息し、同じ餌を求める2種類の生物が存在する場合、有限な餌に関してこの2つの生物は競合(競争)関係にあります。一方が多くの餌を食べれば、他方は食べるものが少なくなって個体数が減少します。
このように、自然界ではスペース(Space:場所)やリソース(Resorce:資源)に関して多くの生物が競合関係にあって、この競合関係が個体数に影響してきます。
片方が強ければ、他方を攻撃して追い出す(滅ぼす)例もありますが、大きくて強いものが生存競争に勝てるというわけではありません。大きさや強さを維持するためには寿命を犠牲にし、エネルギーを費やすので、繁殖にはマイナスになるので、個体数の増加という点で不利に作用する場合もあります。
このような競合状態で、一方の生物種が絶滅(消滅)すると、残った生物種はスペースとリソースを独り占めできるので、個体数を最大に増やすことができます。これを生態学では競合解放(Competitive Release)と言っています。(下図)

図:スペース(場所)やリソース(資源)には限りがある。したがって、同じスペースとリソースを利用する生物種のAとBは競合関係にあり、生存競争をしている。Bが消滅するとAはスペースとリソースを独り占めできるので、最大限に個体数を増やすことができる。これを生態学では競合解放(Competitive Release)と呼んでいる。
【競合解放(competitive release)によって抗がん剤耐性細胞の最大限の増殖が起こる】
最大耐用量の抗がん剤を投与すると、その抗がん剤に感受性のあるがん細胞は死滅し、抗がん剤に抵抗性のあるがん細胞は生き残ります。そして、抗がん剤耐性のがん細胞が増えていきます。
抗がん剤感受性のがん細胞をある程度生き残らせておく方が、がん組織の増殖を抑える目的では有効という報告があります。
その理由は、抗がん耐性のがん細胞の方が一般的に増殖が遅いからです。抗がん剤抵抗性になるにはコストがかかり(エネルギー産生や物質合成が必要)、そのため増殖速度は遅くなると考えられています。
前述の競合解放(competitive release)という観点から、最大耐用量の抗がん剤治療のデメリットを考察した意見があります。以下のような報告があります。
A Strategy to Delay the Development of Cisplatin Resistance by Maintaining a Certain Amount of Cisplatin-Sensitive Cells(ある程度の量のシスプラチン感受性細胞を維持することによってシスプラチン耐性細胞の出現を遅らせる対策)Sci Rep. 2017; 7: 432.
【要旨】
多くの進行がんの治療に用いられているシスプラチンは、初めは良く効いて腫瘍の縮小を認めるが、シスプラチン耐性のがん細胞が出現することが、シスプラチン治療が失敗する主要な原因となっている。そのような問題に対処するため、我々は、シスプラチンに感受性のある細胞株と耐性の細胞株の間の適応能力の違いを検討した。
シスプラチン抵抗性のがん細胞の増殖速度はシスプラチン感受性細胞より顕著に遅いことを発見した。その理由としてシスプラチン抵抗性細胞では活性酸素種の産生が亢進しており、シスプラチン抵抗性のメカニズムが細胞増殖を抑制していることが示された。
さらに、シスプラチンに感受性の細胞と抵抗性の細胞を一緒に培養すると、シスプラチン抵抗性のがん細胞は治療に適応することができずに、増殖が抑制された。
我々は、2つの競合するサブクローンからなる腫瘍の相対的な増殖を記述するための生体内(in vivo)実験に基づいた数学的モデルを提案する。
我々のモデルによって、腫瘍の成長を制御するために、薬物投与間隔を変えた定量的戦略が提案された。
腫瘍内の競合を利用することによって、適切な投与間隔でのシスプラチン投与は、シスプラチン耐性細胞の出現を著しく遅延させ、全生存期間を延ばすことができた。
継続的な治療で腫瘍の根絶を目指すより、ある一定の量のシスプラチン感受性細胞を維持する治療法の方が、腫瘍治療に有効である可能性がある。
白金製剤のシスプラチンは多くのがんの治療に使われています。
最初は良く効いてがんが縮小することもありますが、抗がん剤治療を継続していると次第にシスプラチンに抵抗性のがん細胞が増えていきます。
抗がん剤を始める前から、そのがん組織にはシスプラチンに感受性の細胞と抵抗性の細胞が存在し、シスプラチンの投与によって、シスプラチン感受性のがん細胞が死滅し、シスプラチン抵抗性のがん細胞が生き残り、次第にシスプラチン抵抗性のがん細胞が増えるために、次第に抗がん剤が効かなくなります。(下図参照)

図:抗がん剤治療前のがん組織のがん細胞は薬剤耐性の程度において不均一で、薬剤耐性の低いがん細胞や高いがん細胞が混在している(①)。抗がん剤のシスプラチン投与を行うと、シスプラチンに感受性のがん細胞は死滅するが、耐性のがん細胞は生き残る(②)。生き残ったがん細胞は増殖してがんは再発する(③)。さらにシスプラチンを投与しても、がん細胞は死滅せずにさらにシスプラチン耐性細胞の比率は増し、がん組織は増大する(④)。
シスプラチン投与がシスプラチン耐性がん細胞を増やすというのはダーウィンの進化論と同じです。シスプラチンで死滅する細胞は自然淘汰されて子孫を残さずに滅び、シスプラチンに抵抗性のがん細胞だけが選択的に生き残ります。抗がん剤ががん細胞の進化の選択圧として働きます。
抗がん剤治療がはじまれば、がん細胞間で生存競争が開始されます。
一般に、抗がん剤抵抗性のがん細胞は増殖が遅いことが知られています。抗がん剤に抵抗性の機序を働かせるのに余分なエネルギーと物質合成が必要だからです。
例えば、抗酸化力を高めることによって抗がん剤抵抗性になりますが、この抗酸化システムを高めるには余分なエネルギー(ATP)消費と物質合成(グルタチオンや抗酸化酵素などの産生)が必要です。
この論文では、シスプラチンの投与量と投与間隔を調整して、シスプラチン感受性細胞と抵抗性細胞を拮抗するように残すと、がん組織の増大が抑制されました。しかし、シスプラチン感受性細胞を消滅させると、腫瘍の増大は促進されました。
シスプラチン抵抗性のがん細胞は細胞内の活性酸素種の産生が高いことが示されています。
薬剤耐性になると酸化ストレスが亢進し、そのために増殖速度が遅くなります。抗酸化作用のあるグルタチオンを投与すると、薬剤耐性がん細胞の増殖が早くなることが報告されています。グルタチオンによって酸化ストレスが軽減し細胞の負担が少なくなるので、増殖を速くすることができるのです。
したがって、抗がん剤治療中は、抗酸化剤の併用は間違いであり、むしろがん細胞における酸化ストレスを高めることを積極的に行うのが良いと言えます。
つまり、ケトン食や、解糖系を阻害する2-デオキシ-D-グルコースや、ミトコンドリアを活性化するジクロロ酢酸ナトリウム、酸化ストレスを高めるメトホルミンやジスルフィラムやアルテスネイトや半枝蓮などは、薬剤耐性のがん細胞の出現を抑制し、がん細胞を死滅させることができます。
最大耐用量の抗がん剤を投与する方法は、進化論的な観点からは、患者の死に至る薬剤耐性の出現と成長を促進するため、恐らくは有害であるという意見が増えています。
食糧や場所(スペース)を競合する2つの集団が存在する場合、ある一方の集団を除去すると、残った集団は食糧とスペースを独り占めできるようになります。これは生態学において「競合解放(competitive release)」として知られている現象です。
がん組織においても、「抗がん剤感受性細胞」を除去することによって、競合していた抗がん剤耐性細胞の最大限の増殖を可能にします。
最大耐用量の抗がん剤治療は、生態学における「競合解放(competitive release)」と同様のメカニズムによって、抗がん剤耐性のがん細胞の増殖を促進することになります。
抗がん剤感受性がん細胞の全滅(消滅)は、それ自体が抗がん剤抵抗性がん細胞の増殖を促進するわけではありません。しかしながら、資源が限られた環境で増殖する場合、抗がん剤感受性がん細胞による抑制から抗がん剤耐性がん細胞を解放することになるのです。

図:がん組織内には、薬剤耐性の程度において不均一なクローンが混在している(①)。最大耐用量の抗がん剤投与を行うと、抗がん剤感受性のがん細胞は死滅するが、抗がん剤耐性のがん細胞は生き残る(②)。生き残ったがん細胞は増殖してがんは再発する(③)。同じ抗がん剤を投与しても、がん細胞は死滅せずにさらに薬剤耐性細胞の比率は増し、がん組織は増大する(④)。最大耐用量の抗がん剤治療で抗がん剤感受性細胞が消滅すると、抗がん剤耐性細胞は競合相手がいなくなるので、スペース(場所)とリソース(栄養資源)を独り占めできるので、抗がん剤耐性がん細胞の増殖が促進される。これは生態学における競合解放(Competitive Release)と同様のメカニズムである(⑤)。図中で青い細胞は抗がん剤感受性がん細胞で、赤い細胞は抗がん剤耐性がん細胞を示している。最大耐用量の抗がん剤投与は「薬剤耐性がん細胞を増やす強い選択圧」となり、さらに「競合解放」のメカニズムも加わって、抗がん剤耐性がん細胞を増やす結果になる。
【抗がん剤感受性のがん細胞を残す方ががんの増大を抑えられる】
治療を受けていない腫瘍組織の中に抗がん剤に抵抗性(耐性)の性質をもったがん細胞が存在するとき、抗がん剤抵抗性のがん細胞集団は抗がん剤感受性のがん細胞集団よりも少ない数で存在することが示されています。
薬剤耐性の性質を獲得したがん細胞集団が小さいまま維持される理由は、薬剤耐性の細胞は、薬物を代謝する酵素や耐性に関与する細胞内分子を増やす必要があるため、耐性の性質を維持するためのコスト(エネルギーと物質合成)が余分に必要になり、その分、自身を増殖させるためのエネルギーが不足しているためと考えられています。
抗酸化力を高めることによって抗がん剤抵抗性になりますが、この抗酸化システムを高めるには余分なエネルギー(ATP)消費と物質(グルタチオンや抗酸化酵素など)の合成が必要です。
あるいは、がん組織における虚血や低酸素といったがん細胞の増殖を阻害する微小環境に適応するためのエネルギーも不足していて、虚血や低酸素のがん組織の中での増殖が抑えられる可能性もあります。
このように、がん組織の中での環境適応においては、抗がん剤耐性のがん細胞よりも抗がん剤感受性のがん細胞の方が、がん組織の微小環境により適応しており、増殖しやすい状況にあり、抗がん剤耐性のがん細胞の数は少ない状態が維持されます。
抗がん剤治療前に抗がん剤耐性のがん細胞が存在した場合、大量の抗がん剤を投与して抗がん剤感受性のがん細胞が多く死滅すると、抗がん剤耐性のがん細胞の増殖を阻止していた抑制力がなくなり、耐性のあるがん細胞が一気に増殖し出すことになります。つまり、生態学でいう競合解放(competitive release)による増殖促進です。
そこで、抗がん剤の投与量や投与時期を調整して、抗がん剤感受性のあるがん細胞をある程度残して、そのがん細胞集団に抗がん剤耐性(がん組織の微小環境においては適応力が弱い)のがん細胞の増殖を抑えさせ、がん組織を安定した状態に維持する治療法(Adaptive Therapy)が提唱されています。
「Adaptive Therapy」は、日本語に訳すと「適応治療」という意味です。がん組織の状況に応じて抗がん剤の投与量や投与時期を変化(適応)させる治療法です。
米国フロリダ州にあるモフィットがんセンター(Moffitt Cancer Center)のRobert A. Gatenby博士らが提唱しています。Gatenby博士は数理腫瘍学(mathematical oncology) の専門家で、がんを動的に進化していくシステムとして捉えて考察しています。
このAdaptive Therapyの方が、一度に大量の抗がん剤を投与する場合よりも、生存期間を延ばすことが動物実験やコンピューターシミュレーションで確認されています。
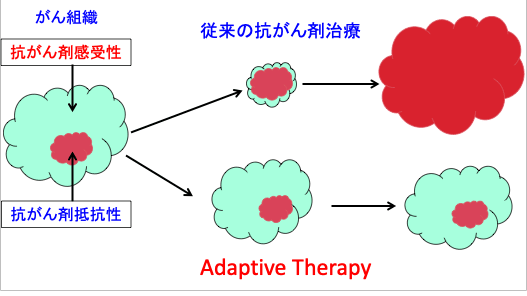
図:がん組織では、抗がん剤感受性のがん細胞と耐性のがん細胞集団が競合関係にある。抗がん剤感受性がん細胞集団は耐性のがん細胞集団の増殖を抑制している。最大限にがん細胞を死滅させる従来の抗がん剤治療では、抗がん剤感受性細胞が消滅して競合相手がいなくなるので、抗がん剤耐性のがん細胞の増殖をむしろ促進する結果となる。抗がん剤感受性のがん細胞を十分生き残らせるように抗がん剤の量と投与時期を調整するAdaptive Therapy(適応治療)では、がん組織が安定化してより延命効果が得られる可能性がある。
Adaptive Therapyに関する最初の論文の要約を以下の紹介します。
Adaptive Therapy(適応治療) [Cancer Res 2009;69(11):4894-903]
【要旨】
全身に広がったがんを治療するために、数多くの有効な治療法が行われている。しかしながら多くの場合、腫瘍組織の縮小は一時的であり、いずれ抗がん剤に抵抗性のあるがん細胞が出現して、治療が困難になることが多い。
抗がん剤治療に抵抗性のあるがん細胞集団が出現する理由は、がん組織に存在するがん細胞の性質や微小環境にはすでに多様性(heterogeneity)があり、さらに抗がん剤の攻撃にがん細胞が適応するためにがん細胞の性質が変化するためである。
がん組織は高度にダイナミック(動的)なシステムにもかかわらず、抗がん剤治療に使う薬の投与量は固定した計算式にしたがって決められている。
この報告では、腫瘍組織の微小環境やがん細胞の性質(形質)や、がん治療に適応して起こる変化に対応しながら、治療薬の投与量や投与時期を変えていく「適応させる治療法(adaptive therapeutic approach)」の有効性について検討した。
そこで我々は、がん組織の中の性質の異なったがん細胞集団のバランスを安定化させるように、抗がん剤の投与量や投与時期を絶えず変更する(適応させる)治療法を代替案として提唱する。
この適応治療(adaptive therapy)の目標は、抗がん剤感受性のあるがん細胞をある程度残して、そのがん細胞集団に抗がん剤耐性(がん組織の微小環境においては適応力が弱い)のがん細胞の増殖を抑えさせ、がん組織を安定した状態に維持することである。
コンピューターを使ったシュミレーションでは、この治療法の方が、一度に大量の抗がん剤を投与する場合よりも、生存期間を延ばすことが示された。
この方法の有効性は動物実験によって確認された。
従来のがん治療の考え方は、がんを消滅あるいは縮小させるという発想しかありませんでした。小さくしないと延命はしないということが大原則になっていました。しかし、この考え方に抗がん剤治療の根本的な間違いがあるという指摘があります。がんの縮小は一時的であることが多く、必ずしも延命につながらないからです。
最近は、がんの縮小を目指すのではなく、がんの増殖をくい止め、がんと共存しながら延命をはかるという戦略が提唱されています。
抗がん剤治療を行っていると次第に薬剤耐性を持ったがん細胞が増えて、いずれはどの抗がん剤にも効かないがん細胞集団になっていくということは、抗がん剤治療の宿命になっています。
薬剤耐性のメカニズムを研究し、薬剤耐性を克服する方法の開発が、抗がん剤治療の研究の重要なテーマとなっていますが、薬剤耐性を克服する有効な方法はまだありません。
現在の抗がん剤治療の主流の考え方は、大量の抗がん剤を投与して、がん細胞をできるだけ死滅させることです。この方法論によって、白血病や精巣腫瘍のような一部の悪性腫瘍は根治できます。
しかし、この方法は全てのがんに有効ではありません。
多くの固形がんでは、大量の抗がん剤を投与しても、腫瘍の縮小は一時的であり、抵抗性をもったがん細胞がかえって急速に増えてしまい、生存期間を延ばす効果につながらないことが指摘されています。副作用によって治療の継続ができない場合も多くあります。
そこで、低用量の抗がん剤を投与しながら、がんを大きくしないという「休眠療法」が提唱され、一部の医師によって実践されています。この低用量の抗がん剤投与の有効性に対しては、がん専門医の多くは懐疑的です。
しかし、数学的解析とコンピューターシミュレーションによって、「大量の抗がん剤を投与して一時的ながん組織の縮小を目指すより、腫瘍の大きさを一定に保つことを目標に抗がん剤を投与した方がより生存期間が長い」という可能性が報告されているのです。
【がんとの共存を目指すがん治療】
通常、がん細胞はファーストラインの抗がん剤治療に反応して大量にがん細胞が死滅し、腫瘍組織は一時的に縮小します。腫瘍縮小は良い結果ですが、同時にこの細胞死誘導作用は、既存の薬剤耐性のがん細胞を増やす選択圧となります。
薬剤感受性の細胞が死滅すると、それまで競合していた細胞集団がいなくなるので、薬剤耐性細胞の増殖は有利になり、促進されます。
高用量の抗がん剤を投与すると、治療でコントロールできるがん細胞は全て死滅し、治療でコントロールできないがん細胞のみになるのです。
「縮小なくして延命なし」は最初の数ヶ月間しか当てはまらないし、がんを縮小させることによって延命が期待できるのは、ファーストラインの抗がん剤までです。
薬剤耐性のがん細胞が増えると、もう抗がん剤治療のメリットは無くなります。
抗がん剤感受性のがん細胞集団を一定量維持して、抗がん剤耐性のがん細胞の増殖を抑えて「がん組織自体を安定化する」ことを目標にした抗がん剤の投与法の方が、「がん細胞を徹底的に攻撃する治療」より生存期間を延ばすことができるというのが「Adaptive Therapy」の根拠です。
細菌に対する抗生物質や、雑草に対する除草剤(農薬)の関係と同様に、新しい薬ができると必ず耐性の生物が出てきます。
Adaptive Therapy を提唱しているGatenby博士は、あるインタビューの中で、Adaptive therapyの方法論を殺虫剤の散布法に例えて次のように説明しています。
『例えば害虫に対応するには、殺虫剤に耐性のある害虫が支配的勢力となるのを防ぐために、農地の4分の3に殺虫剤を撒き、残りの4分の1は放っておくという方法をとります。殺虫剤散布の後も、この区画では殺虫剤に耐性のない害虫が生き残り、やがて農地全体に広がっていくからです。
殺虫剤を農地全体に撒いてしまうのと同じようなことを、われわれは現在、がんに対してしています。害虫を1度に駆除したいのは誰しも同じですが、それができないのならば別の戦略を試すべきです。これに代わる方法は、害虫が作物に被害を及ぼさない程度に数を減らす努力をしつつも、害虫が農地に居座り続ける事実を受け入れることです。これこそがまさに、私ががんについて言っていることです。』
Gatenby博士は、がん細胞は動的に進化していく多様性をもった細胞集団であり、それを強い抗がん剤で一気にたたきつぶそうとしても、結果として細胞集団の中に少数いる薬剤耐性のがん細胞が増えやすい環境を提供することになり、腫瘍の中に薬剤が効かないがん細胞の集団が増えて最悪の事態を招く可能性が高いといいます。
全身に広がったがん細胞を根絶させることはできないことは明らかで、強い抗がん剤治療は問題を悪化させているだけだと主張しています。
そして、腫瘍の大きさを一定に保つ(腫瘍の大きさの変動を+/-10%程度に維持する)ことを目標に抗がん剤を投与し、腫瘍を長期の膠着状態に持ち込む方がうまく行く可能性があると主張しています。
抗がん剤治療の大局的な目標は、腫瘍を安定した状態に保つことで、このことを念頭に置いて、薬剤やその投与量、投与の時期を絶えず変更する治療法(Adaptive therapy)を提唱しています。
ただし、Gatenby博士の理論が、ヒトのがんの多くに当てはまるかはまだ断定できません。
Gatenby博士の理論は、抗がん剤に耐性のある細胞は、その耐性メカニズムを維持するためにエネルギーを使っているため、自身を増殖させるためのエネルギーが不足しているために増殖速度が遅いという仮定に基づいています。がん組織における低酸素や虚血に対しても、抗がん剤耐性を維持するがん細胞の方が不利だと考えています。
したがって、抗がん剤感受性の「普通のがん細胞」を減らしすぎないことが、抗がん剤耐性のがん細胞を増やさないコツだと主張しています。
しかし、数年間かかって大きく成長する過程では、低酸素や虚血に対して強いがん細胞が生き残り、そのような抵抗性の高いがん細胞は、抗がん剤に対しても死ににくい場合が多いという意見もあります。これもダーウィンの進化論的な考えと一致します。
薬剤耐性を維持するためにエネルギーを余分に費やすことが、細胞増殖のハンディになっているというのはまだ仮説の段階です。今後、ヒトのがんの抗がん剤治療での臨床試験の結果が出るまでは、まだ結論は出せないかもしれません。
しかし、現行の「最大耐用量を投与する抗がん剤治療」に多くの欠陥があるのは確かです。
【抗がん剤治療における最大耐用量投与と低用量頻回投与】
局所に限局したがん組織の治療においては、手術と放射線治療の有用性について意義を唱える意見は少ないと言えます。
しかし、抗がん剤治療に対しては多くの批判があります。
がんが進行して全身に広がると基本的には手術や放射線治療の適応はなく、抗がん剤治療が主体になりますが、「抗がん剤は効かない」とか「抗がん剤は百害あって一利なし」といった抗がん剤治療の限界や欠点を強調した意見は多くあります。
このような意見に対して、標準治療を行う立場の専門医から、明確な反論は少ないように思います。その理由の一つは、抗がん剤治療の投与法自体にコンセンサスが得られていない点が多いからです。つまり、がん治療の専門医の間でも投与量や投与法で異なる考えがあるのです。がん専門医の間で抗がん剤治療の方法に統一見解が無ければ、論理的な反論は困難です。
例えば、現在の抗がん剤治療の基本は、患者が耐えられる最大の投与量(最大耐用量)を投与します。抗がん剤の投与量を増やせば増やすほど、がん細胞を死滅させる効果は強くなります。しかし一方、抗がん剤の投与量が増えれば増えるほど正常細胞のダメージによる副作用が強くなり、投与量が限界を超えれば患者さん自身が死亡してしまいます。
患者さんが副作用に耐えられる投与量の範囲で最大限の投与量を設定するのが、最も効果が高いという意見が一般的ですが、この最大耐用量の抗がん剤投与の方法には様々なデメリットと欠陥が指摘されています。
正常組織にダメージを与えて強い副作用を引き起こすだけでなく、免疫力を低下させたり、がん組織の血管新生を促進する可能性や、抗がん剤耐性のがん細胞の出現を促進する可能性などが指摘されています。
このようなデメリットを防ぐ抗がん剤治療法として、メトロノミック・ケモテラピー(Metronomic Chemotherapy)という概念が提唱され、その有効性を示すエビデンスが最近多く報告されています。
メトロノミックとは、リズムを刻む「メトロノームの様な」という意味で、メトロノミック・ケモテラピーとは、メトロノームのように規則的に低用量の抗がん剤を頻回に投与していく抗がん剤治療法です。
最大耐用量を投与する抗がん剤治療では、正常組織のダメージを回復させる期間をもうけるために、週一回とか月に一回というように間歇的な投与法になりますが、この休薬期間に腫瘍血管内皮細胞が急速に再生し、腫瘍血管の新生が亢進して、腫瘍の増大が起こります。
一方、メトロノミック・ケモテラピー(休薬期間をもうけない長期間の低用量投与)では、腫瘍の増大に必要な血管新生を抑制でき、がん細胞の増殖を阻止できると考えられています。
さらに、低用量の投与であるため、副作用が少なく、また免疫細胞の働きを抑えている制御性T細胞の働きを阻害するので、免疫力はむしろ高くなるという効果も報告されています。
近年、メトロノミック・ケモテラピーの有効性を示す報告が多くなっており、最大耐用量を投与する現行の抗がん剤治療に代わる「体にやさしい抗がん剤治療法」として注目されつつあります。
メトロノミックケモテラピー(低用量のシクロフォスファミドなど)と、がん細胞の代謝をターゲットにした治療(ワールブルグ効果を是正する2−デオキシグルコース、ジクロロ酢酸ナトリウム)、酸化ストレスを高める方法(メトホルミン、ジスルフィラム、アルテスネイトなど)の併用は試してみる価値はあります。

図:通常の抗がん剤治療は、副作用に耐えられる最大量(最大耐用量)の抗がん剤を投与する。この場合、正常組織へのダメージも強いので副作用も強く現れる。また、正常組織のダメージを回復させる必要があるため、抗がん剤投与の間に休薬期間が必要であるが、この休薬期間に腫瘍血管が急速に再生し、生き残ったがん細胞が増殖する。抗がん剤が効きにくい強いがん細胞が選択的に生き残るので、がん組織は次第に抗がん剤が効きにくい細胞が多くなってくる。(図の上)
一方、休薬期間を設けないで、メトロノームのように定期的に頻回に低用量の抗がん剤を投与するメトロノミック・ケモテラピー(Metronomic Chemotherapy)では、血管新生が抑制されて抗腫瘍効果を発揮する。また、低用量の抗がん剤投与は副作用が少なく、免疫系組織の抑制も回避できる。低用量の抗がん剤投与は腫瘍免疫を抑制する制御性T細胞の活性を阻害する作用があり、その結果、がん細胞を排除する抗腫瘍免疫が増強される。メトロノミック・ケモテラピーだけでは抗腫瘍効果に限界があるが、血管新生阻害やアポトーシス誘導やシクロオキシゲナーゼ-2(COX-2)阻害や免疫増強などの治療法を併用すると、さらに抗腫瘍効果を高め、腫瘍を消滅させることも可能になる。
新刊紹介

抗がん剤治療が失敗する理由を解説し、その原因に対処する補完医療についても解説しています。さらに、抗がん剤治療の止め時を適切に判断し、終末期における「生活の質」と「死の質」の両方を良くすることの大切さを解説しました。死を早める可能性もある「無駄な抗がん剤治療」を避けるためには、医師の言いなりにならずに、患者自身が正しい知識を得て、もっと考える必要があると思います。
| « 871)抗がん剤... | 873)終末期の... » |



