がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
498)がんと老化とNLRP3インフラマソーム

図:(1)細胞のダメージに伴って漏出したATPや、コレステロール結晶、尿酸結晶、グルコース、βアミロイドなどのダメージ関連分子パターン(damage-associated molecular patterns: DAMPs)は、トル様受容体を介してNF-κBを活性化する。(2)活性化したNF-κBはNLRP3たんぱく質やIL-1βとIL-18の前駆体(pro-IL-1βとpro-IL-18)の遺伝子転写を誘導する。(3)DAMPsの刺激を受けると不活性型NLRP3は重合化しNLRP3インフラマソームを形成する。(4)これによってprocaspase-1は自己切断されて活性型カスパーゼ-1(caspase-1)を形成し、この活性化したカスパーゼー1はIL-1β前駆体のpro-IL-1β とIL-18前駆体の pro-IL-18を切断して成熟型(活性型)のIL-1βとIL-18を生成する。(5)IL-1βとIL-18は慢性炎症を引き起こし、慢性炎症は老化を促進し、2型糖尿病や認知症や動脈硬化性疾患など様々な加齢関連疾患の発症と進展を促進する。(6)ケトン体のβヒドロキシ酪酸とω3系不飽和脂肪酸はNLRP3インフラマソームの活性を阻害することによって、老化や加齢関連疾患の発症と進展を抑制する。
498)がんと老化とNLRP3インフラマソーム
【老化は成長の延長】
老化(加齢)とがん発生と寿命は密接に関連しています。
老化速度を遅くする抗加齢治療はがんを予防し寿命を延ばします。
しかし、一時的な若返りを追求する治療はがんを促進し寿命を短くする可能性があります。このような治療法として性ホルモンや成長ホルモンやインスリン様成長因子の補充など、加齢に伴って産生が低下するホルモンや成長因子を補う治療法です。
このような成長や性機能を高める薬は、見た目の若々しさや機能の向上には有効に作用し、人はその一時的な若返り作用の誘惑に負けて利用します。
しかし、このような治療はがんの発生を促進し、寿命を短くすることが指摘されています。
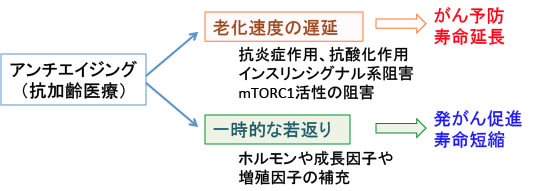
図:抗加齢医療は2つに区分できる。抗炎症作用、抗酸化作用、インスリンシグナル系の阻害、mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の阻害などは老化速度を遅延させ、がん予防と寿命延長に作用する。一方、加齢に伴って低下するホルモンや成長因子や増殖因子を補充する治療は、体を一時的に若返らせるが、長期的には発がんを促進し、寿命を短縮する。
生まれてから生殖年齢に達するまで、生き物は成長します。この成長過程において、成長ホルモンやインスリンやインスリン様成長因子や、PI3K/AKT/mTORシグナル伝達系や性ホルモンなど様々な因子が成長を促進します。
成長が終了したあとは、成長に関わってきた全ての因子が老化を促進し、がんの発生を促進する方向で作用します。
性成熟を促進する女性ホルモン(エストロゲン)や男性ホルモン(アンドロゲン)はそれぞれ乳がんと前立腺がんの発生と進展を促進します。
生殖活動を犠牲にすれば生物の寿命が延びることはショウジョウバエやネズミの実験で示されています。人間でも去勢によって寿命が延びることが報告されています。
カロリー制限や去勢や遺伝子改変によって生殖活動を弱めると寿命が延び、これは「生殖と寿命のトレードオフ」と呼ばれています。トレードオフ(trade-off)とは、一方を追求すれば他方を犠牲にせざるを得ないという状態 ・関係のことです。 生殖活動を高めると寿命が短くなるという関係があると言うことです。逆に言うと、生殖活動を弱めれば、長生きできるということです。セックスは寿命を短くするという考えですが、それを支持する根拠は多数あります。
性ホルモン以外にも、成長ホルモンやインスリン、インスリン様成長因子、上皮成長因子など体の成長を促進する様々な因子は、成熟年齢を過ぎると、老化とがんの発生・進展を促進します。
老化は成長の延長であり、成長を促進する因子は、多くの場合、老化も促進します。
生殖が終了した後は、そのまま老化を促進させる方が種の繁栄には都合が良い(若い世代に生きる場所と食料を与える方が種の繁栄には有利)ので、多くの生物は、成長に関わる因子がそのまま老化を促進し、生殖の終わった個体の死を早めているのです。
サケ科の魚のように、排卵や排精の直後に死亡したり、カマキリの雌が交尾中に雄を食べてしまうように、生殖が終了すれば直後に死ぬ生き物もあります。
アンチエイジングの領域では、ヒト成長ホルモンや性ホルモンの補充によって若返りを目指す治療が行われています。
実際に、中年以降の人に成長ホルモンを注射すると、老化の症状を逆行させる様々な効果が現れます。筋肉量が増え、脂肪組織が減り、筋力や体力が増し、男性の性的能力が向上します。しかし、中年以降の成長ホルモンの注射は、がんの発生や成長を促進する可能性が高く、そして寿命を短くする可能性が指摘されています(現段階では人間においてはまだ証明はされていません)。
マウスの研究では成長ホルモンの産生や受容体に異常がある場合は寿命が延びることが示されており、人間でも成長ホルモンが過剰に分泌される先端肥大症ではがんの発生率が高く、寿命が短くなることが知られています。
閉経後の女性に女性ホルモン(エストロゲン)を補充すると、骨粗しょう症の減少や性欲の増加や若返り効果が得られますが、乳がんを促進し、寿命に対してもマイナスに働くことが指摘されています。
男性ホルモン(テストステロン)の場合も同様で、一時的には年老いてきた男性の衰えを回復させる効果はありますが、長期にテストステロンを補充すると生存に及ぼす影響は最終的にはマイナスになることが示されています。
インスリンは性ホルモンの産生と活性を高めます。中年以降はインスリンを高めない方が寿命を延ばす効果が得られます。つまり糖質制限が寿命を延ばす根拠です。
「生殖と寿命のトレードオフ」の存在意義はまだ良く判っていません。「地球上には空間的にも食料供給にも限界があるので、生き物に寿命がなければ、いずれ生物は全滅するので、寿命や老化が必然的に存在する」という考えがあります。空間や食糧供給に限界がある状況では、繁殖力が強いほど早く死なないと、種の保存ができないということになります。実際に繁殖能の高いマウスは短命で、成熟のプロセスがゆっくりで繁殖率が低い動物(ゾウや人間など)は寿命が長いのも「生殖と寿命のトレードオフ」の1例だと考えられています。
がんを予防し、寿命を延ばそうと思えば、老化を引き起こす仕組みを知ることが必要です。
【加齢と炎症と慢性疾患】
老化や加齢というのは病気ではありません。
しかし、加齢は様々な慢性疾患の発症の最大のリスク要因になっています。
慢性疾患は生体の機能を正常に維持できない状態であり、その疾患を引き起こしている原因を取り除けなければ、個人の健康状態は次第に悪化します。
加齢とともに、関節炎、2型糖尿病、心血管疾患、腎臓病、アルツハイマー病、パーキンソン病、黄斑変性、虚弱(frailty)、呼吸器疾患、ある種のがんなど様々な慢性疾患の発症頻度が高まってきます。
このような加齢関連疾患の発症に慢性炎症が関わっていることは広く認識されています。
加齢が慢性炎症を引き起こして加齢関連疾患の発症を促進し、慢性炎症はさらに老化を促進し、加齢関連疾患をさらに悪化させます。このように、加齢と慢性炎症と加齢関連疾患との間には強い関連があり、悪循環を形成しています。
すなわち、加齢関連の慢性炎症を引き起こすメカニズムを解明し、慢性炎症を引き起こしている原因を除去することによって、老化や加齢関連の慢性疾患の発症や進展を遅延させることができます。

図:慢性炎症は老化や様々な加齢関連の慢性疾患の発症を引き起こしている。(参考:Prev Med. 2012 May; 54(Suppl): S29–S37.)
【加齢とともに炎症性サイトカインの血中濃度が高くなっている】
加齢は細胞のダメージの蓄積とダメージ関連分子パターン(damage-associated molecular patterns: DAMPs)を除去する内因性メカニズムの疲弊と考えられます。
ダメージ関連分子パターン(DAMPs)というのは、細胞傷害に伴って放出される細胞内分子で、組織の炎症を引き起こします。このDAMPsの処理能力が低下すると慢性炎症が持続します。
生体は「自己にない分子パターンを認識する」というメカニズムで細菌やウイルスや真菌などの病原体を認識して免疫を発動させます。これを「病原体関連分子パターン(pathogen-associated molecular patterns: PAMPs)」と言います。
また、細胞傷害に伴って放出される細胞内分子を「危険シグナル」として認識して炎症反応を発動させます。これをダメージ関連分子パターン(DAMPs)と総称しています。これらは、周囲の組織や細胞に危険を知らせるアラームのような役割を担っています。
壊死した細胞、細胞外に漏出したATP、高血糖、セラミド、アミロイド、尿酸結晶、コレステロール結晶など様々なDAMPsが加齢とともに増加します。
これらのDMAPsは、マクロファージなどの組織に常在する自然免疫に関与する細胞によって認識され、慢性の炎症を引き起こし、これが加齢や加齢関連疾患の原因になっています。
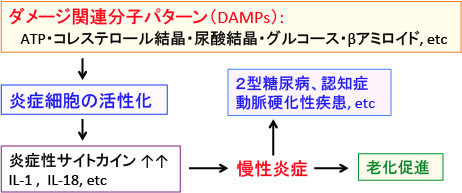
図:細胞ダメージに伴って漏出したATPや、コレステロール結晶や尿酸結晶や高血糖やβアミロイドなどの自己由来成分はダメージ関連分子パターン(damage-associated molecular patterns: DAMPs)となって、マクロファージなどの組織に存在する炎症細胞を活性化し、IL-1βやIL-18などの炎症性サイトカインの産生を高め、慢性炎症を引き起こす、慢性炎症は老化を促進し、2型糖尿病や認知症や動脈硬化性疾患など様々な加齢関連疾患の発症と進展を促進する。
中枢神経系におけるミクログリア、肝臓のクッパー細胞、骨の破骨細胞、腎臓のメサンギウム細胞などの組織に常在する貪食細胞は、傷害された組織の修復や再構築を行うためにサイトカインを産生し、臓器機能の恒常性維持に重要な役割を果たしています。
しかし、加齢関連のDAMPs(ダメージ関連分子パターン)による組織マクロファージの持続的な活性化は、組織の炎症性のダメージと機能異常を進行させるメカニズムになっています。
組織常在のマクロファージの活性化だけでなく、組織の白血球浸潤も加齢関連疾患の発症に関与しています。
現在では、加齢と炎症と慢性疾患の関連は確立されています。
男女とも65歳以上では炎症性サイトカインのIL-6やTNF-αやIL-18の血清中濃度が上昇していることが報告されています。
これらのサイトカインは、アルツハイマー病や虚弱(frailty)を含む様々な加齢関連疾患の発症に密接に関連していることが明らかになっています。
加齢に伴う炎症性サイトカインの増加は「inflammaging(炎症加齢)」という用語が提唱され、加齢関連疾患の発症を促進し、寿命を短くする原因として重視されています。
多臓器における加齢関連炎症の存在は、特別な疾患が存在しなくても、臓器機能の低下を引き起こしています。炎症によって産生が高まる活性酸素は細胞や組織に酸化傷害を与えることによって細胞や組織の老化を促進し、機能を低下させます。
炎症性の免疫応答は、成長期においては感染症から個体を守ってくれますが、年齢が進み生殖年齢が終了したあとの身体に対しては、炎症性細胞の働きは臓器機能を低下させ、寿命を短くする方向で作用します。
つまり、炎症応答というのは、感染症から身体を守るという働きがある一方、身体の老化を進行させているというトレードオフの関係が存在するのです。
炎症加齢仮説(Inflammaging theory)では、生理的加齢あるいは病的加齢はともに、自然免疫システムによって産生される炎症起因性のサイトカインによって進行されると考えています。
この炎症加齢仮説が正しければ、自然免疫の応答経路を制御することによって、加齢による臓器機能の低下を弱めることができる可能性があります。
病原菌による感染症から防御するために急性炎症のメカニズムは必要ですが、炎症応答を制御するメカニズムは加齢とともに異常をきたしています。その結果、慢性的な軽度の炎症が多くの加齢関連疾患の発症に関与しています。
【加齢と自然免疫センサーとインフラマソーム】
炎症誘発性サイトカインであるインターロイキン-1(IL-1)とIL-18は、老化を進めるインフラマソーム介在性のカスパーゼ-1活性化に関与することによって加齢に関与することが多くの研究で明らかになっています。
NLRP3(nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3)インフラマソームのような自然免疫のセンサーであるNod様受容体(Nod-like receptor:NLR)は、加齢の過程において幾つかの臓器における骨髄系細胞におけるカスパーゼ-1の活性を制御しています。
細胞外ATP、高血糖、セラミド、アミロイド、尿酸結晶、コレステロール結晶などの加齢とともに増加する様々なダメージ関連分子パターン(damage-associated molecular patterns: DAMPs)に応答して活性化されるNLRP3インフラマソームは特に加齢と関連が深いことが明らかになり、加齢関連疾患の予防や治療のターゲットになっています。
NLRP3関連の炎症を抑制すると、加齢関連のインスリン抵抗性や骨粗しょう症や認知機能低下や虚弱を抑制できることが明らかになっています。
自然免疫システムは病原菌の感染に対する第一の防御メカニズムです。
組織に常在するマクロファージのような自然免疫システムは、貪食作用によって細胞の死骸を片付けたり、成長因子やサイトカインを産生することによって、局所の臓器機能の制御や恒常性維持の機能を果たしています。
マクロファージはパターン認識受容体を使って病原体関連分子パターン(pathogen-associated molecular patterns: PAMPs)を認識し、炎症応答を開始します。この炎症応答は病原体の広がりを防ぐ初期の生体応答として重要です。
パターン認識受容体の活性化はインフラマソーム複合体の集合を導きます。インフラマソームは複数のたんぱく質から構成されます。
最も研究が進んでいるインフラマソーム複合体は、多くの活性物質が知られているNLRP3インフラマソームです。
NLR(nucleotide-binding domain leucine-rich repeat)はASCと相互作用するためのpyrin domains (PYD)を持ちます。
ASCは apoptosis-associated speck-like protein containing a carboxy-terminal CARDの略です。
さらにASCはCARD(caspase-1 activation recruitment domains)を介してカスパーゼ-1(caspase-1)と結合します。
インフラマソームが重合するとカスパーゼー1が活性化され、不活性なIL-1βとIL-18の前駆体(pro-IL-1β and pro-IL-18)は、カスパーゼ-1によって活性型のIL-1βとIL-18に変換されます。
NLRP3インフラマソームの活性化には2つのシグナルが必要です。
まず、トル様受容体を介するNF-κB依存性のIL-1βやIL-18の遺伝子発現の亢進です。ついで、複合体を重合させる引き金になる危険シグナルの認識です。
様々な危険シグナルやダメージ関連分子パターンが認識され、NLRP3インフラマソームが活性化されます。(下図参照)

図:NLRP3インフラマソームの活性化。炎症性サイトカインのIL-1βとIL-18の成熟(活性化)には、(A)トル様受容体やNF-κB活性化を介するIL-1βとIL-18の前駆体(pro-IL-1βとpro-IL-18)の遺伝子転写の誘導(シグナル1)と、(B)インフラマソームの活性化(シグナル2)という2つのシグナルが必要。①刺激を受けるとNLRP3は重合化しアダプターのASCを集め、さらにASCのCARDドメインがカスパーゼ-1前駆体(procaspase-1)をリクルートしてオリゴマーを形成する。②これによってprocaspase-1は自己切断されて活性型カスパーゼ-1(caspase-1)p10/p20テトラマーを形成する。③この活性化したカスパーゼー1はIL-1β前駆体のpro-IL-1β とIL-18前駆体の pro-IL-18を切断して成熟型(活性型)のIL-1βとIL-18を生成し、細胞外に分泌する。
(略語)
ASC: apoptosis-associated speck-like protein containing a carboxy-terminal CARD
LRR: leucine-rich repeat
NACHT: nucleotide-binding and oligomerization domain
NLRP3: NLR family, pyrin domain–containing 3
PYD: pyrin domain
(参考:Annu Rev Nutr. 2012 Aug 21; 32: 261–286. Fig.4)
【加齢に伴ってダメージ関連分子パターンが増える】
身体における炎症の増加は、様々な病気の発症と老化を促進します。
老化はIL-18とIL-1βとIL-6の増加と関連しています。IL-1βとIL-18はインフラマソーム依存性のカスパーゼ-1活性化によって産生されます。
NLRP3は加齢関連の炎症を増強する最大の原因であり、したがって、食事や薬によって異常なインフラマソーム活性化を抑制しようという考えは、加齢に伴う様々な慢性疾患を予防し、寿命を延ばす有望な戦略となります。
インフラマソームを活性化する危険関連分子パターンには、活性酸素種、コレステロール結晶、尿酸結晶、脂肪毒性のあるセラミド(lipotoxic ceramide)などがあり、これらは加齢とともに増加する内因性代謝産物です。これらの代謝産物はNLRP3依存性のメカニズムでカスパーゼ-1を活性化し、成熟型のIL-1βとIL-18の産生を亢進します。
NLRP3インフラマソームを活性化することが知られている内因性シグナルの多くは加齢とともに蓄積します。その結果、インフラマソームの持続的な活性化により、加齢関連疾患を引き起こす炎症を増悪することになります。
インフラマソーム複合体は基本的には、マクロファージや単球や好中球を含む骨髄細胞に発現しています。
細菌感染に対する防御機能がマクロファージや単球や好中球の最も重要な機能ですが、病原菌の感染に関係のない無菌性炎症が、加齢関連の炎症や疾患の発症に関連していることが明らかになっています。
【NLRP3インフラマソームの活性化が様々な病気を引き起こす】
動脈硬化の進展にマクロファージの関与が重要であることは良く知られていますが、NLRP3インフラマソームの関与が指摘されたのは2010年です。マウスの研究で動脈硬化の発生にNLRP3インフラマソームが重要な役割を果たしていることが報告されました。
動脈硬化の患者では、動脈のNLRP3の発現が亢進しており、その発現の程度は冠動脈硬化の程度と相関していることが報告されています。
冠動脈疾患患者の末梢血の単球ではNLRP3とカスパーゼ-1とIL-1βの発現が亢進していることが報告されています。
動脈硬化の血管内のプラーク(内膜の隆起)にみられるコレステロール結晶はNLRP3インフラマソームの重要な活性化因子であり、NLRP3の欠損したマウスでは動脈硬化が阻止されることが明らかになっています。
記憶と認知機能の加齢に伴う低下は、健康寿命を短くする主要な因子です。
アルツハイマー病は認知症の主要な原因であり、その最大の危険因子は加齢です。
年齢が増えるにつれてアルツハイマー病の発症が増えます。アルツハイマー病の古典的な特徴はアミロイドβ班の存在です。これはアミロイドβたんぱく質の産生亢進か分解低下によって起こります。
アミロイドβたんぱく質は自然免疫系と特にミクログリアにおけるNLRP3インフラマソームを強力に活性化する作用があります。
ミクログリアは中枢神経系における組織常在型のマクロファージです。
以前の研究では、ミクログリアがアミロイドβ班を除去する作用があると考えられていましたが、ミクログリアの欠損したマウスを使ったアルツハイマー病の動物モデルでも、脳のアミロイドβ班の量はミクログリアが存在する場合と同じレベルでした。
アルツハイマー病における神経炎症の亢進のメカニズムに関しては十分に解明されていません。しかし、最近の研究で、ミクログリアのインフラマソームの活性化が重要なメカニズムであることが指摘されています。
アルツハイマー病患者と同様に、マウスのアルツハイマー病の動物モデルでも、脳における活性化したカスパーゼ-1とIL-1の量の増加を認められています。
重要な点は、NLRP3やカスパーゼ-1を欠損させたマウスでは、神経の炎症と認知機能の低下が認められなかったことです。
この研究結果に一致して、NLRP3遺伝子を欠損したマウスでは、加齢関連のアストログリア細胞の増殖や、ミクログリア活性化や、IL-1とTNF-αの発現亢進が抑制されました。
つまり、NLRP3遺伝子が欠損したマウスでは加齢に伴う認知機能の低下が抑制されたのです。
以上の結果から、NLRP3インフラマソームは神経炎症の発生に重要な役割を担っており、加齢に伴う認知機能の低下に関与していることが強く示唆されています。
脳組織におけるNLRP3インフラマソームの活性化阻害が認知機能の低下を防げる可能性を示しています。
肥満は加齢を促進し、免疫低下や骨粗しょう症や虚弱などの加齢関連の病態を促進します。
脂肪組織の過剰、特に内臓脂肪の過剰が、肥満における多くの炎症性メディエーターの産生源であることが知られています。
肥満した脂肪組織に自然免疫および獲得免疫に関与する様々な免疫細胞が浸潤し、炎症を引き起こしています。
マクロファージは炎症起因性(pro-inflammatory)と抗炎症性(anti-inflammatory)の2つの働きを持っています。この2つの逆の作用は、2つのサブセットのマクロファージによって実行されます。
組織傷害や病原菌感染の場合は、血中を循環している単球は病変が起こっている組織にリクルートされ、炎症起因性(pro-inflammatory)の性質をもつM1型のマクロファージに分化し、感染の広がりを阻止する働きを行います。
一方、M2型のマクロファージは組織に常在していて直ちに応答でき、その主な作用は組織の恒常性を維持し炎症を収束させることです。
健康な内臓脂肪には抗炎症性のM2型の性状をもったマクロファージが常在しています。しかし、肥満になると、炎症性の性質をもったM1型のマクロファージが活性化され増加しています。
つまり、肥満した脂肪組織ではM1型マクロファージが増えていて、炎症を引き起こす炎症性サイトカイン(TNF-α、IL-6、IL-1β)の産生を増やしています。
【NLRP3インフラマソーム活性化の阻害】
インフラマソームの活性抑制は寿命延長と抗加齢とがん予防の作用が期待できます。
NLRP3インフラマソームを阻害する食品成分や食事法として、ケトン食、オメガ3系不飽和脂肪酸、カロリー制限が報告されています。
実際に、動物実験モデルではケトン体とカロリー制限が寿命を延長することが報告されています。
ケトン食がNLRP3インフラマソームを阻害することは471話と473話で解説しています。
ケトン体のβヒドロキシ酪酸とアセト酢酸は、グルコースに変わるエネルギー源となることによって飢餓時の生存を助ける働きがあります。
肝臓や筋肉の貯蔵グリコーゲンが枯渇すると、肝臓は脂肪酸を燃焼(分解)してβヒドロキシ酪酸を産生します。
したがって、カロリー制限や強度の運動や低糖質ケトン食によって、βヒドロキシ酪酸の血中濃度は上昇します。
ケトン体が炎症を抑制する作用があることは実験的に多くの研究で確かめられています。
人間とマウスのマクロファージを用いた実験でβヒドロキシ酪酸はNLRP3インフラマソーム活性化を阻害しました。
そのメカニズムとしては2段階の機序で抑制することが報告されています。インフラマソーム活性化に重要なステップであるカリウムイオンの流出を阻害する作用と、ASC重合を阻害し、その結果インフラマソーム複合体の重合を阻害する作用が報告されています。
βヒドロキシ酪酸の血中レベルを上昇させるケトン食が、生体内においてNLRP3インフラマソームによって引き起こされる加齢関連疾患を予防できるかどうかはまだ十分に検証されていません。
オメガ3系多価不飽和脂肪酸:
オメガ3系多価不飽和脂肪酸が抗炎症作用を示すことは多くの研究で確かめられています。この抗炎症作用にNLRP3インフラマソームの活性阻害作用が関連している可能性が幾つかの研究で報告されています
マクロファージや単球におけるNLRP3インフラマソーム活性化によるIL-1β分泌を、ドコサヘキサエン酸が減少させることが報告されています。その機序として、Gたんぱく質共役型受容体のシグナル伝達の阻害、トル様受容体(TLR)刺激によるTLR1/2の2量体化と細胞膜ラフトへのMyD88のリクルートメントの阻害、NF-κBの核内移行の阻害、オートファジーの亢進などが報告されています。
オメガ3系多価不飽和脂肪酸は、炎症細胞特異的にインフラマソームの活性化を阻害します。
一方、動物性脂肪などに含まれる飽和脂肪酸は末梢血の単球におけるNLRP3インフラマソームを直接活性化することが報告されています。
油脂には健康に良い油脂と悪い油脂があることを知ることが重要です。
最近の研究でも、バター、ラード、赤身肉などに含まれる飽和脂肪酸が、早死リスクを上昇させることが、30年間に及ぶ研究で明らかになっています。その一方で、飽和脂肪酸をオリーブオイルなどの不飽和脂肪酸に切り替えることで、健康上の大きな恩恵が得られることが報告されています。ω3系不飽和脂肪酸やオリーブオイルは多く摂取するほど健康作用が高まる様です。
NLRP3インフラマソームの活性化を抑制することは寿命延長に有効ですが、インフラマソームは病原体に対する防御機構において重要な働きを行っています。
高齢者ではすでに免疫機能は低下しているので、寿命を延ばすためにインフラマソーム活性を抑制することは、感染症を助長する可能性があることも知っておく必要があります。NLRP3の完全な阻害ではなく、適度な抑制が、加齢関連の炎症性疾患の予防に有効のようです。
加齢というのは、その他の外的要因とは関係なく、多くの組織においてNLRP3インフラマソームの活性化を引き起こし、局所的な炎症を増やし、組織や臓器の機能低下を引き起こしています。NLRP3インフラマソームの過剰な活性化を防ぐのががんを含めた加齢関連疾患の発生と進展を抑制するメカニズムとして重要です。
参考文献:Drivers of age-related inflammation and strategies for healthspan extension(加齢関連炎症を進行させるものと寿命延長の戦略)Immunol Rev. 265(1): 63–74.2015
| « 497)医療大麻... | 499)アンジオ... » |



