がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
485)正常なミトコンドリアは悪性形質を抑制する
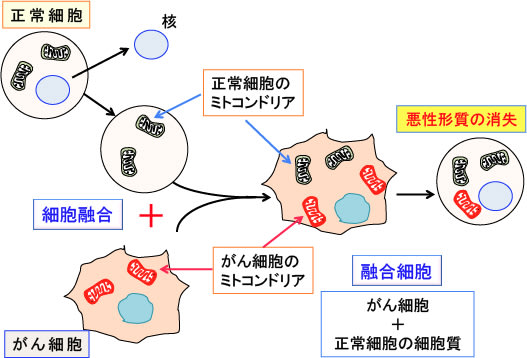
図:核を抜きとった正常細胞の細胞質をがん細胞に細胞融合させると、がん細胞の核が存在しているにも拘らず、悪性の性質が無くなる。これは、正常細胞のミトコンドリアががん細胞の悪性形質を抑制するためと考えられている。
485)正常なミトコンドリアは悪性形質を抑制する
【細胞のがん化は遺伝子異常だけでは説明できない】
個々の細胞の働きを根本的に制御しているのは、細胞核の染色体に存在する遺伝子です。
「遺伝子」というのは、遺伝情報を担う構造単位で、通常1つの蛋白質を作り出すことができる情報を持っています。この遺伝情報は染色体中のDNA(デオキシリボ核酸)に書き込まれています。
一つの細胞核に含まれる染色体の一組をゲノムといい、ヒトの場合1ゲノムは46個(22対の常染色体と1対の性染色体)の染色体があります。1ゲノム中には合計約30億塩基対の塩基配列情報が記録されており、これに含まれる遺伝子の数は22000個程度であることが明らかになっています。
遺伝子(DNA)の情報がメッセンジャーRNA(mRNA)に転写され、さらに蛋白質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います(下図)。
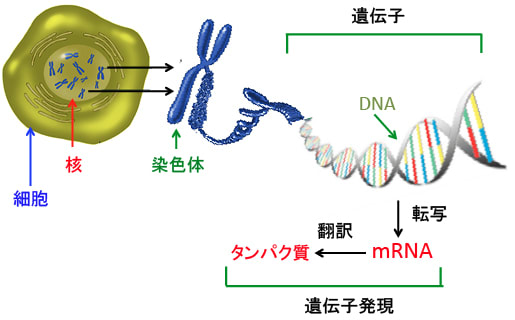
図:遺伝情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれている。DNAは2本のロープがより合わさったような二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、その配列を読み取って体に必要な蛋白質を作り出している。DNAの情報がメッセンジャーRNA(mRNA)に転写され、タンパク質に翻訳される過程を遺伝子発現と言う。
体の中の全ての細胞は同じ遺伝子を持っていますが、細胞の種類によって発現している遺伝子の種類に違いがあります。通常の細胞では全遺伝子の数分の一しか発現しておらず、発現している遺伝子の種類の違いがそれぞれの細胞の機能の違いの原因となっています。
DNA(デオキシリボ核酸)の遺伝情報には、細胞を形作り機能させるためのタンパク質の作り方と、その発現の量や時期を調節するために必要なマニュアルが組み込まれています。したがって、この遺伝子情報に誤りが生じるとその細胞の働きに異常が生じます。
例えば、正常な細胞であれば、止めどなく分裂増殖を繰り返すということはありません。それは遺伝子(DNA)の情報によって、分裂増殖のペースや限度が厳密に制御されているからです。
しかし、この細胞増殖をコントロールしている遺伝子(がん遺伝子やがん抑制遺伝子)に異常が生じると細胞は際限なく分裂を繰り返すがん細胞となります。
発がんに関係している人間の遺伝子として、100種類以上が知られており、そのうちの数個から十数個の遺伝子の異常(突然変異や発現異常)が起こった時に、正常な増殖制御を行うことができなくなり、がん細胞が発生すると考えられています。
誤りを起こす原因は、DNAに傷がついて間違った塩基に変換したり、遺伝子が途中で切れたりするためです。これをDNAの「変異」と呼び、DNA変異を引き起こす物質を変異原物質とよびます。
環境中には、たばこ・紫外線・ウイルス・添加物など変異原物質が充満しています。変異原物質は、活性酸素のように体内でのエネルギー産生や物質代謝や慢性炎症の過程でも作られます(図)。
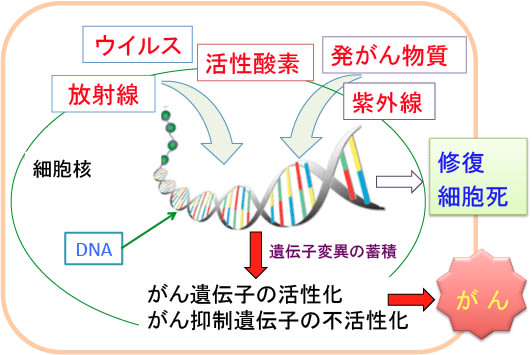
図:DNAと反応してDNAの塩基配列に異常を来して発がんの原因になるものを変異原物質という。活性酸素や放射線や紫外線やウイルスなど様々な変異原物質によってDNAの変異が起こる。細胞はDNAの損傷を修復するDNA修復機構を持っており、損傷(変異)は通常は元に戻される。高度のDNA損傷が発生した場合は細胞死(アポトーシス)を誘導して、がん細胞の発生を防いでいる。しかしながら、変異の一部が修復されずに残るか、あるいは修復時のエラーによってDNAの変異が固定されることがある。細胞の増殖や死を調節する複数の遺伝子(がん遺伝子やがん抑制遺伝子)に異常が蓄積すると細胞ががん化する。
以上のように、「細胞のがん化は遺伝子の突然変異や発現異常で起こる」という「体細胞突然変異説」が腫瘍生物学の研究者のコンセンサスになっています。
しかし、「がん細胞は遺伝子変異によって発生する」という考えだけでは説明できない研究結果も数多く報告されています。その代表が、「ミトコンドリアの異常ががん細胞を発生する」という考えです。
【がん細胞はミトコンドリアの機能が低下している】
「細胞核の遺伝子(DNA)の突然変異が蓄積して、細胞の増殖や死の制御に異常を来して、がん細胞になる」というのが、一般に認められた発がんメカニズムです。
しかし、「ミトコンドリアの異常ががん細胞の発生に重要な要因になっている」あるいは「ミトコンドリアの異常で細胞はがん化する」という考えや実験結果は、古くからあります。
体細胞突然変異説を支持する研究結果が圧倒的に多いので、「ミトコンドリア発がん説」は一般には認められていませんが、最近も再度この説が注目されてきました。つまり「がん細胞はミトコンドリアの異常によって発生する」という仮説です。
ミトコンドリア発がん説を最初に提唱したのは、オットー・ワールブルグ(Otto Warburg:1883年~1970年)です。今から80年以上も前のことです。
ワールブルグは呼吸酵素(チトクローム)の発見で1931年にノーベル生理学・医学賞を受賞したドイツの生化学者です。細胞生物学や生化学の領域で重大な基礎的発見を次々に成し遂げ、呼吸酵素以外の研究でも何回もノーベル賞候補になった偉大な科学者です。そのワールブルグが最も力を注いだのががん細胞のエネルギー代謝の研究です。
ベルリンの当時のカイザー・ ヴィルヘルム生物学研究所(Kaiser Wilhelm-Institute for Biology;現在のマックスプランク研究所)にいたワールブルグ博士とその共同研究者たちが初めて、動物や人間の多くの腫瘍のグルコースの取込みとエネルギー産生量を測定しました。
生体内(in vivo)および試験管内(in vitro)での測定において、正常細胞に比べてがん細胞ではグルコース(ブドウ糖)の取込み量が数倍に増えており、そのグルコースからの乳酸の産生量が増加していることをワールブルグ博士は明らかにしました。
正常細胞でも酸素が無い条件では乳酸の産生が増えます(嫌気性解糖)が、酸素が十分に存在すれば乳酸への変換は抑制されます。しかし、がん細胞では酸素が十分に利用できる条件でも、乳酸の産生が増えていることをワールブルグ博士は明らかにしたのです。
このように酸素が十分にある状況でもがん細胞がグルコースの取込みを増やし乳酸の産生を増やす現象をワールブルグ効果(Warburg effect)あるいは好気性解糖(aerobic glycolysis)と呼んでいます。酸素が十分に存在しても酸素を利用しない解糖系でのエネルギー産生が増えていることを意味します。
そこでワールブルグ博士は、「がん細胞と好気性解糖はミトコンドリアでの呼吸(酸化的リン酸化)の異常によって引き起こされる」という仮説を立てました。
ワールブルグ自身は、ミトコンドリアにおける酸化的リン酸化の機能欠損が細胞のがん化の原因だと考えていました。しかし、その後の研究で、多くのがん細胞においてミトコンドリアの機能自体は障害されていないことが明らかになっています。
そこで、がん細胞が解糖系を好む理由とそのメカニズムの解明が、がん研究における重要なテーマになっています。様々ながん遺伝子の異常や活性化が、がん細胞のワールブルグ効果の成り立ちに関与していることが明らかになっています。
最近では、ミトコンドリアの異常が逆行性に細胞核の遺伝子発現やシグナル伝達系に影響することも報告されています。
【がん細胞はグルコースの取込みが亢進している】
がんに勝つには、がん細胞の特徴と弱点を理解することが重要です。この点において、がん細胞のエネルギー代謝の特徴である「ワールブルグ効果」を理解することは重要です。
それは、このワールブルグ効果を是正なり阻止する方法ががん治療として有効であることが明らかになっているからです。
がんが怖いのは、細胞分裂して数を増やし、増殖するためです。増殖が止められれば、がんは怖くありません。
がん細胞が数を増やしていくには、莫大なエネルギー(ATP)と細胞を構成する成分(タンパク質や脂質や核酸)が必要です。がん細胞では正常細胞に比較して、数倍から数十倍のエネルギー産生と物質合成が行われています。
そこでまず、エネルギー産生の概略を説明します。
細胞を働かせる元になるエネルギーは、栄養として食事から取り入れたグルコース(ブドウ糖)を分解してATPを作り出すことによって得ています。
ATPはアデノシン3リン酸(Adenosine Triphosphate)の略語で、エネルギーを蓄え,供給する分子としてエネルギーの貨幣としての役割を持っています。
ヒトの血液中にはおよそ80~100mg/100mlのブドウ糖が存在します。
ブドウ糖は血液中から細胞に取り込まれ、1)解糖(glycolysis)、2)TCA回路(クエン酸回路やクレブス回路と呼ばれる)、3)電子伝達系における酸化的リン酸化をへて、二酸化炭素と水に分解され、エネルギーが取り出されます。
解糖はグルコースがピルビン酸になる過程で、この酵素反応は細胞質で行われます。ピルビン酸は酸素の供給がある状態ではミトコンドリア内に取り込まれて、アセチルCoAに変換され、TCA回路と電子伝達系によってさらにATPの産生が行われます。
すなわち、ミトコンドリアに取り込まれたピルビン酸は、ピルビン酸脱水素酵素によって補酵素A(CoA)と結合してアセチルCoAになり、さらにアセチルCoAは、TCA回路に入ってNADHやFADH2が生成されます。この酵素反応はすべてミトコンドリアの基質で行われます。
こうして生成されたNADHやFADH2は、ミトコンドリア内膜に埋め込まれた酵素複合体に電子を渡し、この電子は最終的に酸素に渡され、まわりにある水素イオンと結合して水を生成します。
このようにTCA回路で産生されたNADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化(oxidative phosphorylation)と呼び、これの酵素反応をおこなうシステムを電子伝達系(electron transfer system)と呼びます。こうしてつくられたATPはミトコンドリアから細胞質へ出て行き、そこで細胞の活動に使われます。
酸素の供給が十分でないとピルビン酸は細胞質で乳酸に変わります。この状態を嫌気性解糖(aerobic glycolysis)と言います。運動をして筋肉細胞に乳酸が貯まるのは、酸素の供給が不足して嫌気性解糖が進むからです。
酸素が十分にある状態では、ミトコンドリア内で効率的なエネルギー生産が行われます。グルコースの供給が少ないときは、脂肪酸やアミノ酸もアセチルCoAからエネルギー産生に使われます。
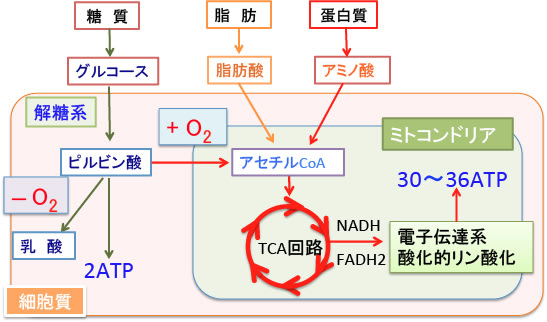
図:細胞は血中のグルコースを取り込み、解糖系、TCA回路、電子伝達系における酸化的リン酸化系を経て、エネルギー(ATP)を産生している。グルコース1分子から解糖系だけでは2個のATPしか産生されないが、ミトコンドリアでの酸素呼吸で完全に分解されると、さらに30〜36個のATPが産生される。酸素が不足すると解糖系が進んで乳酸が蓄積する。酸素が十分に利用できる場合はミトコンドリアで効率的なエネルギー産生が行われる。
酸素を使わない解糖系ではブドウ糖1分子から2分子のATPしか産生できません。ミトコンドリアでの酸素を使った酸化的リン酸化では1分子のブドウ糖(グルコース)からさらに30〜36分子のATPを産生できます。細胞質における解糖系とミトコンドリアでのTCA回路と酸化的リン酸化で1分子のブドウ糖から合わせて最大で38分子のATPが産生されます。
しかし、がん細胞では酸素が十分に利用できる状況でも、ミトコンドリアでの酸化的リン酸化が抑制され、酸素を使わない解糖系でのATP産生に依存しているのが特徴です。
解糖系に依存したATP産生は非効率的で増殖には不利のはずです。1分子のブドウ糖から産生されるATPの量は、ミトコンドリアで完全に分解されると最大で38分子であるのに対して、解糖系だけでは2分子しかできません。
しかし、がん細胞がエネルギー産生効率を犠牲にして酸化的リン酸化を抑制するのには訳があります。それは、細胞構成成分を合成する材料として多量のブドウ糖が必要になっているためです。
細胞が分裂して数を増やすためには核酸や細胞膜(主に脂質から構成される)やタンパク質(アミノ酸から合成される)などの細胞構成成分を新たに作る必要があります。細胞は、解糖系やその経路から派生するペントース・リン酸経路などの細胞内代謝系によってブドウ糖の炭素骨格から核酸や脂質やアミノ酸を作ることができます。
つまり、エネルギー産生と物質合成を増やすという2つの目的を両立させるために、必然的にミトコンドリアでの酸化的リン酸化が抑制され、解糖系に依存したエネルギー代謝が亢進し、ブドウ糖の取込みが亢進していると考えられます。
ミトコンドリアでブドウ糖の炭素骨格を全て二酸化炭素(CO2)と水(H2O)に分解すると細胞分裂のための細胞構成成分が作れなくなることが酸化的リン酸化を抑制せざるを得ない理由の一つと言えます。
また、ミトコンドリアでの酸化的リン酸化は活性酸素を産生するので、細胞内の酸化ストレスが高まると細胞死を引き起こす原因になります。がん細胞は死ににくくするためにミトコンドリアの活性を抑制しているという考えもあります。
がん細胞では、酸素が十分に使える状況でも酸素を使わず、解糖系が亢進し、乳酸の産生が増え、ミトコンドリアでの酸化的リン酸化が抑制されているというワールブルグ効果はがん細胞の生存と増殖に様々なメリットを与えます(下図)。

図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸化的リン酸化は抑制されている。これをワールブルグ効果と言う。グルコースの取り込みが増えると、アミノ酸や核酸や脂肪酸の合成に必要な中間代謝産物を増やすことによって、細胞の増殖に必要な細胞成分を増やすことができる。乳酸と水素イオン(H+)はがん組織を酸性化し、周囲正常組織にダメージを与え、がん細胞の浸潤や転移を促進する。ミトコンドリアの酸化的リン酸化が抑制されるとアポトーシスが起こりにくくなる。したがって、ワールブルグ効果はがん細胞の増殖に有利に働き、がん細胞のワールブルグ効果を阻害するとがん細胞の増殖や転移を抑制し、アポトーシスを誘導することができる。
【正常なミトコンドリアは腫瘍形成能を抑制する】
ミトコンドリアは赤血球以外の全ての真核細胞の細胞質中にある細胞小器官です。細胞内の数は細胞の種類によって異なりますが、多くの細胞は数百個~数千個のミトコンドリアを持っています。2重の膜からなる構造で、内側にある内膜は多くのひだがあり、内側に向かって入り込んだ部分をクリステと言います。
がん細胞では、ミトコンドリアの形態や機能に様々な異常が報告されています。そして、がん細胞のミトコンドリアが正常に働くとがん細胞としての性質(増殖や転移する性質)が抑制されることが知られています。
例えば、核を抜き出した正常細胞とがん細胞を細胞融合させると、がん細胞は腫瘍組織を作る能力が無くなることが報告されています(トップの図)。
すなわち、がん細胞に移入された正常細胞のミトコンドリアが、がん細胞の悪性の性質(腫瘍組織を作る能力)を抑制することができるということです。これは、がん細胞の発生メカニズムは遺伝子変異だけでは説明できず、ミトコンドリアが何らかの関与をしていることを示唆しています。
ミトコンドリアでの酸素呼吸は細胞の分化(細胞の構造や機能が特殊化していくこと)に必要であり、酸素呼吸が行われないと、嫌気性解糖系の活性化、脱分化、無制限の増殖が起こるという報告もあります。
例えば、ミトコンドリアDNAを欠損させた細胞を作ってミトコンドリアでの酸化的リン酸化を起こさないようにすると、その細胞はがん細胞の性質を獲得し、腫瘍を形成することが報告されています。
これは、ミトコンドリアでのエネルギー産生の障害が長く続くことが発がん過程において重要なステップになるという考えです。ミトコンドリアの異常が、発がんのメカニズムにどのように関与するのか、不明な点が多く残されていますが、いろんな仮説や理論が提唱されています。次のような論文があります。
Crosstalk from Non-Cancerous Mitochondria Can Inhibit Tumor Properties of Metastatic Cells by Suppressing Oncogenic Pathways.(非がん細胞のミトコンドリアからのクロストークが腫瘍関連シグナル経路を抑制することによって転移細胞の腫瘍性形質を阻害する)PLoS One. 2013; 8(5): e61747.
【要旨】
ミトコンドリアと核のクロストーク(シグナル伝達系が相互に影響しあうこと)とミトコンドリアからの逆行性制御が、細胞の性状に大きな影響を及ぼしている。
ミトコンドリアを入れ替えるサイブリッド(cybrid; 細胞雑種)の実験系は、細胞核の存在下での異常ミトコンドリアの作用を研究する上で役立つ。
サイブリッドを使った実験系は、ミトコンドリアの機能やがん細胞の特性におけるミトコンドリアDNAの特殊な変種の役割に焦点を合わせた研究が多い。
しかし、これらのミトコンドリアDNAの変種は良性の多形性であって、その機能的な役割は知られていない。
がん細胞のおけるミトコンドリアの欠陥を正常化する目的と、がん治療におけるターゲットとしてのミトコンドリアの役割を確立するためには、がん細胞の核の存在下でのがん細胞の特性を正常化させるミトコンドリアの機能を理解することは極めて重要である。
本研究では、高度に転移活性の高いがん細胞を用い、非がん細胞のミトコンドリアを導入することによって腫瘍性特性を正常化できる可能性について検討した。
悪性度の高い骨肉腫細胞株からミトコンドリアDNAを欠損させた143B TK-ρ0細胞と、良性の乳腺上皮細胞株のMCF10Aから採取したミトコンドリアを融合させてサイブリッドを作成した。さらに、中等度に転移活性を有する乳がん細胞株のMDA-MB-468 と骨肉腫細胞株の143B とのサイブリッドを作成した。
これらのサイブリッド(雑種細胞)では、がん細胞に由来する細胞核が存在するにも拘らず、がん細胞由来のミトコンドリアを導入した場合に比較して、正常な細胞からのミトコンドリアを融合させたサイブリッドでは、ATP合成や酸素消費や呼吸鎖活性の亢進など、ミトコンドリア機能の亢進を認めた。
興味深いことに、正常細胞のミトコンドリアは、143B TK-細胞の増殖能、無酸素状態での生存、アポトーシス抵抗性、抗がん剤抵抗性、浸潤能、寒天上でのコロニー形成能、ヌードマウスにおける移植腫瘍の増殖速度などを含めて、様々ながん性特性を正常化させることができた。
マイクロアレイ解析では、がん細胞のミトコンドリアを導入した場合に観察されて幾つかの腫瘍性シグナル伝達系が、正常細胞からのミトコンドリアを導入したサイブリッドでは阻害された。
これらの結果は、ミトコンドリアと核のクロストークが腫瘍形成において重要な制御機能を果たしており、ミトコンドリア機能を正常化することががん治療のターゲットとなる可能性を示唆している。
Cybrid(細胞雑種)はCytoplasmic hybridの意味です。悪性度の高いがん細胞に正常細胞のミトコンドリアを細胞融合によって導入すると、そのがん細胞としての性質を喪失するという実験結果です。
がん細胞に正常細胞のミトコンドリアを導入すると、がん細胞の様々な性質(無制限の増殖、無酸素下での生存、アポトーシス抵抗性、抗がん剤抵抗性、浸潤、マウスへの移植腫瘍の形成能などの性質)が喪失しました。
がん細胞と正常細胞の細胞質を細胞融合させると、がん細胞の核(遺伝子)が存在するにも拘らず、ミトコンドリアの機能が亢進し、ミトコンドリアでのATP合成と酸素消費と呼吸鎖活性が亢進します。
ミトコンドリアのたんぱく質をコードしている遺伝子の多くは核の遺伝子に存在するにも拘らず、正常細胞に由来するミトコンドリアを導入すると、がん細胞の腫瘍形成性の表現型とシグナル伝達系は抑制されます。
がん細胞の核の存在下でもミトコンドリア機能が正常であれば、腫瘍性が消失するという実験結果です。
細胞核の遺伝子異常(体細胞突然変異)よりもミトコンドリアの機能異常の方が重要かもしれないという可能性を示唆しています。
このような正常細胞とがん細胞の核と細胞質を置き換えるような実験を核-細胞質置換実験(nuclear-cytoplasmic transfer experiments)と言っています。
この論文のまとめは以下のように記載されています。
総合的に考察すると、この論文で紹介した実験結果は、細胞の遺伝子変異だけではがん細胞の成り立ちを全て説明できないこと、さらにミトコンドリアを含む正常な細胞質は細胞の腫瘍形成能を抑制できることを証明する確固たる証拠を提供している。
腫瘍のタイプや実験動物の種類や実験方法などは様々であるが、核-細胞質置換実験の結果が一致している点は興味深い。
遺伝学と発生生物学の分野のリーダー達がこれらの研究を行っており、それが実験結果の有効性をさらに支持している。
さらに、大部分の研究は、がんの体細胞突然変異仮説を検討するために行われたものではなく、むしろ腫瘍形成性を引き起こす核突然変異の重要性を決定するために行われたものであった。したがって、データの解釈は公平であった。
重要な科学実験結果はしばしば再現できていないという最近の懸念を考慮すると、これらの実験結果の再現性の高さは注目に値する。
体細胞突然変異論の信憑性に疑問を投げかけるような実験結果が多数報告されているが、これらのいずれも、この論文で紹介した核細胞質置換実験から引き出された結論ほど強力な証拠ではない。
さらに、ChernetとLevinは最近の研究において、遺伝子変異の存在なしに、生体電気膜のシグナル伝達を変更することによって、アフリカツメガエルのメラノサイトを転移性の性質に変えることを示している。この実験結果は、腫瘍形成性の表現型が核の遺伝子変異に依存しないことを示唆している。
言い換えると、遺伝子変異だけでは腫瘍を形成するには不十分であり、ある種の細胞においては遺伝子変異がなくても腫瘍形成能を示すことができる。
これらの実験結果は、がんの体細胞突然変異論の基盤の信憑性に重大な疑問を投げかけている。
核細胞質置換実験の結果はがんの体細胞突然変異論を支持しておらず、ワールブルグの説を強く支持している。
ワールブルグ効果はミトコンドリアでの呼吸が低下することに依存するため、ミトコンドリア機能の正常化はワールブルグ効果を抑制することになる。
好気的解糖はミトコンドリアでの呼吸が不十分なために起こる。
正常なミトコンドリアは呼吸を促進してがん遺伝子の発現と腫瘍形成能を抑制する。一方、がん細胞から採取したミトコンドリアは呼吸を回復させることはできず腫瘍形成能を抑制できない。
ワールブルグの理論によると、がん細胞に正常ミトコンドリアを導入すると細胞レドックス状態を回復させ、ミトコンドリアのストレス応答を抑制し、そして最終的には、生存を維持するための発酵(ワールブルグ効果)を抑制ないし阻止する。
別の言葉で言い換えると、正常なミトコンドリア機能は細胞の分化した状態を維持し発がん過程を抑制し、異常なミトコンドリアは細胞の脱分化と発がん過程を促進する。
ミトコンドリアでの正常な呼吸が腫瘍形成能を抑制することが報告されている。
細胞の増殖というのは、いかなる積極的な制御から拘束されなくなる状態である。
ミトコンドリアは細胞の分化と増殖停止を維持することができる。
ミトコンドリアの喪失は、酸素の無かった太古の地球において単細胞生物が無制限な増殖を行っていたのと同様の代謝状況になる。
【ミトコンドリアの酸化的リン酸化を阻害すると細胞ががん化する】
細胞核のDNAとミトコンドリアDNAが協調して発現することが、細胞の正常な働きに重要です。
核やミトコンドリアに存在する遺伝子でコードされているミトコンドリアたんぱく質の異常が、ミトコンドリアの機能や、アポトーシスと細胞生存のシグナル伝達経路に影響し、ミトコンドリア関連の細胞機能異常をきたします。
ミトコンドリアDNAが欠損すると細胞はがん化することが報告されています。以下のような論文があります。
Tumorigenic transformation of human breast epithelial cells induced by mitochondrial DNA depletion. (ミトコンドリアDNAの欠損によって誘導されるヒト乳腺上皮細胞の腫瘍性変化)Cancer Biol Ther. 2008 Nov; 7(11): 1732–1743.
人間の細胞のミトコンドリアDNAには酸化的リン酸化に関与する13種類のたんぱく質の遺伝子がコードされています。
この報告では、ミトコンドリアDNAを欠如した乳腺上皮細胞(ρ0細胞)を作成して、乳がん細胞の発生過程におけるミトコンドリアの酸化的リン酸化の役割を検討しています。
結論は、乳腺上皮細胞のミトコンドリアDNAを欠如させると、がん細胞の性質を示し、マウスに移植すると腫瘍を形成しました。
元の細胞(ミトコンドリアDNAが正常)とρ0細胞(ミトコンドリアDNAが欠如)の違いを解析した結果、フィブロネクチン(fibronectin)ネットワークとp53ネットワークの2つのネットワークに違いが見つかりました。
フィブロネクチン・ネットワークに関しては、ラミニン、インテグリン、ペルオキシレドキシン(peroxiredoxin)の6つのメンバーのうち3つにおいて、ρ0細胞で異常を認めました。
P53ネットワークに関しては、SMC4とWRNの発現に異常を認め、これは染色体安定性(chromosomal stability)に関与することが示唆されました。
実際にρ0細胞では、DNA二重鎖切断(DNA double strand breaks)と特徴的な染色体再構築(chromosomal rearrangements)の増加が認められました。
さらに、p53ネットワークにおける細胞接着たんぱく質のclaudin-1 とclaudin-7の異常が認められました。
ρ0細胞では、claudin-1 とclaudin-7の発現が低下していました。乳がん細胞でもclaudin-1 とclaudin-7の発現は低下していました。
以上の結果から、ミトコンドリアDNAにコードされた酸化的リン酸化に関与する遺伝子は、ミトコンドリアから細胞核への逆行性制御によって、乳がんの発生に重要な働きを行っていることを示していると言っています。
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年ほど前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
大気中に増える酸素による悪影響に苦しんでいた原始真核生物にとって、酸素を使ってATPを作り出す好気性細菌との共生は好都合でした。好気性細菌は生体にダメージを与える酸素をブドウ糖に結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができるからです。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。
このように、ミトコンドリアはかつて細菌で、そのため見かけは細菌に似ています。直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1〜4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞(ひだ)や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。
ミトコンドリアは酸素を使ったエネルギー(ATP)産生だけでなく、脂肪酸合成や、アミノ酸や核酸や鉄の代謝、無機イオンの細胞内恒常性の維持、細胞のシグナル伝達、細胞死(アポトーシス)の制御などに重要な役割を果たしています。
ミトコンドリアにもDNAが存在します。これをミトコンドリアDNAと言います。
好気性細菌の時代に持っていたDNAの多くは、寄生した細胞の核に取り込まれています。しかし、幾つかのDNAはまだミトコンドリアに残っています。
ミトコンドリアDNAは16,569bpの環状の分子です。D-loopという部位がミトコンドリアDNAの複製や転写を制御しています。ミトコンドリアDNAには酸化的リン酸化に関与するたんぱく複合体の85種類のサブユニットのうち13種類のたんぱく質(複合体I,III, IV, Vのサブユニット)を作成する遺伝子が存在します。
その他のサブユニットは核のDNAにコードされており、細胞質でたんぱく質に翻訳されて、ミトコンドリアに移行します。
呼吸鎖の複合体IIを構成する4つのサブユニットは全て核のDNAにコードされています。
つまり、ミトコンドリアでの酸化的リン酸化が正常に行われるためには、細胞核とミトコンドリアに存在するDNAが必要です。ミトコンドリアDNAを欠損させると、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が起こりません。
ミトコンドリアでは酸素呼吸をするために活性酸素が産生され、そのためにミトコンドリアDNAの損傷が起こりやすくなっています。とくにD-loop領域の異常は多くのがん細胞で見つかると報告されています。この領域の異常はミトコンドリアDNAの複製を妨げるので、ミトコンドリアDNAの量が減少します。
例えば、ミトコンドリアDNAでコードされているチトクロームC酸化酵素のサブユニットIIが乳がんと卵巣がんの40%において検出されないという報告があります。
最近の研究で、ミトコンドリアDNAの減少は、がん細胞の悪性進展や乳がん患者の予後不良と相関していると報告されています。
多くのがん細胞でミトコンドリアDNAの欠損や異常が明らかになっています。
この論文では、ミトコンドリアDNAを欠損した乳腺上皮細胞を作成し、その元になった正常な乳腺上皮細胞と比較しています。その結果、ミトコンドリアDNAに存在する酸化的リン酸化に関連する遺伝子の欠損は、培養細胞を使った実験では細胞は悪性形質を示すようになり、マウスの移植腫瘍の実験では腫瘍形成能を獲得することが明らかになりました。
つまり、ミトコンドリアでの酸化的リン酸化を阻害すると、細胞はがん化するという結論です。
ただし、これを支持しない報告やこの仮説に矛盾する報告も多くあります。
むしろ、体細胞突然変異(核遺伝子の変異)とミトコンドリアの機能異常が相互に密接に関与していると考える方が妥当かもしれません。どちらか一方に決めつける必要はないようです。
細胞核の遺伝子変異とミトコンドリアの異常が、相互に作用しあって、がん細胞の様々な異常を引き起こしていると考えられます。
このように遺伝子の突然変異だけでなく、ミトコンドリアの異常が細胞のがん化に関与しているという点が重要です。ミトコンドリアを正常化させると、がん細胞の悪性形質を低下させることができるからです。
がん細胞はミトコンドリアでの酸化的リン酸化に異常があって、ミトコンドリアでのATP産生が低下しています。
もし、がん細胞がミトコンドリアでATP産生ができるときは、ジクロロ酢酸などでミトコンドリアを活性化するとがん細胞は活性酸素の産生が増えて、死滅させることができます。
ミトコンドリアでの代謝やATP産生が阻害されている状況にあるときは、2−デオキシグルコースやメトホルミンやケトン食などで解糖系を阻止するとがん細胞の増殖を抑えることができます。がん細胞はミトコンドリアでのATP産生ができないので、解糖系を抑えれば、がん細胞の増殖を抑えることができます。
つまり、解糖系を阻害しながらミトコンドリアを活性化すると、がん細胞を死滅させることができます。この方法については、355話「解糖系を阻害しながらクエン酸回路(TCA回路)を活性化するとがん細胞は死滅する?」で解説しています。
ジクロロ酢酸とメトホルミンと2-DGとケトン食の組合せも有効です。がん治療に試してみる価値はあります(417話)。
正常細胞とがん化した細胞を区別する最も重要な形質と考えられるのが足場非依存性増殖(anchorage-independent growth) です。
正常細胞が増殖する際には「足場」を必要とします。
足場というのは、「細胞外マトリックス」や「細胞間マトリックス」など細胞と細胞の間を埋める物質で、接着剤的役割を務めます。コラーゲン、プロテオグリカン、フィブロネクチンやラミニンといった糖タンパク質などが主な成分です。
正常細胞はこのような足場がないと増殖できません。正常細胞は足場を除かれると、細胞周期のG1期に停止し自然死(アポトーシス)に至ります。
しかし、がん細胞は足場がなくても生存し増殖できます。
具体的には軟寒天コロニー形成アッセイ法(soft agar colony formation assay)を用います。
正常細胞は細胞がシャーレに接着していないと増殖できないのにたいして、がん化した細胞は軟寒天中などの細胞接着のない浮遊状態でも増殖することができます。
軟寒天の培地に細胞を入れて、コロニーを形成するかで判定します。細胞が増殖してコロニーを形成すれば、足場非依存性増殖能を持っていることを意味し、がん細胞の形質を持っていることを示します。
この足場非依存性増殖能は細胞の造腫瘍性(ヌードマウスなどに接種して腫瘍を形成する活性)と非常に密接に関連しています。
この論文での実験では、正常細胞からミトコンドリアDNAを欠損させると、足場非依存性増殖とヌードマウスへの移植腫瘍の形成を示す結果が得られています。つまり、がん細胞の形質を獲得するという結果です。浸潤能やアポトーシス抵抗性も確認しています。
つまり、遺伝子の変異が無くても、ミトコンドリアDNAを欠損させるだけで、がん細胞の形質を獲得することが示されています。
ミトコンドリアをターゲット にしたがん治療法が注目されています。
画像をクリックするとサイトに移行します。
| « 484)医療大麻... | 486)ミトコン... » |





