がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
321)がんと寿命とmTORC1
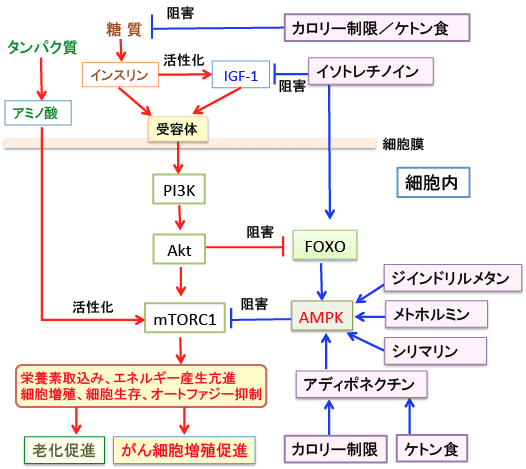
図:インスリン/インスリン様成長因子-1(IGF-1)で活性化されるPI3K/Aktシグナル伝達系が活性化されると、mTORC1(哺乳類ラパマイシン標的蛋白質複合体1)が活性化され、転写因子のFOXO(Forkhead Box O)は抑制される。その結果、細胞の老化とがん細胞の増殖が促進される。AMP依存性プロテインキナーゼ(AMPK)を活性化するとmTORC1を抑制できる。カロリー制限による寿命延長とがん抑制効果はmTORC1活性の抑制が重要なメカニズムと考えられている。mTORC1活性を抑制する方法を組み合わせると、カロリー制限と同じ効果が達成できる可能性がある。あるいはカロリー制限とこれらを併用すると、さらに抗がん作用と寿命延長効果が得られる可能性がある。mTORC1活性の抑制は進行がんの治療のターゲットとして重要である。
321)がんと寿命とmTORC1
【日馬富士とにきびと牛乳】
牛乳や乳製品の摂取とにきびの発症が密接に関連していることを前回(319話と320話)解説しました。
すなわち、牛乳・乳製品に含まれる牛乳タンパク質に豊富に含まれるロイシンはmTORC1(mammalian target of rapamycin complex-1:哺乳類ラパマイシン標的蛋白質複合体-1)を活性化し、mTORC1の活性亢進は皮脂腺からの皮脂の分泌を促進してにきびの原因となることが報告されています。
さらに、牛乳にはウシ由来のステロイドホルモンの5α-pregnanedionが含まれており、これは人の体内で男性ホルモンのdihydroteststeroneに変換されます(Dermato-Endocrinology 1:1. 12-16, 2009年)。
男性ホルモンは皮脂腺の活性を高めるので、牛乳はmTORの活性化と男性ホルモンのテストステロンの増加の両方の相乗効果によって皮脂腺の活性が高くなって皮脂の分泌が増え、にきびを悪化させます。
mTORC1の活性化と男性ホルモンの増加は前立腺がんのリスクを高めるので、牛乳の摂取が多いとにきびと前立腺がんが発症するリスクが高くなります。牛乳・乳製品にグリセミック負荷(ブドウ糖負荷)の高い高糖質食や肉類の摂取が組み合わさるとさらににきびと前立腺がんのリスクが高まります。
mTORC1の活性亢進と男性ホルモンの増加は筋肉量を増やします。したがって、スポーツ選手などが筋肉量を増やす目的で牛乳やロイシンの豊富なアミノ酸飲料やサプリメントを摂取することは科学的に根拠があります。
先週終わった大相撲初場所で優勝した日馬富士のにきびがインターネット上で話題になっています。ネットで「日馬富士 にきび」と検索すると4万件以上がヒットします。顔だけでなく、胸や背中にもにきびがあり、28歳という年齢を考えると非常に気になるにきびです。今までの話から、日馬富士は牛乳を多く飲んでいるのではないかと推測したので、「日馬富士 牛乳」でグーグルを検索すると、なんと69万件以上の記事がヒットし、そこには、「日馬富士は体重と筋肉を増やす目的でプロテインと牛乳を混ぜたものを1日3回、計1.5リットル飲み続けている」というような記事が多く載っていました。つまり、日馬富士の強さの秘密は牛乳を大量に飲むことにあるようですが、もともとにきびができやすい体質の人が牛乳やプロテインを大量に摂取すればにきびを悪化させることになるので、日馬富士のにきびはひどいのかもしれません。
ただ、筋肉を増やすために牛乳を多く摂取することはがんと老化を促進する可能性があるので、注意が必要です。
例えば、牛乳の摂取が前立腺がんのリスクを高めることは多くの証拠があります。
40カ国の前立腺がんの発生率と牛乳や乳乳製品の消費量の関係を検討した研究では、牛乳・乳製品の消費量と前立腺がんの発生との間に強い正の相関があるという結果が得られています。(Int J Cancer. 98(2):262-7. 2002)
47,781人を対象にした米国の「the Health Profesional Follow-up Study」では、1日2回以上牛乳を飲む人は、進行性の前立腺がんを発症するリスクが1.6倍になることが報告されています。(Cancer Res. 58(22):5117-22. 1998)
同じく米国の2万人以上の医師を対象に11年間追跡調査した「the Physicians Health Study」では、1日2.5回以上の乳製品の摂取は、1日1回以下の摂取に比べて、前立腺がんの発生率が1.34倍になるという結果が得られています。(Am J Clin Nutr. 74(4):549-54. 2001)
14万人余りを平均8.7年間追跡したヨーロッパで行われた前向きコホート研究では、1日当たりの牛乳タンパク質の摂取量が35g増えると前立腺がんの発症率が32%増えるという報告もあります。(Br J Cancer. 98(9):1574-81. 2008 )
いろんな研究を総合すると、前立腺がんのリスクを高める原因は牛乳タンパク質にあると最近は考えられています。(312話参照)
そこで、筋肉量を増やす目的で牛乳を多く摂取している人は、前立腺がんに注意が必要で、前立腺がんの予防効果のある食品を多く摂取することが勧められます。そのような食品としては、大豆製品(豆乳、豆腐、納豆など)、リコピンの豊富なトマト、DHAやEPAを多く含む脂ののった魚、DHA/EPAのサプリメント、α-オレイン酸の豊富な亜麻仁油、ブロッコリーやケールやキャベツなどのアブラナ科野菜、アブラナ科植物に含まれるがん予防成分のジインドリルメタンのサプリメントなどが有効です。
【mTORC1はタンパク質と脂質の合成を促進する】
mTOR(mammalian target of rapamycin:哺乳類ラパマイシン標的蛋白質)はラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
mTORにはmTOR複合体1((mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2((mammalian target of rapamycin complex 2:mTOR2)の2種類があります。
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。
インスリンやインスリン様成長因子やロイシンによって活性化されるのはmTORC1の方です。
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。
したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を酸化して得られるATP)が必要です。
このような栄養素とエネルギーが存在する条件で、増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、タンパク質や脂質の合成を促進して細胞増殖を実行するのが、mTORC1です。
mTORC1を活性化するシグナル伝達経路の代表は、インスリンやインスリン様成長因子などの成長因子の受容体から惹起されるPI3K-AKTシグナル伝達系です。
すなわち、細胞が増殖因子などで刺激を受けるとPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。このAktのターゲットの一つがmTORC1です。Aktによってリン酸化(活性化)されたmTORC1はタンパク質や脂質の合成や細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します。
この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。
PI3K/Akt/mTORC1経路の阻害は、抗がん剤や放射線治療の効き目を高める効果も報告されています。mTORC1阻害剤は免疫抑制という欠点を持ちますが、がん細胞や肉腫細胞の多くにおいてmTORC1が活性化されているため、抗がん剤として有効性が高く、すでに幾つかのmTORC1阻害剤が開発され、抗がん剤として使用されています。
mTORC1を活性化する別のルートがアミノ酸のロイシンです。ロイシンにはインスリンの分泌を促進する作用が知られており、筋肉を増やす効果があります。そのため、スポーツ選手が筋肉を増やすためのサプリメントとしても利用されています。
さらに最近の研究で、ロイシンが直接mTORC1を活性化する機序が報告されています。つまり、アミノ酸の供給が増えれば、細胞が成長し分裂を刺激するということです。タンパク質の摂り過ぎががんを促進するという理由とも関連しています。
牛乳に含まれるタンパク質にはロイシンが多く、牛乳のタンパク質は肉のタンパク質に比べてmTORC1を活性化する作用が強いという研究報告があります。(詳しくは312話参照)
【栄養飢餓になるとmTORC1が不活性化されてオートファジーが亢進する】
オートファジー(Autophagy)という用語はギリシャ語の「自分」(オート;auto)と「食べる」(ファジー:phagy)を組み合わせた用語で、文字通り、「自分を食べる」という意味を持ちます。
このオートファジーというのは、私たちの細胞の中で起こっている大規模な分解作用のことで、日本語では「自食作用」と訳されています。栄養が枯渇したときに、自分の細胞を分解して栄養源にしているのです。
細胞丸ごと食べてしまうようなものではなく、細胞内の一部を少しづつ分解する細胞内のリサイクルのようなものです。
例えば、私たちは食事から1日50~100グラム程度のタンパク質を食べています。
一方、私たちの体内では、1日に200グラム程度の自分のタンパク質をアミノ酸に分解し、それに相当するタンパク質を合成しています。
口から食べているタンパク質より、ずっと多い量の自分のタンパク質を食べているのです(下図)。

インスリンとアミノ酸はオートファジーを抑制します。前述のようにインスリンとアミノ酸はmTORC1を活性化し、mTORC1はオートファジーを抑制するからです。
栄養がたくさんあるとmTORC1が活性化されて、細胞の増殖が促進され、オートファジーは抑制されます。反対に、飢餓になるとTORが不活性化されてオートファジーが誘導されます。TOR阻害剤のラパマイシンは周囲の栄養状態とは無関係にオートファジーを起こします。
オートファジーが抑制されると腫瘍が発生しやすくなります。これは、細胞内に異常タンパク質や不良ミトコンドリアが蓄積することが引き金になると考えられています。また、mTORC1の活性化は酸化ストレスを高めます。つまり、インスリンやアミノ酸の過剰摂取によってmTORC1が活性化されることは、体の成長促進や筋肉増強には効果があるのですが、オートファジーの抑制や酸化ストレスの亢進によって細胞の老化とがん化を促進することになります(下図)。
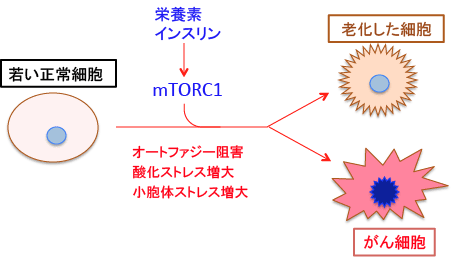
一時的飢餓あるいは軽度の飢餓はオートファジー亢進を通じて細胞内をきれいにして、細胞を若返らせる効果があり、さらにがんを予防することもできます。
カロリー制限は完全な絶食ではなく、普通の食事の60%程度のカロリーに抑えるのですが、この程度の弱い飢餓でもオートファジーが誘導されます。
しかし、60%程度にカロリーを制限することは、がん治療中は困難です。体力を低下させます。そこでカロリー制限を行わずにmTORC1を抑制する方法が有用になるのです。その方法の基本はインスリンやIGF-1の産生・分泌を抑制しPI3K/Aktシグナル伝達系を抑制することです。
線虫の研究では、カロリーを制限しなくても、カロリー摂取で応答するインスリンの信号伝達系に欠陥がある変異体は普通にエサを食べていても長生きすることが明らかになっています。
インスリンはオートファジーの抑制因子であり、インスリン信号伝達に異常があるとやはりオートファジーが亢進するのです。このようにがん予防と寿命延長とインスリンシグナル伝達系とオートファジーは密接に関連しています。この事実は「超高齢者はがんにならない(315話)」という事実の理由の一つと思われます。
サルにラパマイシンを投与するとがんや糖尿病などの様々な成人病が予防されるという報告がありあす。ラパマイシンはオートファジーを抑制します。
カロリー制限による寿命延長において、オートファジーを誘導することが部分的に貢献していることが明らかになっています。
インスリンシグナルに変異をもつ線虫は長寿命になりますが、同時にオートファジー遺伝子に変異をもつと寿命延長効果は打ち消されるという報告があります。
週1回食事を摂らず水分のみをとる、いわゆるプチ断食というのがはやっていますが、線虫の研究から、断続的なカロリー制限でも寿命延長効果があることが示されています。
【mTORC1を抑制すると寿命が延び、がんが抑制される】
以上を簡単にまとめると「mTORC1が活性化されると老化が促進されて寿命が短くなり、がん細胞の増殖が促進されて、がんによる死亡が増える」ことになります。つまり、mTORC1活性を抑制することは、がんの抑制と寿命延長に効果が期待できることになります。
近年、このmTORシグナル伝達系の仕組みが次第に明らかになり、細胞の増殖や老化に重要な役割を果たしていることが認められるようになってきました。
いろんな成長因子や栄養素(アミノ酸など)は成長過程においてはmTORC1の働きによって体が成長し成熟していく上で重要な働きを担っていますが、成熟が済むと、mTORの活性化は細胞や組織の老化を促進する作用になり、さらにがん細胞の発生や増殖や進展を促進することに加担しています。
したがって、成長を終了した後は、むやみにmTORシグナル伝達系を活性化しない方ががんの予防と長寿の達成には有利になります。
そこで、mTORC1の活性を積極的に抑える方法を実践すれば、がんの抑制と長寿を達成できる可能性があります。mTORC1の活性を阻害するラパマイシン自体に寿命延長効果と抗がん作用が示されています。
mTORC1の阻害剤はすでにがんの治療薬として使用されています。mTORC1阻害剤はある種のがんに対してある程度の効果はあるのですが、やはり効果に限界があります。mTORC1が細胞増殖の制御に重要な役割を果たしていますが、mTORC1を阻害すれば全てのがん細胞の増殖が止められるほど簡単ではありません。
細胞というのはかなり複雑なシグナル伝達系で増殖や細胞死を制御しています。そこには様々なバックアップ機構やバイパス回路やフィードバック機構などがあり、mTORC1を直接阻害しても、なんらかのバックアップ機構やバイパス回路のようなものが存在して、増殖抑制効果が弱められるからです。
例えば、mTORC1が阻害されると、フィードバックによってその上流のPI3KやAktの活性化が亢進し、何らかのバックアップ機構やバイパス回路によって、細胞の増殖や生存を維持しようとするようです。
したがって、mTORC1の活性阻害を利用してがん細胞の増殖を抑えるためには、インスリン/IGF-1の産生や、PI3K/Akt/mTORC1シグナル伝達系やそれを制御するアディポネクチンやAMPKなどにも広く作用させる必要があります。そのような観点から、以下のようながん治療法が考えられます。
食事法としては、インスリン/インスリン様成長因子-1(IGF-1)の分泌や活性を低下させる糖質制限やケトン食(高度の糖質制限+高脂肪食でケトン体を多く産生する食事)が有効です。牛乳や乳製品の摂取を減らすことは重要です。
オートファジーを亢進させるために、カロリー制限や断食を時々行うのも有効です。
アミノ酸摂取が多いとmTORC1は活性化されるので、肉類も過剰な摂取は避ける方が良いと言えます。通常推奨されている1日体重1kgあたり0.8~1.0g程度が適切です。
また、mTORC1はAMPK(AMP活性化プロテインキナーゼ)によって阻害されます。したがって、AMPKを活性化するメトホルミンは有効です(308話参照)。メトホルミン以外にも、AMPKを活性化する漢方薬も効果が期待できます(309話、311話)。
アディポネクチンはAMPKを活性化します。カロリー制限とケトン食がアディポネクチンを増やすという報告があります。ケトン食がmTORの活性化を抑制するという報告もあります。
漢方薬のオウギがアディポネクチンを増やすという報告があります。(292話)
ブロッコリーやケールやキャベツのようなアブラナ科野菜や植物に含まれるジインドリルメタンがAMPKを活性化するという報告やmTORを阻害するという報告があります。ジインドリルメタンのサプリメントは海外では多数販売されています。
また、ミルクシスルに含まれるシリマリンがmTORシグナル伝達系を阻害するという報告もあります。
IGF-1の産生を抑える方法に成長ホルモンの分泌を抑制するソマトスタチン製剤があります。実際に、ソマトスタチンががんに有効であることは多くの報告があります。しかし、極めて高価なので使いにくいのが実情です。
難治性にきびの治療薬のisotretinoinはビタミンA誘導体のレチノイドの一種ですが、IsotretinoinがIGF-1の産生を低下させてmTORC1活性を抑制し、転写因子のFOXOの活性を高めることが報告されています。Isotoretinoinは安価なので、IGF-1/PI3K/AKT系を抑える手段として、Isotoretinoinの併用は効果が期待できます。(Isotretioninは日本では認可されていませんが、外国では難治性にきびの治療に使う処方薬として使用されています)
以上をまとめると、中鎖脂肪ケトン食を行いながら、メトホルミンを1日500~1000mg服用し、ニキビ治療薬のIsotrretinoinとサプリメントのジインドリルメタン(DIM-Pro)とシリマリンを併用すると抗腫瘍効果を高めることができます。
追記:
ケトン食はアディポネクチンの産生を増やす
以下のような論文があります。
Metabolic impact of a ketogenic diet compared to a hypocaloric diet in obese children and adolescents.(肥満した小児および青年における低カロリー食と比較したケトン食の代謝に対する影響)J Pediatr Endocrinol Metab. 2012;25(7-8):697-704.
【要約】
背景:小児における代謝パラメーターに対する糖質制限食(ケトン食)の影響は十分に検討されていない。
目的:肥満している小児と青年におけるケトン食と低カロリー食の有効性と代謝に対する影響を比較する。
対象:58人の肥満者をケトン食と低カロリー食のどちらかに振り分けて6ヶ月間の食事療法を行った。
方法:食事療法の開始前と終了時(6ヶ月後)において、身体測定値(Anthropometric measurements)、身体成分(body composition)、経口ブドウ糖負荷試験(oral glucose/insulin tolerance test)、血清脂質の値(lipidemic profile)、高分子量アディポネクチン値、インスリン抵抗性を評価するwhole-body insulin sensitivity index (WBISI)と homeostatic model assessment-insulin resistance (HOMA-IR)の測定と評価を行った。
結果:低カロリー食とケトン食の両方のグループにおいて体重、体脂肪量、腹囲、空腹時インスリン値、インスリン抵抗性指数(HOMA-IR)の著明な減少あるいは低下を認めた(ケトン食はp=0.009、低カロリー食はp=0.014)。しかし、効果はケトン食の方が高かった。
両グループともインスリン感受性(WBISI)は統計的有意に上昇したが、高分子量アディポネクチンの増加を認めたのはケトン食のグループだけであった(p=0.025)。
結論:ケトン食療法は、体重の減量や代謝数値の改善において低カロリー食よりも効果が高く、肥満小児の体重減量の治療法として、安全で実施可能な食事療法であることが明らかになった。
(訳者注)
この研究で最も注目すべき点は、高分子量アディポネクチンの値が、低カロリー食では有意な上昇を認めず、ケトン食でのみ増加が認められた点です。
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのような蛋白質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。さらに、がん細胞におけるAMPKの活性化は様々な抗がん作用を発揮します。
百歳を超えるような超高齢者ではアディポネクチンの産生量が高く、これが長寿とがん発生率の低下に関与している可能性が指摘されています。がんの発生率や罹患率やがんによる死亡率は80歳代をピークにして、90歳代以降は急激に減少することが明らかになっていますが、その理由の一つとして、超高齢者では体脂肪が減少し、アディポネクチンの産生が高くなっていることが関与している可能性が指摘されています。
アディポネクチンは血中に1分子ずつバラバラにではなく、複数個がくっついた形で存在しています。低分子量(3量体)、中分子量(6量体)、高分子量(12~18量体)です。中でも高分子量アディポネクチンが生理活性が強いことが知られていますので、活性の高い高分子量のアディポネクチンの値がケトン食で増加したことは、ケトン食が寿命の延長やがんの予防に効果があることを示唆しています。
また、アディポネクチンには、がん細胞の増殖や転移の抑制など様々な抗がん作用があることが報告されています。人の胃がん細胞を移植したマウスにアディポネクチンを注射すると、がんが著しく縮小したという報告があります。
また、ラットを使った実験で、ケトン食が、脂肪組織におけるアディポネクチンmRNAの量を増やすことが報告されています(J Clin Neurosci. 2010 Jul;17(7):899-904. )
ケトン食は、がん細胞へのブドウ糖(グルコース)の供給を減らし、さらにインスリンやインスリン様成長因子の産生を減らすことによって増殖シグナルを低下させるメカニズムなどによって抗がん作用を発揮します。さらに、ケトン食が寿命延長作用と抗がん作用のある高分子量アディポネクチンの産生を増やすという臨床試験の結果は、ケトン食の抗がん作用をさらに支持することになります。
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 320)肥満とに... | 322)βヒドロキ... » |



