がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
700)アンジオテンシンII受容体拮抗薬はCOVID-19の急性肺損傷を軽減する
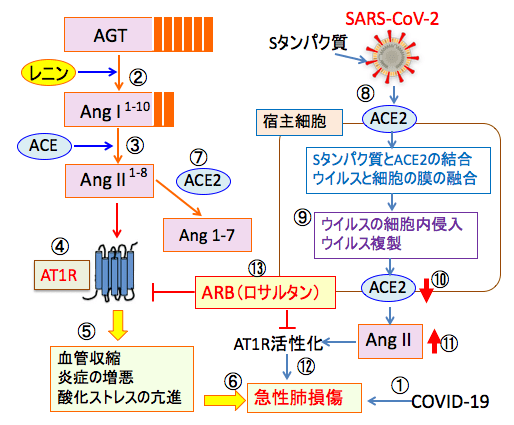
図:新型コロナウイルス(SARS-CoV-2)感染症のCOVID-19では急性肺損傷が起こる(①)。肝臓で作られるアンジオテンシノーゲン(AGT)が、腎臓から分泌されるレニンで分解されて10個のアミノ酸からなるアンジオテンシン-I(AngI)が産生され(②)、さらにアンジオテンシン変換酵素(Angiotensin Converting Enzyme: ACE)によってアンジオテンシン-II(AngII)が産生される(③)。AngIIはアンジオテンシンII受容体タイプ1(AT1R)を活性化する(④)。AT1Rは血管を収縮して血圧を上昇し、炎症を増悪させ、酸化ストレスを亢進し(⑤)、新型コロナウイルス感染症(COVID-19)で引き起こされる急性肺損傷を増悪させる(⑥)。アンジオテンシン変換酵素2(ACE2)はアンジオテンシンIIを分解して減少させることによってCOVID-19による急性肺損傷を抑制する(⑦)。新型コロナウイルス(SARS-CoV-2)は宿主細胞のACE2と結合し(⑧)、ウイルスと宿主細胞の膜を融合して細胞内に侵入し、ウイルスを複製する(⑨)。その結果、細胞のACE2は減少し(⑩)、アンジオテンシンIIの濃度が上昇して(⑪)AT1Rを活性化して急性肺損傷を増悪する(⑫)。アンジオテンシンII受容体拮抗薬(ARB)のロサルタンはAT1Rの活性を阻害する作用によって急性肺損傷を軽減する効果が報告されている(⑬)。
700)アンジオテンシンII受容体拮抗薬はCOVID-19の急性肺損傷を軽減する
【がん患者はCOVID-19に感染すると重篤化しやすい】
新型コロナウイルス(SARS-CoV-2)の感染によって発症するCOVID-19(Coronavirus Disease 2019)は、致死的な重症例から、軽症例・無症候例まで、幅広い臨床像を呈することがわかっており、重症化に関わる条件に注目が集まっています。
これまでの報告から、高血圧や心臓病や糖尿病を有する高齢者が重篤化しやすい傾向が明らかになっています。
現時点での日本の場合、発熱や倦怠感や咳などで発症しPCR検査でCOVID-19が確定された人のうち20%くらいが肺炎を発症して入院し、敗血症や多臓器不全で亡くなる人はCOVID-19確定症例の2〜3%程度と報告されています。
しかし、SARS-CoV-2に感染しても、発熱などの症状を起こさないで感染を気づかれないうちに自然に治っている人がかなり存在することも推定されています。
このような無症状で治ってしまう人がどの程度存在するかまだ十分なデータはありませんが、感染者は実際に報告されている患者数の10倍以上という意見もあり、SARS-CoV-2に感染しても致死率は0.2%以下だという報告もあります。
例えば、米国カリフォルニア州サンタクララ郡の住人3300人の血液を採取し、SARS-CoV-2に対する抗体の有無を調べた結果、実際の感染者は確認されている数を大幅に上回る50倍以上で、感染者の致死率は0.2%に満たないという結果が報告されています。
体力や免疫力が十分にあり、高血圧や心臓病や糖尿病などの持病がなければ、新型コロナウイルス感染をそれほど恐れる必要はないという意見は、ある程度正しいと思います。
問題は、体力や免疫力が低下している高齢者や、高血圧や心臓病や糖尿病などの持病を持っている人は発症すると重症化しやすいことです。
がん患者さんも、転移のある進行したがんや抗がん剤治療中の患者さんは、体力や免疫力が低下し、血栓ができやすい状態にあるため、重症化しやすいリスクを持っています。
がん患者がCOVID-19で重症化しやすいことは多くの報告があります。
AACR(American Association for Cancer Research:米国がん学会)のサイトに以下のような報告があります。
Patients with cancer appear more vulnerable to SARS-COV-2: a multi-center study during the COVID-19 outbreak(がん患者はSARS-COV-2に対してより脆弱であるように見える:COVID-19アウトブレイク中の多施設研究)Published OnlineFirst April 29, 2020
doi: 10.1158/2159-8290.CD-20-0422
https://cancerdiscovery.aacrjournals.org/content/early/2020/04/29/2159-8290.CD-20-0422
この研究には、2020年1月1日から2月24日までの間に登録された中国の武漢の14の病院の105人の「COVID-19に感染したがん患者」を解析の対象にしています。年齢と病院と入院期間をがん患者群とマッチさせた無作為に選択された「がんのないCOVID-19感染患者」536人を対照群としています。 がんの種類は肺がん(n = 22、21%)が最も多く、次に胃腸がん(n = 13、12%)、乳がん(n = 11、10%)、甲状腺がん(n = 11、10%) 、および血液腫瘍(n = 9、9%)でした。
年齢、性別、喫煙、糖尿病、高血圧、慢性閉塞性肺疾患などの併存症を補正した分析では、がんのないCOVID-19感染者に比較して、がん患者のオッズ比は、死亡が2.17 (P = .06)、重篤な症状の発症が1.99(P <.01)、集中治療室(ICU)への入院が3.13 (P < .01)、人工呼吸器の使用が2.71 (P = .04)でした。
平均入院期間はがんのない患者が17.75日に対してがん患者では27.01日と有意に長くなっていました(P < .01).
血液がんの患者は、死亡率(33%)、ICUへの入院(44%)、重度/重篤な症状(67%)、および人工呼吸器の使用(22%)の率が他の種類のがん患者よりも高い結果でした。
肺がんの患者は血液がんに次いで重篤化しやすく、死亡率(18%)、ICUへの入院(27%)、重度/重篤な症状(50%)、人工呼吸器使用(18%)という結果でした。
がんのない患者に比べて、転移性がんの患者は、死亡率(オッズ比 = 5.58、P = .01)、ICU入院(オッズ比 = 6.59、P <.01)、重篤な状態(OR = 5.97、P <.01)、および人工呼吸器の使用(オッズ比 = 55.42、P <.01)のリスクが有意に高いことが示されています。
しかし、非転移性がんの患者とがんのない患者の間に、これらの結果に有意差は見られませんでした。
肺がんまたは肺転移を伴う他のがんの患者は、がんのない患者よりも死亡、ICU入院、重大な症状、および人工呼吸器の使用(すべてP <.01)のリスクが有意に高かったが、肺転移のない他のがん患者ではがんのない患者との間に、これらの結果には有意差は認められませんでした。
がん患者105人のうち、COVID-19の症状の発症の40日以内に治療を受けた人数は、放射線療法が13人、化学療法が 17人、手術が8人、分子標的薬が4人、免疫療法が4人でした。
分子標的薬(EGFR阻害薬)または免疫療法(免疫チェックポイント阻害薬)を受けた患者は、すべて肺がんでした。免疫療法を受けた6人の患者のうち、2人が死亡し、4人が重篤な症状を示しました。
手術は転帰不良のリスクが高く、手術を受けた患者8人のうち2人が死亡、3人がICU入院、5人で重度/重篤な症状が発生し、2人が人工呼吸器を使用しました。放射線療法は有害転帰のリスク増加とは関連していませんでした。
研究者らは次のように結論付けています。「この研究の調査結果は、SARS-CoV-2に感染したがん患者は、がんのない患者と比較して、より重篤な結果をもたらす傾向があることを示唆している。血液がん、肺がん、および転移のあるがんの患者は、がんのない患者と比較して、重篤なイベントの発生率が高かった。さらに、がんの手術を受けた患者は、死亡率が高く、重篤な症状を起こすリスクが高かった」
血液がんや肺がんや肺に転移のあるがん患者ではCOVID-19に感染すると重篤化しやすいという結果です。
放射線治療は問題ないが、手術や抗がん剤や免疫チェックポイント阻害剤は重症化のリスクを高めるということです。
抗がん剤や手術がCOVID-19の重症化のリスクになることは理解できます。一方、免疫チェックポイント阻害剤による免疫療法を行っている患者は化学療法を行っている患者よりも免疫能が高い可能性がありますが、COVID-19パンデミック下の免疫チェックポイント阻害剤の投与にはいくつかの懸念が指摘されています。
一つは免疫チェックポイント阻害剤の免疫関連有害事象の1つに間質性肺炎などの肺疾患があります。他の免疫関連有害事象と比べて頻度は高くないが致命的です。
もう一つはサイトカイン放出症候群です。サイトカイン放出症候群はCAR-T細胞療法のみならずT細胞免疫療法で起こりうる免疫過活性化現象です。IL-6、IFN-γなどのサイトカインの産生により発熱、倦怠感、筋肉痛から重度の臓器毒性、肺不全、死亡などを引き起こします。
一方、COVID-19重篤化のメカニズムの1つにサイトカインストームがあり、CD4/CD8陽性T細胞の過剰な活性化などにより急性呼吸窮迫症候群(ARDS)や多臓器不全を引き起こします。
これらを考慮すると、免疫チェックポイント阻害剤治療とCOVID-19による免疫過活動の相乗効果は否定できないという懸念があるということです。免疫システムには免疫応答が過剰にならないように制御するメカニズムが存在しますが、免疫チェックポイント阻害剤はその制御を阻害する可能性があります。
つまり、免疫チェックポント阻害剤を使用しているとCOVID-19が重症化する可能性があるという指摘です。
【がん患者はCOVID-19に感染したときの準備が必要】
前述のように、高齢で、高血圧や糖尿病や心疾患やがんがあると、COVID-19は重症化しやすい傾向があります。
がんの患者さんは高齢者が多く、高血圧や心臓病や糖尿病をもっている方も多くいます。これらのリスク要因を複数あるいは全て持っているがん患者さんは日本では数十万人いると思われます。
その根拠は、現在日本にはがん治療中の患者さんが180万人以上います。このうち70%以上が65歳以上で、80歳以上は20%以上を占めています。
このような高齢者には高血圧や心臓病や糖尿病の治療を受けている方が多くいます。
厚生労働省統計情報・白書(平成26年10月)の主な疾患の総患者数(調査日現在において、継続的に医療を受けている者)のデータによると、高血圧性疾患:約1000万人、糖尿病:約320万人、高脂血症:約200万人、心疾患(高血圧性のものを除く):約170万人、悪性新生物(がん):約160万人、脳血管疾患:約120万人となっています。
これらの疾患は全て高齢者ほど罹患率が高いという特徴があります。
実際、私が診療しているがん患者さんで、高血圧や心臓病や糖尿病の薬を1種類以上服用している患者さんは半分以上いる印象です。高血圧と心臓病と糖尿病の薬を全て服用している患者さんもかなりいます。
抗がん剤治療中の患者数の統計は存在しませんが、幾つかの推計値があります。
最近の統計によると、日本では1年間に約100万人が新たにがん(悪性新生物)と診断され、がんによる死亡数は年間40万人程度です。
がん全体の5年生存率は約65%と言われています。全ての臨床病期を合わせた平均の5年生存率は、前立腺がんや乳がんや甲状腺がんは90%を超えており、胃がんや大腸がんや子宮頚がんは70%程度、食道がんや肺がんや肝臓がんは30~40%程度、胆のう・胆道がんは20%台、膵臓がんは6%程度と報告されています。
がん治療の進歩によって再発がんや手術不能の進行がんでも、5年以上にわたってがんと戦いながら生存している方が増えています。
大雑把に見積もって、1年間に見つかった約100万人の新規のがん患者のうち、約半分(50万人)は治療によって治癒し(治療に数年間かかる場合も多い)、約35%(約35万人)は5年以内に亡くなり、約15%(約15万人)はがんが存在する状態で5年以上治療を受けることになる、ということになります。
1年間に100万人ががんと診断されて治療が開始され、また何年間も治療を継続している患者さんも何十万人といるので、現在、実際にがん治療を受けているがん患者さんの数(総患者数)は150万人以上と推定されます。
実際に、厚生労働省統計情報・白書(平成29年)の主な疾患の総患者数(調査日現在において、継続的に医療を受けている者)のデータによると、悪性新生物(がん)の総患者数は約178万人です。平成26年は約160万人でしたので、3年間で20万人くらい増えています。
抗がん剤の使用率が30.1%というデータが報告されています(JMDCレセプトデータベース;平成17~21年 がん患者数8928人に基づく推計)。総患者数178万人の30%ということで、約53万人が抗がん剤治療を受けているという試算になります。
ただし、JMDCレセプトデータベースは健保組合のデータであるので、年齢分布が就業者に偏っています。つまり若い人のデータです。
抗がん剤治療の適応になりにくい高齢者を含めると、もっと低い数値になります。別の推計では、がん患者のうち抗がん剤治療を受けている割合は18%という数値が報告されています。総患者数178万人の18%だと、約32万人になります。現時点で、抗がん剤治療を受けている人が30万人以上いると考えるのが妥当です。
高齢でなく、高血圧や心臓病や糖尿病がなくても、抗がん剤治療は確実にCOVID-19の発症と重症化のリスクを高めます。
感染予防の基本は「感染源から遠ざかる」ことです。外出を控えたり、多くの人が集まるところを避けたり、マスクや手洗いなどで感染の機会を減らす方法です。
もう一つは「体力や免疫力を高めて病気に対する抵抗力を高める」ことです。
しかし、がん治療中は、治療や検査で病院に行く必要があり、感染源から避ける努力も限界があります。どんなに努力しても、抗がん剤治療は確実に体力と免疫力を低下させます。
COVID-19に関しては、まだワクチンも有効な抗ウイルス剤もありません。
肺炎の症状がでれば入院して治療を受けるしかありません。重篤化すればICUや人工呼吸器での治療になります。
米国で承認された抗ウイルス薬「レムデシビル」が、日本でも近日中に薬事承認されるようです。新型コロナウイルスには「重症の患者に効果がある」とされています。
アメリカ国立アレルギー・感染症研究所による治験結果はレムデシビル投与群は11日で回復、プラセボ投与群は15日で回復しました。死亡率はレムデシビル投与群で8%、プラセボ投与群で11.6%でした。
つまり、レムデシビルが使用できるようになっても、回復するまでの日数が4日早くなって、死亡率が70%くらいに低下する程度のようです。
したがって、COVID-19に感染しても、重症化しない、つまり肺炎まで進行しない対策を日頃から実践することが重要です。
漢方治療などで「体力や免疫力を高めて病気に対する抵抗力を高める」ことは有効です。中国ではCOVID-19の予防や治療に漢方治療を用いて、有効であることが報告されています。
COVTD-19の発症や重症化を予防する方法としてイベルメクチン(695話)、メラトニン(696話)、ジクロロ酢酸、L-カルニチン、ベザフィブラート(697話)、水素ガス吸入(698話)、ホスホジエステラーゼ5(PDE5)阻害剤(699話)について解説してきました。これらの方法はがんの補完・代替療法で使用されています。つまり、がんと新型コロナウイルス感染症の両方に効果が期待できます。
がんの標準治療に使われる手術や抗がん剤治療はCOVID-19の発症と重症化を促進します。がんの患者さんは、COVID-19に感染すると重症化しやすく、死亡率が高いことが報告されています。
降圧薬として使用されているアンジオテンシンII受容体阻害剤のロサルタンもがんの補完・代替医療やアンチエイジング(抗老化)の領域で報告の多い薬ですが、COVID-19に対する治療効果も注目されています。
【新型コロナウイルスSARS-CoV-2はアンジオテンシン変換酵素2(ACE2)に結合して細胞内に侵入する】
新型コロナウイルスSARS-CoV-2が細胞内に侵入するとき、ウイルスのスパイクの糖タンパク質と宿主細胞の細胞膜に存在するアンジオテンシン変換酵素2(ACE2)が結合する必要があります。
ACE2は肺や心臓や血管に多く発現しています。これらのACE2の発現の多い臓器はウイルスが直接感染します。
SARS-CoV-2は宿主細胞のACE2と結合し、ウイルスと宿主細胞の膜を融合して細胞内に侵入し、ウイルスを複製します。その結果、細胞のACE2は減少します。
アンジオテンシンII は炎症を促進し、急性肺損傷を悪化させる作用があります。
ACE2はアンジオテンシンIIを分解して急性肺損傷を軽減する効果があります。
つまり、SARS-CoV-2感染ではACE2の減少が肺や心臓や血管の病変を増悪に関連していることが指摘されています。

図:新型コロナウイルス(SARS-COV-2)のスパイク(S)の糖タンパク質(S glycoprotein)と宿主細胞の細胞膜に存在するアンジオテンシン変換酵素2(ACE2)が結合して(①)、両方の細胞膜が融合してRNAが宿主細胞に侵入し(②)、ウイルスを複製する(③)。ACE2は肺や心臓や血管に多く発現しているので、これらの組織にウイルスの感染が起こりやすい。SARS-CoV-2感染によって急性肺損傷が起こる(④)。ウイルス感染によって細胞のACE2は減少し(⑤)、アンジオテンシンIIの分解が減少する(⑥)。アンジオテンシン変換酵素(angiotensin converting enzyme:ACE)によってアンジオテンシン-II(AngII)が産生される(⑦)。その結果、AngIIの濃度が上昇し(⑧)、アンジオテンシンII受容体タイプ1(AT1R)を活性化する(⑨)。AT1Rは血管を収縮して血圧を上昇し、炎症を増悪させ、酸化ストレスを亢進して(⑩)急性肺損傷を増悪させる(⑪)。したがって、AT1Rの活性を阻害することは急性肺損傷を軽減する効果がある。
このように、ウイルスがACE2に結合することが、コロナウイルス感染症の重症化のメカニズムとも関連しています。
したがって、COVID-19の重症化のメカニズムを理解するためには、アンジオテンシン変換酵素2(ACE2)の働きや分布に関する知識が必要になります。
【レニン・アンジオテンシン系は体液の保持と恒常性を制御している】
生物は体液(体内の水分や血液)を保持しその恒常性を維持する必要があります。
海水に発生した生物が、塩分の少ない淡水で生きられるように進化し、さらに陸に上がって生活する過程で、体の中に水分を保持するメカニズムが必要になってきます。
体内の水分が少なくなれば口渇を感じて水分を摂取し、脱水になれば尿の量を減らすようにホルモンが作用します。
出血して血液を失えば、血管が収縮して血圧を維持します。
このような、体内にナトリウムや水分を保持したり、尿量や血圧を調節する体内の制御システムの中心になっているのが、レニン・アンジオテンシン・アルドステロン系です。
外傷によって血液が失われると、交感神経系が刺激されて、レニン、アンジオテンシン、アルドステロン、カテコラミン、ナトリウム利尿ペプチドが分泌され、体液が減少した状況で血圧を維持しようと働きます。
このようなメカニズムが進化しなければ、生き物は海の中から陸に上がって生存はできません。また、外傷による失血で簡単にショック状態になり、生存に不利になります。
レニン・アンジオテンシン・システム(renin-angiotensin system : RAS)は、血管収縮や血圧の制御、ナトリウム保持とカリウム排出の制御を行っています。
レニンの発見は約120年前(1898年)です。腎臓皮質の抽出物の中に血圧を上昇させる物質として発見されています。
1934年には、犬の腎臓の動脈を機械的に閉塞すると慢性の高血圧が発生することが示されています。
腎臓の動脈が閉塞して腎臓に血液が来なくなると、血流を維持するために腎臓は血圧を上昇させる物質を産生するというメカニズムです。
このような研究から、腎臓から分泌されるレニンが、急速で短時間作用性の血圧上昇物質であるアンジオテンシンを産生する機序が解明されています。
レニンは血管拡張因子のブラジキニンを分解して不活性化する作用もあります。つまり、レニンは血管収縮の方向に向かわせます。
血圧や血中ナトリウム量が低下すると、肝臓でアンジオテンシノーゲンが産生されて血中に放出され、腎臓から分泌されるされたんぱく質分解酵素のレニンで分解されて10個のアミノ酸からなるアンジオテンシン-I(AngI)が産生されます。
さらにアンジオテンシン変換酵素(angiotensin converting enzyme : ACE)によってアンジオテンシン-II(AngII)が産生されます。アンジオテンシン変換酵素(ACE)は主に肺の血管内皮細胞に発現しています。
AngIは不活性な前駆体で、AngIIが活性体です。
AngIIは受容体のタイプ1(AT1R)とタイプ2(AT2R)に結合して、それぞれの受容体を活性化して作用を発揮します。
AngIからAngIIへの変換はACEの他にChymaseという酵素によっても起こります。Chymaseは心臓の肥満細胞(mast cell)、血管内皮細胞、間葉系の間質細胞、腎臓のメサンギウム細胞や血管内皮細胞などで産生されます。Chymaseは心臓や血管や腎臓において、特に病的状態でのAngIIの産生が関与しています。
AngIIはACE2によってAng1-7に変換される経路もあります。ACE2はcarboxypeptidaseで、AngIIのC末端のアミノ酸を1個除去してアミノ酸7個のポリペプチド(Ang1-7)を産生します。Ang1-7はMas受容体に結合し、アンジオテンシンIIの作用に拮抗するように、血管拡張や臓器保護的に作用します。
つまり、ACE2は臓器を保護する作用があります。
ACEとACE2の活性のバランスでAngIIの量が制御されます。
AngIIはさらに他のプロテアーゼで分解され、Ang(2-8)[AngIII]、Ang(3-8)[AngIV]が産生されます。
AngIIIはAngIIと同様の作用を示しますが、弱い活性です。AngIVは腎臓や脳の血流を増やして、組織を保護する作用があります。
このように、活性型のAngII以外に、それから派生した物質も様々な作用を示すことによって、レニン・アンジオテンシン系全体が複雑に制御されています。(下図)

図:肝臓で作られるアンジオテンシノーゲン(AGT)が、腎臓から分泌されるされるたんぱく分解酵素のレニンで分解されて10個のアミノ酸からなるアンジオテンシン-I(AngI)が産生され、さらにアンジオテンシン変換酵素(angiotensin converting enzyme:ACE)によって8個のアミノ酸からなるアンジオテンシン-II(AngII)が産生される。AngIIの産生は主に血管系組織で起こる。AngIからAngIIへの変換はACEの他にChymaseという酵素によっても起こる。AngIIはACE2によってAng1-7に変換される経路や、AngIIがさらに他のプロテアーゼで分解され、AngIII [Ang(2-8)]、AngIV[Ang(3-8)]が産生される。(参考:EMBO Mol Med. 2; 247-257, 2010)
【アンジオテンシンIIは受容体を介して作用を発揮する】
アンジオテンシンIIは薬理学的に作用が異なる2種類の受容体に結合して作用します。
タイプ1受容体(AT1R)とタイプ2受容体(AT2R)の2種類です。この2つの受容体は7回膜貫通型のGタンパク質共役型受容体です。
AT1Rは腎臓、心臓、脳、副腎、血管平滑筋、肝臓などで発現しています。
AT1RとAT2Rは循環系や腎臓において逆に作用して制御しています。
血液中を循環しているAngIIは血圧を上昇させたり、副腎皮質からアルドステロンの分泌を促進し、腎臓の尿管上皮細胞に作用してナトリウムと水分を保持する働き(全身作用)があります。さらにAngIIは炎症を増悪させ、組織傷害を促進する局所作用があります。これはタイプ1受容体(AT1R)を介した作用です。
一方、AT2Rは血管を拡張する作用や、心血管系を傷害から保護する作用や、腎臓の線維化を抑制する作用、炎症を抑制する作用、細胞増殖を抑制する作用があります。(下図)

図:肝臓で作られるアンジオテンシノーゲン(AGT)が、腎臓から分泌されるされるレニンで分解されて10個のアミノ酸からなるアンジオテンシン-I(AngI)が産生され、さらにアンジオテンシン変換酵素(angiotensin converting enzyme:ACE)によってアンジオテンシン-II(AngII)が産生される。AngIIは2種類の7回膜貫通型のGタンパク質共役型受容体を介して作用を発揮する。タイプ1(AT1R)は血管を収縮して血圧を上昇し、腎臓の尿管上皮細胞に作用してナトリウムと水分を保持する働きがある。さらにAT1Rは炎症を増悪させ、酸化ストレスを亢進し、線維化を亢進する。一方、AT2Rは血管を拡張し、心血管系を傷害から保護する作用や、腎臓の線維化を抑制する作用、炎症を抑制する作用、細胞増殖を抑制する作用がある。(参考:EMBO Mol Med. 2; 247-257, 2010)
【アンジオテンシンIIは慢性炎症や発がんに関与している】
レニン・アンジオテンシン・システムの研究領域において、この20年間での進歩は、このシステムが組織局所や細胞内でも存在することが発見されたことです。
この局所におけるレニン・アンジオテンシン・システムの存在は、心臓、腎臓、脳、膵臓、生殖系、リンパ管系、脂肪組織などで確認されています。
このような組織や細胞内でのレニン・アンジオテンシン・システムの存在は、AngIIの全身循環系に対する作用の他に、炎症や細胞増殖や線維化にも関与することが明らかになっています。
AngIIは活性酸素の産生を増やし、細胞増殖や細胞死、細胞の移動や分化、細胞外基質の再構築などに関連し、遺伝子発現に影響し、細胞内の様々なシグナル伝達系に作用し、組織や細胞の傷害を促進する方向で作用しています。
腎臓や心臓や血管系においては、AngIIは炎症性サイトカインの遺伝子発現を促進し、組織に炎症細胞を集積させ、炎症反応を亢進します。
高血圧においては、AngIIは腎臓におけるアンジオテンシノーゲンを誘導して、腎臓だけでAngIIを産生できるようになります。
AngIIはサイトカインやケモカインの産生を誘導し、炎症細胞を炎症が起こっている局所に集める作用があります。
炎症は血管の内皮細胞を活性化して、血管内皮由来の因子によって血管の透過性が亢進し、炎症局所において白血球が集積してきます。
AngIIは血管内皮増殖因子(VEGF)の産生を増やし、血管の透過性を亢進します。
セレクチン、VCAM-1(vascular cell adhesion molecule-1)、ICAM-1(intercellular adhesion molecule-1)などの血管内皮の接着因子の受容体の発現も亢進します。
AngIIはCOX-2を活性化してプロスタグランジンや活性酸素の産生を増やす作用もあります。
これらの作用はアンジオテンシンIIがCOVID-19における急性肺損傷を増悪させる可能性を示唆しています。
さらに、AngIIは炎症反応を増悪させるので、自己免疫疾患の発症に関与しています。
AngIIはT細胞機能に影響するTh1/Th17介在性の多発性硬化症の発症に関与することが報告されています。
AngIIはAT1受容体を介して、Th1とTh17サイトカイン(特にIFN-γとIL-17)の産生を亢進します。
ACE阻害剤やアンジオテンシン受容体阻害剤を用いてレニン・アンジオテンシン・システムを阻害すると、Th1とTh17サイトカインの産生を阻止し、抗原特異的制御性T細胞を誘導して、自己免疫疾患を抑制します。
脳組織のレニン・アンジオテンシン・システムが認知機能に影響することが指摘されています。
脳のレニン・アンジオテンシン系の活性化がアルツハイマー病の発症に関与しています。
アルツハイマー病の脳組織ではレニン・アンジオテンシン・システムの活性が亢進し、レニン・アンジオテンシン・システムの阻害は、アルツハイマー病の認知機能を改善します。
血液脳関門を通過できるACE阻害剤(perindopril, captopril)は認知機能を改善することが報告されています。
819,491人のコホート研究では、アンジオテンシンII 阻害治療(ACE阻害剤かタイプ1AngII受容体阻害剤)を受けている人は認知機能が改善することが明らかになっています。
ACE阻害剤とタイプ1AngII受容体阻害剤の併用は認知機能の改善において相加効果が示されています。(ただし、この2つの薬剤の併用は、低血圧や高カリウム血症や腎臓障害を引き起こすリスクを高めるので、副作用を引き起こさない量の摂取が重要です。)
これらの薬がパーキンソン病の改善に有効であることも報告されています。
アンジオテンシンIIの阻害が活性酸素の産生を減らして、虚血性脳傷害を軽減することが報告されています。AngIIはAT1受容体を介してNAD(P)Hオキシダーゼを活性化し、活性酸素の産生を増やし、組織の酸化傷害を増やし、組織や臓器の老化を促進します。その結果、加齢関連の慢性疾患の発症を促進します。
【アンジオテンシンII受容体拮抗薬は寿命を延ばす】
以下のような論文があります。
Angiotensin Converting Enzyme (ACE) Inhibitor Extends Caenorhabditis elegans Life Span(アンジオテンシン変換酵素阻害剤は線虫の寿命を延ばす)PLoS Genet. 2016 Feb 26;12(2):e1005866. doi: 10.1371/journal.pgen.1005866. eCollection 2016.
カエノラブディティス・エレガンス (Caenorhabditis elegans) は線虫の1種で、生物学の実験に良く使われます。加齢や寿命の研究にも使われています。インスリン・シグナル伝達系が働かないと寿命が延長するという事実も、この線虫の変異体を解析して得られています。
この論文では、FDA(米国食品医薬品局)が認可している医薬品を、線虫の寿命を延ばすかどうかでスクリーニングしています。
その結果、アンジオテンシン変換酵素(ACE)阻害剤のカプトプリル(captopril)を投与すると線虫の寿命が顕著で延びることが発見されました。そこで、アンジオテンシン変換酵素(ACE)の遺伝子が変異してACE活性が低下している変異体を解析すると、ACE活性が低下すると寿命が延びることが示されました。
アンジオテンシン変換酵素(ACE)の遺伝子が変異している線虫では、カプトプリルによる寿命延長効果は認められませんでした。
その結果、アンジオテンシン変換酵素(ACE)を阻害する薬は、加齢関連疾患の発生や進展を抑制し、寿命を延ばすことができるという結論です。
アンジオテンシンIIタイプ1受容体(AT1R)の阻害はマウスの寿命を延ばす作用が報告されています。
ある実験では、29ヶ月齢で通常のマウスは全例死亡しましたが、この受容体を欠損したマウスでは85%が生きていました。
アンジオテンシンIIタイプ1受容体(AT1R)の欠損したマウスは通常のマウスより寿命が7ヶ月(26%)延長しました。
つまり、AT1受容体を欠損するマウスは寿命が延長するということです。
高血圧のラットにアンジオテンシンII変換酵素(ACE)阻害剤やアンジオテンシンII受容体阻害剤でアンジオテンシンIIの活性を阻害すると、寿命が2倍になるという実験結果も報告されています。
ACE阻害剤とアンジオテンシンII受容体タイプ1(AT1R)阻害剤は、活性酸素の産生を減らして酸化傷害を軽減し、生存を延ばす遺伝子の発現を亢進し、寿命を延ばすことが示されています。
このように、組織局所におけるレニン・アンジオテンシン系が、炎症や老化やがんにも関与することが明らかになり、レニン・アンジオテンシン系の抑制や阻害が抗老化作用や抗がん作用を示すことが明らかになってきました。
アンジオテンシンII(AngII)がその受容体(特にAT1R)に結合するとミトコンドリアの機能異常を促進し、細胞内の活性酸素の発生量と増やし、細胞や組織のダメージを促進します。
ラットを使った実験では、AngIIシグナル系を阻害すると神経変性を抑制し、寿命を延ばすことが明らかになっています。
レニン・アンジオテンシン系は慢性炎症性疾患や自己免疫疾患、老化関連の組織傷害、悪性腫瘍の治療のターゲットになっています。加齢関連疾患や慢性炎症性疾患やがんを予防して健康寿命を延ばすという観点から、レニン・アンジオテンシン系を抑制する薬は有用だと言えます。

図:肝臓で作られるアンジオテンシノーゲン(AGT)が、腎臓から分泌されるされるレニンで分解されて10個のアミノ酸からなるアンジオテンシン-I(AngI)が産生され、さらにアンジオテンシン変換酵素(angiotensin converting enzyme:ACE)によってアンジオテンシン-II(AngII)が産生される。AngIIは2種類の7回膜貫通型のGタンパク質共役型受容体を介して作用を発揮する。タイプ1(AT1R)は血管を収縮して血圧を上昇し、アルドステロンの分泌を促進し、ナトリウムと水分を保持する働きがある(全身作用)。さらにAT1Rは組織局所において、活性酸素の産生を増やして酸化ストレスを亢進し、炎症を増悪し、mTORC1活性を亢進する。その結果、老化を促進し、がんを含めた様々な加齢関連疾患の発症と進展を促進し、寿命を短縮する方向で作用する。ACEやAT1Rの働きを阻害する薬が高血圧や心臓疾患の治療に用いられており、抗がん作用や寿命延長作用が注目されている。
アンジオテンシンIIは血圧制御やナトリウムと水分の保持といった全身作用の他に、局所において、活性酸素の産生を増やし、炎症を増悪させ、mTOR経路を活性化する作用が知られています。その結果、哺乳動物における老化と加齢関連疾患の発生と進展を促進します。
多くの動物実験で、アンジオテンシンIIの阻害剤はがん予防と寿命延長の効果が示されています。
レニン・アンジオテンシン系を阻害する医薬品としてアンジオテンシン変換酵素(ACE)の活性を阻害するACE阻害剤(一般に'-prils'という名称がつく)とアンジオテンシンII 受容体タイプ1(AT1R)を阻害するアンジオテンシン受容体拮抗薬(一般に'-sartans'という名称がつく)が数多く販売され、高血圧や心疾患の治療薬として使用されています。
新型コロナウイルスの治療においては、ACE阻害剤やアンジオテンシンII 受容体タイプ1(AT1R)阻害剤がACE2の発現を亢進して、SARS-CoV-2感染を増悪する可能性が指摘され、これらの降圧剤の使用に対して懸念する意見が発表されました。
しかし、現在では、COVID-19において、CE阻害剤やアンジオテンシンII 受容体拮抗薬はアンジオテンシンの炎症増悪作用を抑制することによって、むしろ治療効果の方が高いという意見が主流になっています。
【アンジオテンシンII受容体阻害剤はSARS-CoV-2の治療薬として有効】
以下のような報告があります。
Angiotensin receptor blockers as tentative SARS‐CoV‐2 therapeutics(暫定的なSARS-CoV-2治療薬としてのアンジオテンシン受容体遮断薬)
Drug Dev Res. 2020 Mar 4. doi: 10.1002/ddr.21656.
【論文内容の抜粋】
COVID-19の最終的な解決策は、明らかにSARS-CoV-2ワクチンの開発である。しかし、ウイルスにコードされたペプチドに基づくワクチンは、ウイルス変異がそれらを無効にする可能性があるため、将来のコロナウイルスの流行に対して有効ではない可能性がある。実際、新しいインフルエンザウイルス株が毎年出現し、新しい予防接種が必要である。
コロナウイルス変異に耐えられる治療法の候補としてロサルタンなどの利用可能なアンジオテンシン受容体1(AT1R)遮断薬を使用することを提案する。
この考えは、アンギオテンシン変換酵素2(ACE2)がSARS-CoV-2のスパイクタンパク質の結合部位として機能しているという事実に基づいている。
最近の仮説では、アンジオテンシン受容体1(AT1R)遮断薬は、肺炎を発症したCOVID-19感染患者に有益である可能性があることが示唆されている。
アンジオテンシン変換酵素(ACE)とその類似ホモログACE2は、どちらもジペプチジルカルボキシジペプチダーゼのACEファミリーに属しているが、2つの相反する生理学的機能を果たす。
ACEは、アンジオテンシンIを切断してアンジオテンシンIIを生成する。アンジオテンシンIIは、AT1Rに結合してこれを活性化し、血管を収縮させて、血圧を上昇させる。
ACE2はアンジオテンシンIIを不活性化する一方で、アンジオテンシン1–7を生成する。これは、Mas受容体の活性化を介して強力な血管拡張機能を持ち、レニン-アンジオテンシン系の負の調節因子として機能する。
AT1R拮抗薬のロサルタンとオルメサルタンは、高血圧患者の血圧を下げるために一般的に適用され、ラットの冠動脈結紮によって誘発された心筋梗塞後の慢性治療後(28日)に、心臓ACE2発現を約3倍増加させることが示された
ロサルタンはまたラットにおいて腎ACE2発現を亢進することも示された。これらの観察と一致して、AT1R拮抗薬オルメサルタンで治療された高血圧患者では、より高い尿中ACE2レベルが観察された。
まとめると、これらの観察結果は、慢性のAT1R遮断がラットとヒトの両方でACE2の発現を増やすことを示唆している。
ACE2は2002-2003年のSARS流行のSARS-CoVと、おそらく現在のCOVID-19流行の根底にあるSARS-CoV-2株の両方の共通の結合部位である。
したがって、ACE2発現を増加させるためにSARS患者をAT1R拮抗薬で治療するという提案は、ウイルスの感染を増やす可能性が危惧される。ただし、SARS-CoV-2と類似性の高いSARS-CoVに関する研究からのいくつかの観察は、そうでないことを示唆している。
細胞結合部位であるACE2へのコロナウイルススパイクタンパク質の結合がACE2のダウンレギュレーション(発現低下)を引き起こし、アンジオテンシン変換酵素(ACE)によるアンジオテンシンIIの過剰な生成をもたらす。アンジオテンシンIIにより活性化されたアンジオテンシン受容体I型(AT1R)は肺血管透過性の増加をもたらし、それにより肺病変を増悪させる。
一方で、ACE2はアンジオテンシン1–7(Ang1-7)を産生し、血管を拡張し、炎症を抑制する。
したがって、AT1Rブロッカーを慢性的に服用した後のACE2発現が高まことは、SARSを発症するリスク(コロナウイルスに感染するリスク)が高くなるのではなく、急性肺損傷から保護する可能性がある。
これは、ウイルス感染によって引き起こされる過剰なアンジオテンシンII媒介性のAT1R活性化の阻害とACE2の発現亢進の2つのメカニズムによって説明される。
つまり、ACEによるアンジオテンシン産生を減少させ、血管拡張作用のあるアンジオテンシン1-7(Ang1-7)の産生を増加させる。
AT1R遮断薬をSARS治療薬として適用するという提案は、ウイルス結合部位のACE2の発現を増やすとしても、有害とは思われない。
ロサルタン、テルミサルタン、オルメサルタンなどのAT1R拮抗薬は、1990年代以来高血圧症および腎障害の治療のために広く適用されており、有害薬物事象にめったに経験しない安全な薬物として知られている。
ただし、SARS-CoV患者の約半分は入院中に低血圧を発症したことに注意する必要がある。この解説を書いている時点では、入院中のSARS-CoV-2患者の低血圧率に関する包括的な情報はない。したがって、現在進行中の流行のSARS患者の何パーセントが低血圧のリスクなしにAT1Rブロッカーで安全に治療できるかを推定するのは時期尚早である。
ロサルタンやテルミサルタンなどのAT1R拮抗薬をSARS-CoV-2治療薬として急性呼吸器症候群の発症前に使用するという暫定的な提案は、臨床試験でまだ証明されていない。
したがって、その実現可能性を評価するための最も迅速なアプローチは、患者の記録を分析し、診断前にAT1R拮抗薬を処方された患者(高血圧、糖尿病性腎疾患、またはその他の適応症の治療)の方が優れていたかどうかを判断することである。
さらに、一般集団におけるAT1Rブロッカーを慢性的に服用している人の割合と、重篤な症状を示すSARS-CoV-2感染患者のAT1Rブロッカーの服用率と比較する必要がある。後者のパーセンテージが大幅に小さいことがわかった場合、これは、AT1RアンタゴニストがSARS-CoV-2感染者に重篤な症状からの保護を与えるという考えを支持することになる。
理論的にはアンジオテンシンII受容体の阻害がCOVID-19の急性肺損傷の軽減に役立つと考えられるので、アンジオテンシン受容体拮抗薬やACE阻害剤を服用している患者の割合を、一般集団と重症化して入院しているCOVID-19患者の集団で比較すれば、アンジオテンシン受容体遮断薬がCOVID-19の治療に役立つかどうか分かるという提案です。
そこで、以下のような研究報告があります。
Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. (COVID-19で入院した高血圧患者の死亡率と入院中のアンジオテンシン変換酵素阻害剤およびアンジオテンシンII受容体遮断薬の使用の関連)Circ Res. 2020 Apr 17. doi: 10.1161/CIRCRESAHA.120.317134. [PubMed]
【要旨】
理論的根拠:アンジオテンシン変換酵素阻害剤(ACEI)およびアンジオテンシンII受容体遮断薬(ARB)の使用は、高血圧患者のコロナウイルス疾患2019(COVID-19)を治療する臨床医にとって大きな懸念事項である。
目的:高血圧のCOVID-19患者におけるACEI / ARBの院内使用と全死因死亡との関連を決定すること。
方法と結果:このレトロスペクティブな多施設研究には、2019年12月31日から2020年2月20日まで中国の湖北省にある9つの病院に入院した高血圧を有するCOVID-19患者で、ACEI / ARBを使用しない高血圧患者940人(ACEI / ARB非使用のグループ、年齢の中央値64歳、男性53.5%) とACEI / ARBを使用している高血圧患者188人(ACEI / ARBグループ、年齢中央値64歳、男性53.2%)を比較した。
未調整の死亡率は、ACEI / ARBグループはACEI / ARB非使用のグループより低かった(3.7%対9.8%、P = 0.01)。
年齢、性別、併存症、および院内投薬を調整した後、全原因死亡リスクは、ACEI / ARBグループはACEI / ARB非使用グループと比較して低かった(調整後ハザード比=0.42、95%信頼区間;0.19-0.92、P = 0.03)。
さらにサブグループ傾向スコア一致分析は、他の降圧薬の使用と比較して、ACEI / ARB使用グループはCOVID-19による死亡率の低下(調整ハザード比=0.30; 95%信頼区間;0.12-0.70; P = 0.01)とも関連していた。
結論:高血圧のCOVID-19入院患者の中で、ACEI / ARBの使用は、ACEI / ARB非使用者と比較して、全死因死亡のリスクの低下を認めた。 研究の解釈は他の交絡因子の可能性を考慮する必要があるが、病院内でのACEI / ARBの使用が死亡リスクの増加と関連しているとは考えられない。
ACE阻害剤やアンジオテンシンII受容体遮断薬がACE2の発現を増やして、SARS-CoV-2の感染を増やすのではないかという意見に対して、レトロスペクティブに行われた研究で、ACEI / ARBの使用が死亡リスクの増加とは関係しない、むしろACEI / ARBの使用が死亡リスクを低下させる可能性を示唆しています。
つまり、高血圧の患者さんは、アンジオテンシンII受容体遮断薬のロサルタンを服用しているとCOVID-19に感染しても、重症化するリスクを低下できるということです。
高血圧はCOVID-19の重症化のリスクを高めることが多くの研究で示されています。
まだ検討の余地はあり、断定はできませんが、現時点でのエビデンスは、高血圧患者がロサルタンなどのアンジオテンシンII受容体遮断薬を服用することはCOVID-19の重症化のリスクを減らす可能性が高いと言えます。
また、ロサルタンは抗がん剤治療の高めたり、再発を予防する効果など様々な抗腫瘍効果が報告されています(654話参照)。つまり、アンジオテンシン受容体遮断薬はがんとCOVID-19の両方に効果が期待でき、抗老化作用や寿命延長作用も報告されているので、高血圧の人は積極的に使用して良いように思います。
| « 699) 新型コロ... | 701)糖尿病治... » |



