がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
591)シスプラチン耐性を阻止する酸化治療
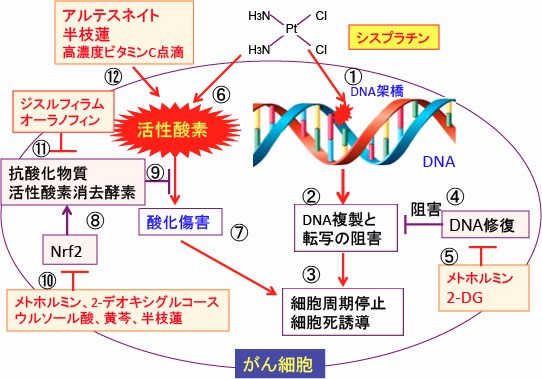
図:シスプラチンはDNA鎖に結合してDNA架橋(クロスリンク)を形成し(①)、DNA複製と転写を阻害し(②)、細胞周期を停止し、細胞死を誘導する(③)。がん細胞はDNA修復能を高めてシスプラチン抵抗性になる(④)。DNA修復はエネルギーを消費するので、解糖系を阻害する2-デオキシグルコース(2-DG)とミトコンドリアの呼吸酵素を阻害するメトホルミンはATP産生を抑制することによってDNA修復を阻止する(⑤)。シスプラチンは活性酸素の産生を亢進し(⑥)、酸化傷害によって細胞の増殖を抑制し細胞死を誘導する(⑦)。酸化ストレスを軽減するためにがん細胞は転写因子のNrf2の活性を亢進し(⑧)、グルタチオンやチオレドキシンシステムを亢進して活性酸素による酸化傷害に抵抗する(⑨)。メトホルミンや2-デオキシグルコースやウルソール酸や黄芩や半枝蓮はNrf2の活性化を阻害する(⑩)。ジスルフィラムやオーラノフィンはグルタチオンやチオレドキシンによる抗酸化システムを阻害することによって酸化ストレスを高める(⑪)。アルテスネイト、半枝蓮、高濃度ビタミンC点滴は細胞内の活性酸素の産生を高める(⑫)。これらを組み合せると、がん細胞に効率的に酸化ストレスを増強して、シスプラチンの抗腫瘍効果を増強でき、シスプラチン耐性を阻止できる。
591)シスプラチン耐性を阻止する酸化治療
【抗がん剤を投与するとその抗がん剤に耐性の細胞が生き残る】
がん組織内の個々のがん細胞は、遺伝子変異のパターンや増殖速度や薬剤耐性の程度などにおいて極めて不均一なクローンが混在しています。クローンというのは、細胞分裂を繰り返すことによって生ずる同一の遺伝子構成を持つ細胞群です。
このような不均一な細胞集団において、生存において有利な性質をもった細胞が生き残ってクローンを増やして行くというダーウィンの進化論と同様な自然選択(natural selection)が起こっています。
抗がん剤治療を行うと、抗がん剤に感受性が高い細胞群(クローン)は死滅していき、抗がん剤に抵抗性を持った「死ににくい」細胞クローンが生き残るという選択圧が加わります。
さらに、環境の変化に適応するように進化する「進化的適応(Evolutionary adaptation)」と同様なことが起こります。つまり、新たな遺伝子変異の発生によって抗がん剤に耐性の性質を獲得するようになり、そのような形質を獲得したがん細胞が選択されて増えていきます。
最大耐用量の抗がん剤を投与すると、その抗がん剤に感受性のあるがん細胞は死滅し、抗がん剤に抵抗性のあるがん細胞は生き残ります。そして、抗がん剤耐性のがん細胞が増えていきます。
高用量の抗がん剤投与によって最初は腫瘍の増大を抑えても、次第に抗がん剤に抵抗性のがん細胞が増えて、抗がん剤でがんの増大を抑えることができなくなります。
例えば白金製剤のシスプラチンは多くのがんの治療に使われています。
最初は良く効いてがんが縮小しますが、抗がん剤治療を継続していると次第にシスプラチンに抵抗性のがん細胞が増えていきます。
抗がん剤を始める前から、そのがん組織にはシスプラチンに感受性の細胞と抵抗性の細胞が存在し、シスプラチンの投与によって、シスプラチン感受性のがん細胞が死滅し、シスプラチン抵抗性のがん細胞が生き残り、次第にシスプラチン抵抗性のがん細胞が増えるために、次第に抗がん剤が効かなくなります。
シスプラチン投与がシスプラチン耐性がん細胞を増やすというのはダーウィンの進化論と同じです。シスプラチンで死滅するがん細胞集団(クローン)は自然淘汰されて子孫を残さずに滅び、シスプラチンに抵抗性のがん細胞集団だけが選択的に生き残ります。(下図参照)

図:抗がん剤治療前のがん組織のがん細胞は薬剤耐性の程度において不均一で、薬剤耐性の低いがん細胞や高いがん細胞が混在している(①)。抗がん剤のシスプラチン投与を行うと、シスプラチンに感受性のがん細胞は死滅するが、耐性のがん細胞は生き残る(②)。生き残ったがん細胞は増殖してがんは再発する(③)。さらにシスプラチンを投与しても、がん細胞は死滅せずにさらにシスプラチン耐性細胞の比率は増し、がん組織は増大する(④)。
【抗がん剤耐性になるにはエネルギーが必要】
抗がん剤を使い続けていると、いつか効かなくなるときが来ます。がん細胞がその抗がん剤に耐性を獲得するためです。
例えば肺腺がんで分子標的薬のチロシンキナーゼ阻害剤(イレッサ、タルセバなど)が効いても、多くは10から14ヶ月程度で効かなくなります。
通常の殺細胞作用を持った抗がん剤治療も、数ヶ月から1年もすれば効かなくなってきます。
がん細胞が抗がん剤でダメージを受けると、いろんなメカニズムを使って生き残る手段を獲得してきます。
治療前からがん組織の中に耐性細胞が存在する内因性(intrinsic)の原因だけでなく、抗がん剤治療が薬剤耐性の性質を亢進する獲得性(acquired)の抗がん剤耐性もあります。
抗がん剤を細胞の外に排出するポンプの作用を持つ蛋白質の合成を増加させたり、抗がん剤を不活化させる物質や薬の目標になる蛋白質を増産させて薬剤の作用を妨害します。抗がん剤の攻撃目標がDNAであれば、DNA修復を促進することにより細胞死を阻止しようとします。
多くの抗がん剤は細胞にダメージを与えて細胞死(アポトーシス)を引き起こすことによって効果を発揮します。細胞には自ら細胞死を実行するプログラムが内在しており、細胞が傷付くとこのプログラムによって死にます。この細胞死をアポトーシスといいます。がん細胞はいろんな機序によってアポトーシスに対する抵抗性を獲得していきます。細胞死が起きにくくなるというアポト−シス耐性の獲得も抗がん剤耐性の重要なメカニズムです(下図)。

図:がん細胞は様々なメカニズムで抗がん剤の効き目を弱めている。例えば、抗がん剤の分解や代謝による不活性化の促進(①)、排出ポンプを増やして抗がん剤を細胞外への排出の促進(②)、抗がん剤のターゲット分子の増産(③)、アポトーシスに抵抗性になるBcl-2サブファミリーのタンパク質を増やしたり、アポトーシスを誘導するBaxサブファミリーの活性を抑制して細胞死に対する抵抗性の獲得(④)、ダメージを受けたDNAなど細胞成分の修復の促進(⑤)など多くのメカニズムが知られている。
一般に、抗がん剤抵抗性のがん細胞は増殖が遅いことが知られています。抗がん剤に抵抗性の機序を働かせるのに余分なエネルギーと物質合成が必要だからです。
抗酸化力を高めることによって抗がん剤抵抗性になりますが、この抗酸化システムを高めるには余分なエネルギー(ATP)消費と物質合成(グルタチオンや抗酸化酵素などの産生)が必要です。
したがって、抗がん剤感受性を高める方法の第一は、がん細胞のエネルギー産生を低下させることです。
がん細胞は解糖系の代謝が亢進しています。解糖系を阻害する2-デオキシ-D-グルコースとクエン酸療法、ミトコンドリアのATP産生を阻害するメトホルミンの併用はがん細胞のエネルギー産生を阻止して、抗がん剤治療や放射線治療の効き目を高めます。
【シスプラチンはがん細胞の酸化ストレスを高める】
シスプラチン(cisplatin : CDDP)は白金錯体に分類される抗がん剤で、多くの種類のがんの治療薬として使用されています。
シスプラチンは、DNAの構成塩基であるグアニンとアデニンに結合します。2つの塩素原子部位でDNAと結合するため、DNA鎖内には架橋(クロスリンク)が形成され、その結果、DNAの複製を阻害したり、mRNAの転写を阻害して、細胞にダメージを与え、死滅させます。がん細胞だけでなく、細胞分裂している正常細胞の分裂も阻害するため、副作用も非常に強い薬です(下図)。

図:シスプラチンの2つの塩素(Cl)原子が、DNAの塩基の水酸基に結合し、DNA鎖内に架橋(クロスリンク)が形成され、DNAの複製やmRNAの転写を阻害して、細胞にダメージを与え、細胞周期の停止(増殖抑制)と細胞死(アポトーシス)を誘導する。
シスプラチンは1978年に米国とカナダで承認され、日本は1983年に承認されています。多くの固形がんの治療に使用され、効き目は高いのですが、その作用機序から副作用が強いのも特徴です。がん細胞への選択性が無く、正常細胞も同様にダメージを受けるためです。
シスプラチンで治療していると、ほぼ確実にシスプラチン耐性のがん細胞が出現し、シスプラチンはいずれ効かなくなります。この抗がん剤シスプラチン耐性のメカニズムを阻止すれば、シスプラチンの抗腫瘍効果を継続できます。
シスプラチンの抗がん作用のメカニズムは、前述のようにDNAに付加体を結合させることによるDNAの複製や転写の阻害がメインだと考えられていました。したがって、シスプラチン耐性は、DNA付加体の除去やDNA修復の機能が亢進することが、主な原因だと考えれてきました。
しかし、最近の研究では、シスプラチンの抗がん作用はDNAに結合することより、細胞内で酸化ストレスを高める機序の関与が大きいと考えられています。その理由は、シスプラチンの抗がん作用は抗酸化剤の投与で減弱すること、シスプラチン耐性細胞では抗酸化システムの増強が起こっていること、などが明らかになっているからです。以下のような報告があります。
Cisplatin generates oxidative stress which is accompanied by rapid shifts in central carbon metabolism. (シスプラチンは酸化ストレスを引き起こし、これは中心的な炭素代謝の急速な変化を伴う)Sci Rep. 2018; 8: 4306.
【要旨の抜粋】
シスプラチンは、固形腫瘍の治療に広く利用されている。その作用機序は複雑であり、この薬に対する耐性のメカニズムも多くの報告がある。
シスプラチンに対する細胞応答に関連する代謝の特徴を同定するために、頭頸部扁平上皮がん細胞を用いて、増殖や生存および代謝活性に対するシスプラチン投与によって誘導される酸化ストレスの影響を検討した。
細胞内に存在する全てのシスプラチンのうち、DNAに結合したシスプラチンはわずかであり、細胞内のシスプラチンは強い酸化ストレスを引き起こしている。
細胞死およびTP53突然変異状態のメカニズムとは無関係に、酸化ストレスの軽減はシスプラチン毒性を抑制する。
シスプラチン誘発性の酸化ストレスは、3つの主要な異化経路である解糖系とペントース・リン酸経路とクエン酸回路における代謝の急激な変化を引き起こす。
これらの代謝系の変化の中で、ピルビン酸から乳酸への変換の減少は、多様な遺伝子異常を有し、シスプラチンに対する感受性の違いを有する複数の頭頸部扁平上皮がん細胞株にわたって共通して観察される唯一の代謝変化である。
酸化ストレスは、頭頸部扁平上皮がん細胞株に対するシスプラチンによる細胞傷害活性の重要なメカニズムであり、この酸化ストレスはピルビン酸から乳酸の変換を急速に減少させる。
シスプラチンがDNAに結合してDNAのクロスリンク(架橋)や付加体を形成することが、シスプラチンの細胞毒性の主体と今までかんがえられていましたが、細胞内でDNA結合のシスプラチンはわずか(10%以下)であって、大半はDNAに結合せずに、活性酸素の産生を高めて、タンパク質やDNAの傷害を引き起こしていることを報告しています。このように、細胞質内のシスプラチンが活性酸素を産生して、酸化ストレスを高めていることが、最近の多くの研究で明らかになっています。培養がん細胞にシスプラチンを添加すると細胞周期の停止や細胞死(アポトーシス)の誘導が起こりますが、抗酸化剤のN-アセチルシステインを加えるとシスプラチンの増殖抑制作用が阻止されることが示されています。
以下のような報告があります。
Nrf2 inhibition reverses the resistance of cisplatin-resistant head and neck cancer cells to artesunate-induced ferroptosis(Nrf2阻害は、シスプラチン耐性頭頸部がん細胞のアルテスネイト誘発性フェロトーシスに対する抵抗性を逆転させる)Redox Biol. 2017 Apr; 11: 254–262.
【要旨の抜粋】
抗マラリア薬であるアルテスネイト(Artesunate)は、活性酸素種を産生することによって細胞死の誘導の作用を有し、抗がん剤として再利用されている。
しかしながら、アルテスネイトによる細胞死誘導お分子機構および抵抗性のメカニズムに関しては依然として不明である。
我々は、頭頸部がんに対するアルテスネイトの抗腫瘍作用の分子メカニズムと、アルテスネイト耐性を克服する方法を研究した。
3つのシスプラチン耐性の頭頸部がん細胞株を含む異なる頭頸部がん細胞株を用いて、アルテスネイトおよびトリゴネリン(trigonelline)の効果を検討した。
アルテスネイトは正常細胞には毒性は示さずに、頭頸部がん細胞を選択的に死滅させた。シスプラチン耐性の頭頸部がん細胞では、アルテネイトに対する感受性は比較的低かった。
アルテスネイトは、細胞内のグルタチオンレベルを低下させ、脂質活性酸素種の量を増加させることによって、頭頸部がん細胞においてフェロトーシスを誘導した。
アルテスネイトは、頭頸部がん細胞におけるNrf2-抗酸化応答エレメント(ARE)経路を活性化し、これはフェロトーシス耐性に寄与した。
Nrf2の負の制御因子であるKeap1の発現抑制は、頭頸部がん細胞におけるアルテスネイト感受性を低下させた。
Nrf2遺伝子サイレンシングまたはトリゴネリン(trigonelline)は、Keap1サイレンシングおよびシスプラチン耐性の頭頸部がん細胞のアルテスネイトによるフェロトーシス耐性をインビトロおよびインビボで阻止した。
Nrf2-ARE経路の活性化は、頭頸部がん細胞のアルテスネイト抵抗性に寄与し、この経路の阻害は、頭頸部がん細胞のフェロトーシス耐性を阻止する。
アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っており、がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています(下図)。

図:アルテスネイトは鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っている。がん細胞は正常細胞に比べて鉄を多く含むので、がん細胞を選択的に傷害することができる。
がん細胞で活性が亢進している転写因子の低酸素誘導性因子-1(HIF-1)はトランスフェリンレセプターの発現を高めます。
鉄は細胞増殖に必要なため、がん細胞はトランスフェリンレセプターを多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に傷害を与えることができます。
アルテスネイトはがん細胞に酸化ストレスを高めて細胞死を誘導します。がん細胞は酸化ストレスに抵抗するために転写因子のNrf2活性を高めて酸化ストレスに抵抗します。
シスプラチン耐性のがん細胞ではアルテネイトに対する感受性は低いというのは、シスプラチンとアルテスネイトに対する抵抗性の共通のメカニズムとしてNrf2の活性化があることを示唆しています。
【細胞内の抗酸化システムを利用してがん細胞は抗がん剤抵抗性になる】
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2という転写因子です。

図:放射線や抗がん剤は、活性酸素の産生を高め(①)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(②)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し(③)、スーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高めて、活性酸素による害(酸化ストレス)を軽減している(④)。この抗酸化システムの亢進によって、がん細胞は放射線や抗がん剤に抵抗性になる。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
ホルミシス(hormisis)効果というものがあります。体に有害と思われている放射線や活性酸素やある種の発がん物質も、微量であれば体を刺激する方向で働いて、これらの害に対する抵抗力が高まるという効果です。刺激やストレスがくり返されると、生体はそれらに対して適応するように体が反応するため、その刺激やストレスに対して抵抗性になると考えられるのですが、抗酸化力や解毒力の増強のメカニズムに関しては転写因子のNrf2の活性化が関与しています。
除草剤(農薬)のパラコートは活性酸素を発生させます。線虫を様々な濃度のパラコートの入った培地で育てて、その寿命を検討した実験があります。
パラコートの濃度が極めて低い(0.005mM以下)と寿命に影響は及ぼしませんが、濃度が0.01mMから0.5mMの場合は、寿命が最大で60%くらい延長します。1mM以上だと逆に寿命は短縮します。軽度の酸化ストレスは寿命を延ばし、高度の酸化ストレスはダメージを与えるので寿命は短縮するという結果です。
化学発がん物質の研究でもホルミシス効果が認められています。体内で活性酸素を発生させて発がん作用を示すような物質を少量だけ投与すると、かえって発がんが抑えられることがあります。これは、軽度の酸化ストレスに対して、適応反応として体の中の抗酸化酵素が増加するためであると考えられています。この場合も、Nrf2の活性化が重要な役割を担っています.
このNrf2は様々なストレスや有害物質から細胞を守っているので、細胞にとっては重要な防御システムです。

図:生物に対して通常有害な作用を示す刺激が、微量であれば逆に有益な作用(ストレス抵抗性の亢進)になるという現象を「ホルミシス(Hormesis)」と言う(①)。活性酸素は大量に発生すると細胞膜やDNAの酸化傷害から増殖抑制や細胞死誘導などの細胞傷害作用をしめす(②)。しかし、適度な活性酸素の産生は、転写因子のNrf2の活性化を介するホルミシス効果によって、抗酸化システムの亢進やストレス抵抗性の亢進を誘導する(③)。
がん細胞ではNrf2の活性が非常に高くなっており、しかもNrf2の活性が高いがん細胞ほど治療に抵抗性で予後が悪いことが報告されています。
つまり、がん細胞は、抗がん剤や放射線治療から自分を守るためにNrf2を利用しているということです。
培養細胞や動物実験の段階ですが、抗がん剤治療や放射線治療にNrf2阻害剤を併用すると抗腫瘍効果が高まることが報告されています。
【Nrf2は細胞の抗酸化力を高める】
転写因子のNrf2は、抗酸化機能や解毒機能を持つ様々な遺伝子の転写を誘導します。
活性酸素種や食物に含まれる親電子性物質によりもたらされる酸化ストレスは,DNAやタンパク質や脂質などの生体高分子を酸化することで傷害を与え、がんや糖尿病や腎臓疾患や神経変性疾患など様々な疾患を引き起こす原因になります。
このような酸化ストレスに対する防御機構において重要な機能を担っているのが、Keap1-Nrf2システムです.
正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受け、分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れて核へ移行し、遺伝子上流に存在する抗酸化剤応答配列(ARE:antioxidant response element)に結合することによって、このARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオンの合成に関与する酵素やフェースII解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞や前がん細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。このようなNrf2の活性化を介したがん予防物質としてスルフォラファンやクルクミンやレスベラトロールなどが報告されています。
一方、がん細胞においては、Nrf2が恒常的に活性化しており、Nrf2活性を阻害するとがん細胞は死にやすくなることが報告されています。
ヒトの肺がんなど多くの固形腫瘍でNrf2機能の異常亢進が見つかっています。そして、Nrf2の活性が高いと治療に抵抗性で予後が不良であることが報告されています。
Nrf2は解毒酵素、抗酸化タンパク質、薬剤排出トランスポーターなどの遺伝子を統括的に活性化することにより、がん細胞の抗がん剤耐性と放射線耐性をもたらします。
さらに、Nfr2はグルコースやグルタミンの代謝を変化させて細胞増殖に有利な同化反応を促進します。
Nrf2はがん細胞のペントースリン酸経路を活性化して、核酸とNADPHの産生を増やすことで細胞増殖を亢進します。NADPHはグルタチオンの合成にも必要です。
多くのがん細胞では、酸化ストレスの有無とは関係なくNrf2の発現量と活性が亢進しています。その理由は、RASやMYCなどのがん遺伝子がNrf2を活性化しているからです。
Nrf2の活性を抑制するKeap1の遺伝子変異によってNrf2が活性化する場合も見つかっています。
恒常的に安定化したNrf2は酸化ストレスや抗がん剤/放射線治療に対する抵抗性を増強し、さらに積極的に細胞増殖を促進することになります。
抗がん剤治療や放射線治療によって活性酸素が増えると、がん細胞はさらにNrf2の量を増やして抵抗性を獲得してきます。
このようにNrf2の活性化はがん細胞が治療に対する抵抗性を獲得するメカニズムとして重要です。したがって、がん細胞のおけるNrf2の機能阻害は、抗がん剤治療の有効な戦略となります。
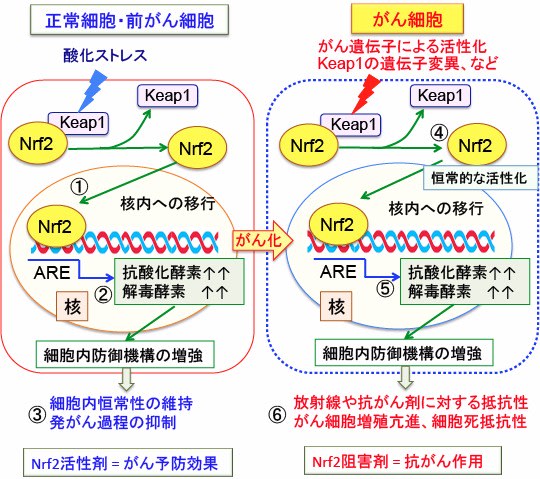
図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている。正常細胞では酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して(①)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合して、これらの遺伝子の発現を亢進する(②)。その結果、正常細胞では活性酸素や発がん物質を解毒することになるので、Nrf2の活性を促進するもの(Nrf2活性剤)はがん予防効果がある(③)。
一方、がん細胞においては、KRasやcMycなどのがん遺伝子の活性化やKeap1の遺伝子変異などによってNrf2は恒常的に活性化しており(④)、抗酸化酵素や解毒酵素の産生や活性が亢進している。そのため、がん細胞は酸化ストレスや細胞傷害性物質に対する抵抗性が亢進しており(⑤)、これが抗がん剤や放散線治療に対する抵抗性の原因になっている(⑥)。したがって、がん細胞においては、Nrf2の活性を阻害するもの(Nrf2阻害剤)ががん治療に役立つ。このように、正常細胞(前がん細胞も含む)とがん細胞とではNrf2に対する対応は全く異なる。
がん細胞のNrf2を阻害すると、
①がん細胞内での活性酸素種の蓄積によってアポトーシス(細胞死)が誘導できる。
②抗がん剤治療や放射線治療の効き目を高めることができる。
③がん細胞での物質合成(同化反応)を阻害することによって増殖を阻害できる。
などの効果が期待できます。
ただし、全身投与の場合は、がん組織以外の正常組織での酸化ストレス応答を減弱させる欠点もあります。つまり、がん細胞特異的にNrf2を阻害できる方法があれば、がん治療に役立ちます。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、糖質制限やケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが明らかになっています。以下のような報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。 メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。
【植物はNrf2阻害薬の宝庫】
ルテオリンは、フラボノイドの一種で、野菜やハーブや生薬に多く含まれています。
食品としては、シュンギク、ピーマン、セロリ,パセリ、ブロッコリー、ニンジン、キャベツなどに多く含まれます。オリーブオイルにも含まれています。
ハーブや生薬としてはシソ科のペパーミント(peppermint)、タイム(thyme)、ローズマリー(rosemary)、オレガノ(oregano)に多く含まれています。キク科のタンポポ(蒲公英)の葉にも含まれています。
漢方薬でも、シソ科の生薬(蘇葉、黄芩、半枝蓮など)は抗がん作用が知られており、多くの抗がん成分が含まれていますが、ルテオリンも重要な薬効成分と言えます。
ルテオリンの豊富な食品はがんの予防や治療に役立ちます。ルテオリンは熱に安定で、調理によってロスが少ないと言われています。
また、ルテオリンの豊富なハーブや生薬を使った漢方治療はがんの治療や再発予防の目的で効果が期待できます。ルテオリンは血液脳関門(blood-brain barrier)を通過できるので、脳腫瘍にも効果が期待できます。
このルテオリンにNrf2阻害作用が報告されています。以下のような報告があります。
Luteolin inhibits the Nrf2 signaling pathway and tumor growth in vivo. (ルテオリンは生体内の実験でNrf2シグナル伝達系と腫瘍増殖を阻害する)Biochem Biophys Res Commun. 2014 May 16;447(4):602-8.
【要旨】
Nrf2(Nuclear factor erythroid 2-related factor 2)は多くのタイプの腫瘍において過剰発現しており、がん細胞の増殖を促進し、抗がん剤治療に対する抵抗性を高める。したがって、Nrf2はがん治療における新規治療標的とみなされている。
我々は、in vitro(培養細胞を使った実験)の実験系で、ルテオリンがNrf2の強力な阻害剤であることを報告した。
この報告では、ルテオリンがマウス肝臓におけるNAD(P)Hキノンオキシドレダクターゼ1の発現を時間および用量依存的に減少させることを示した。さらに、ルテオリンは、抗酸化酵素およびグルタチオントランスフェラーゼの発現を阻害し、マウスの肝臓における還元型グルタチオンの量を減少させた。対照的に、そのような応答は、Nrf2欠損マウスでは検出されなかった。
さらに、ルテオリンの単独経口投与、あるいは細胞毒性薬物シスプラチンの腹腔内注射と組み合わせたルテオリンの経口投与は、ヌードマウスに移植した非小細胞性肺がんA549細胞の増殖を、顕著に阻害した。
移植腫瘍における細胞増殖活性、Nrf2の発現、および抗酸化酵素の活性の全ては、ルテオリン投与によって減少した。
さらに、ルテオリンは、シスプラチンの抗がん効果を増強した。
以上の結果から、ルテオリンが生体内(in vivo)でNrf2経路を阻害し、非小細胞性肺がんの化学療法において補助療法として役立ち得ることを示した。
五環系トリペルペノイドのウルソール酸(Ursolic acid)は白花蛇舌草や夏枯草などの抗がん作用のある生薬に含まれています。このウルソール酸がNrf2を阻害するという報告があります。
Ursolic acid sensitizes cisplatin-resistant HepG2/DDP cells to cisplatin via inhibiting Nrf2/ARE pathway(ウルソール酸はNrf2/ARE経路を阻害することによってシスプラチン耐性HepG2/DDP細胞をシスプラチン感受性にする)Drug Des Devel Ther. 2016 Oct 25;10:3471-3481.
この論文では、ウルソール酸が肝臓がん細胞のシスプラチン耐性を阻止して、シスプラチンに対する感受性を高めることを報告しています。
ウルソール酸とシスプラチンの併用は、肝臓がん細胞の活性酸素の産生を高め、細胞周期をG0/G1で停止し、ミトコンドリア膜電位を低下させ、アポトーシスを誘導しました。
さらに、Nrf2の発現を抑制し、Nrf2によって転写が促進される遺伝子の発現低下が認められました。
以上の結果から、ウルソール酸はNrf2/ARE(/antioxidant response element)経路を阻害するメカニズムで、肝臓がん細胞のシスプラチン耐性を阻止するという結論です。
漢方薬はフラボノイドなどのポリフェノールが豊富です。このようなポリフェノールの抗がん作用は、従来は抗酸化作用で理解されてきました。
しかし、抗酸化剤ががんを予防したり、がん治療にプラスになることは否定されています。最近の研究では、ポリフェノールは酸化剤として作用し、正常細胞に対してはホルミシスの機序で、がん細胞に対しては酸化ストレスを高める作用によって、がん予防効果と抗がん作用を説明する方が理にかなっているように思われます。

図:お茶の健康作用は、エピガロカテキンなどのポリフェノールによると考えられている(1)。ポリフェノールは抗酸化作用(活性酸素の消去)によってがん予防や抗老化の作用を発揮すると一般に考えられている(2)。しかし、ポリフェノールが酸化剤として作用して細胞に酸化ストレスを与え(3)、適度な酸化ストレスは細胞の抗酸化システムを亢進するというホルミシス効果によって抗酸化力を高め、健康作用を発揮している可能性が報告されている(4)。さらに、がん細胞やがん組織では銅イオンが多いため、銅イオンとポリフェノールが反応して活性酸素の産生を増やし、がん細胞に選択的に酸化傷害を引き起こす機序が報告されている(5)。すなわち、ポリフェノールはがん細胞に対して酸化剤として作用して増殖抑制や細胞死誘導の作用を発揮する(6)。
【がん幹細胞のマーカーのアルデヒド脱水素酵素はシスプラチン耐性に関与する】
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
がん幹細胞が生き残れば、がんはいずれ再燃・再発しますので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。
その方法の一つとしてアルデヒド脱水素酵素阻害剤が注目されています。
アルデヒド脱水素酵素はがん幹細胞に多く発現し、この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。
アルデヒド脱水素酵素はがん幹細胞に多く発現し、がん幹細胞のマーカーとして使用されています。このアルデヒド脱水素酵素が抗がん剤のシスプラチン耐性に重要な働きをしていることが複数の研究で示されています。以下のような論文があります。
Targeting the cancer stem cell marker, aldehyde dehydrogenase 1, to circumvent cisplatin resistance in NSCLC(非小細胞性肺がんにおけるシスプラチン耐性を克服するために、がん幹細胞マーカーであるアルデヒド脱水素酵素1を標的とする)Oncotarget. 2017 Sep 22; 8(42): 72544–72563
この論文では、シスプラチン感受性および耐性の非小細胞性肺がん細胞株において、シスプラチンの投与はアルデヒド脱水素酵素(ALDH1)の発現の高いがん細胞集団の出現または増大を誘導し、シスプラチン耐性をさらに高める結果が報告されています。
つまり、ALDH1を発現している肺がん細胞はシスプラチンに耐性の性質を持つので、ALDH1陽性細胞が選択的に増え、シスプラチンがさらに効きにくくなるという現象が起こることを指摘しています。
そこで、 ALDH1を阻害するジスルフィラムを投与すると、シスプラチン抵抗性の肺がん細胞がシスプラチンの細胞傷害作用に感受性を示すようになりました。
つまり、ALDH1を阻害するジスルフィラムはシスプラチン耐性を阻止することができるという結論です。
ジスルフィラムと抗がん剤を併用した臨床試験の結果が報告されています。以下のような報告があります。
A phase IIb trial assessing the addition of disulfiram to chemotherapy for the treatment of metastatic non-small cell lung cancer.(転移性非小細胞肺がんの治療のための化学療法へのジスルフィラムの併用を評価する第IIb相臨床試験。)Oncologist 2015 Apr;20(4):366-7.
非小細胞性肺がんの抗がん剤治療(シスプラチン+ビノレルビン)にジスルフィラムを併用する治療の安全性と有効性を評価するための第II相臨床試験を、多施設のランダム化二重盲検試験で実施しています。
新規に診断されたステージ4の非小細胞性肺がん患者40例が抗がん剤(シスプラチン+ビノレルビンで2サイクル以上)で治療を受けています。この40例のうち20例はジスルフィラム(1回40mgを1日3回)を服用しています。
生存期間の平均は、抗がん剤単独群が7.1ヶ月で、抗がん剤+ジスルフィラム併用群が10ヶ月でした。長期生存患者が2名いて、どちらもジスルフィラム併用群でした。ジスルフィラム併用による安全性には問題はありませんでした。
つまり、ステージ4の非小細胞性肺がんのシスプラチン+ビノレルビンの抗がん剤治療にジスルフィラムを併用すると、生存期間を延ばす効果があるという結果です。
【アルデヒド脱水素酵素は酸化ストレスを軽減している】
人間のゲノムには、機能的なアルデヒド脱水素酵素の遺伝子が19個見つかっています。これらのアルデヒド脱水素酵素は、内因性および外因性のアルデヒド性物質をNAD(P)+-依存性酸化反応によって解毒する役割を担っています。
内因性のアルデヒドはアミノ酸やアルコールや脂肪酸やビタミンの代謝の過程で発生します。
外来性のアルデヒドは環境中の成分や薬物(タバコの煙、自動車の排気ガス、細胞毒性のある医薬品など)などから由来します。アルデヒド脱水素酵素はこれらのアルデヒドを解毒する働きがあるのです。
ALDH1にはALDH1A1とALDH1A2とALDH1A3の3つのアイソタイプがあり、正常組織の組織幹細胞とがん組織のがん幹細胞のマーカーとして知られており、幹細胞における自己複製、分化、細胞保護に関与しています。
マウスやヒトの細胞を用いた研究では、特にALDH1A1アイソタイプの過剰発現および活性亢進は、乳がん、肺がん、食道がん、大腸がん、胃がんなど多くのがん種で、がん患者の予後不良と密接に関連していることが明らかになっています。
20年以上前に、白血病などの造血器腫瘍で、ALDHの活性が高い細胞はアルキル化剤のシクロフォスファミドに抵抗性を示すことが報告され、その後、ALDHの活性が高いがん細胞は多くの抗がん剤や放射線照射に抵抗性になることが明らかになっています。
ALDH1A1は細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。
【ジスルフィラムはアルデヒド脱水素酵素を阻害する】
アセトアルデヒドはDNAと結合してDNA付加体(DNA adducts)を作ってDNA変異を引き起こしたり、様々な毒作用があります。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
多くのがん種においてALDH活性の高いがん細胞は増殖や転移を促進することが報告されています。ALDH活性の高い腫瘍は生存期間も短く予後が悪いことが報告されています。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは副作用の極めて少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。

図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトアルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
ジスルフィラムはALDH1A1を阻害します。ALDH1A1だけでなく、他のALDHアイソフォームを不可逆的に阻害する汎ALDH阻害剤(pan-ALDH inhibitor)であり、細胞質およびミトコンドリアのALDHを広範に阻害します。
その他、ジスルフィラムはプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。プロテアソーム阻害作用に関しては、Natureにも報告され、ジスルフィラムの抗がん作用が最近注目されています(573話参照)。
酸化ストレスを高める作用もあります。
アルコールを摂取しなければ、通常の服用量ではジスルフィラム自体の毒性は極めて軽微です。抗がん剤治療との併用も、副作用を増強する作用は認められていません。
したがって、抗がん剤治療と併用して抗腫瘍効果を高める方法として、ジスルフィラムは極めて有用です。(ただし、パクリタキセルのように溶解にエタノールを使う場合は使用できません)

図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸に変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシドに代謝される(①)。ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応して結合し、酵素活性を阻害する(②)。同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害する。
注:ジスルフィラム服用中は飲酒はできません。奈良漬けのようなアルコールの入った食品も食べれません。抗がん剤のパクリタキセルは溶解剤としてエタノールを用いていますので、パクリタキセル治療中はジスルフィラムは使用できません。点滴による抗がん剤治療を受けているときには、溶解剤などでエタノールを使用していないことを確認する必要があります。
トップの図にまとめたような薬やサプリメントを併用すると、がん細胞のシスプラチン耐性を阻止して、抗腫瘍効果を高めることができます。これらは保険適応外使用やサプリメントであるため、保険診療機関では使用できないため、標準治療には使われていません。しかし、シスプラチン単独では、ほぼ確実に耐性がでてきて、効かなくなります。
実際に多くの患者さんに使用していますが、抗がん剤の効き目を高める効果があり、副作用はほとんど経験しません。 このようなフレキシブルな治療ができないのが、保険診療でのがん治療の限界を作っていると思います。
| « 590)がんの「... | 592)抗がん剤... » |



