がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
592)抗がん剤治療は腫瘍関連マクロファージを活性化してがんの悪化を促進する
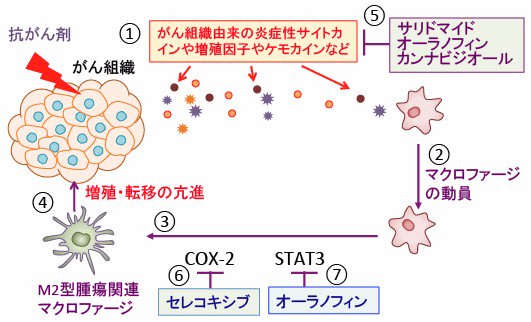
図:高用量の抗がん剤投与によってがん組織がダメージを受けると、腫瘍組織内のがん細胞や炎症細胞や線維芽細胞などから炎症性サイトカインや増殖因子やケモカインが分泌され(①)、がん組織にマクロファージが動員される(②)。シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はがん組織に動員された腫瘍関連マクロファージ(M1型)をM2型腫瘍関連マクロファージに変換し(③)、このM2型腫瘍関連マクロファージは様々なサイトカインや増殖因子を産生してがん細胞の増殖や転移を亢進する(④)。サリドマイド、オーラノフィン、カンナビジオールは炎症性サイトカインや増殖因子やケモカインの産生を抑制し(⑤)、セレコキシブ(celecoxib)はCOX-2を阻害し(⑥)、オーラノフィンはSTAT3を阻害する(⑦)。抗がん剤治療によるがんの悪化を阻止する方法として、これらの薬剤は役立つ。
592)抗がん剤治療は腫瘍関連マクロファージを活性化してがんの悪化を促進する
【がん治療におけるマクロファージ活性化の2面性】
マクロファージは白血球の1種で、細胞内に消化酵素を持ち、細菌、ウイルス、死んだ細胞などの異物を細胞内に取り込んで消化するので、大食細胞や貪食細胞とも呼ばれます。
分解した異物をいくつかの断片にして細胞表面に抗原として提示する(抗原提示という)役割を持ち、リンパ球による免疫反応の最初のシグナルとして重要な働きをします。
さらに、各種のサイトカイン(リンパ球などの免疫細胞の働きを調節するホルモン様蛋白質)を放出してナチュラルキラー細胞やT細胞などを活性化し、感染症やがんに対する生体防御機構において重要な役割を果たします。
がんに効くと宣伝されているサプリメントの多くが、マクロファージを活性化して、がん細胞に対する免疫力を高めることを強調しています。
しかし、がん患者においてマクロファージの活性を高めることは、がん細胞の増殖を抑える良い面だけでなく、状況によってはがん細胞の増殖を促進する悪い面の2面性があるので注意が必要です。(下図)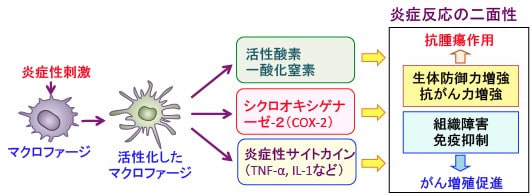
図:マクロファージが活性化されて産生される活性酸素や一酸化窒素やシクロオキシゲナーゼー2や炎症性サイトカイン(TNF-αやIL-1など)は、がん細胞や病原菌に対する生体防御力を高めるが、炎症を増悪させて組織障害を増悪し、抗腫瘍免疫を抑制してがん細胞の増殖を促進する場合もある。マクロファージの活性化には二面性があることに注意する必要がある。
【腫瘍関連マクロファージはがんの悪化を促進する】
以前は、マクロファージが活性化するとがん細胞を攻撃してくれると考えられていたのですが、最近の考え方はむしろ逆で、腫瘍内にマクロファージの数が多いほど予後が悪いことが報告されています。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage:TAM)と言い、血管新生、増殖因子産生、免疫抑制、転移促進などのさまざまな機能により発がん・悪性化を促進する働きをしています。
活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカインはがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。腫瘍組織内のマクロファージはM1型とM2型に分けられます。
M1型はがん細胞を攻撃する作用がありますが、炎症と組織傷害を進める作用があります。
一方、M2型は炎症を収束させるように働きますが、細胞傷害性T細胞(CTL)活性を抑制して抗腫瘍免疫を阻止する作用を持っています。
がんの免疫療法の効果を高めるためにはM1型を亢進し、M2型を抑制することが重要と考えられています。

図:シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)は腫瘍関連マクロファージ(Tumor-associated macrophage: TAM)をM1型からM2型に変換して活性化する(①)。M2型TAMはVEGF, FGF-2, IL-1, and IL-8を産生して血管新生を亢進し(②)、EGF, FGF-2, IL-6, TGF-β, PDGFを産生してがん細胞の増殖を亢進する(③)。さらに、がん細胞と融合したり、EGF(上皮細胞増殖因子), IL-6, IL-8を産生して、がん幹細胞の性状をがん細胞に獲得させる(④)。さらにMMPs(matrix metalloproteinase)やEGFの産生を促進してがん細胞の浸潤性を高める(⑤)。このようにして、M2型腫瘍関連マクロファージはがん細胞の増殖、転移、治療抵抗性、再発を促進する(⑥)。(参考:J Zhejiang Univ Sci B. 15(1): 1–15. 2014年, Fig.1)
【血管周囲マクロファージはがん細胞の血管内浸潤を手助けする】
がん細胞が血管内に侵入するとき、それなりのメカニズムが存在します。
血管というのは、血液が漏れないように血管内皮細胞が連続して管を形成しています。その中に入り込むには、血管内皮細胞の隙間を通って入り込むというプロセスが必須です。偶然に入るわけではありません。
まず、がん細胞は移動能を亢進する必要があり、そのため細胞骨格タンパク質などの発現や機能に変化が起こります。その一つがMenaというアクチン制御タンパク質の発現亢進で、このMenaタンパク質を免疫染色で染めれば、多数のがん細胞の中から移動能が亢進して周囲の組織や血管内に浸潤しようとしているがん細胞を見つけることができます。
さらに、血管内皮細胞の接合をこじ開けて、血管壁の透過性を亢進して、がん細胞の血管内侵入を助けるのが、腫瘍組織内のマクロファージ(腫瘍関連マクロファージ)のサブポピュレーションのTie2発現マクロファージです。
血管周囲マクロファージはアンジオポエチン(angiopoietin )の受容体の Tie2を発現しています。
さらに、血管周囲マクロファージは血管内皮細胞増殖因子-A (vascular endothelial growth factor–A :VEGF-A)を分泌して血管透過性を亢進します。
つまり、血管周囲マクロファファージはTie2とVEGFAを高発現(Tie2Hi/VEGFAHi perivascular macrophages)している特徴があります。
がん細胞が血管内に侵入するとき、血管内皮細胞の間の接合部分がこじ開けられて、移動能を増したがん細胞が血管内に入り込むのですが、この時、血管内皮細胞の接合部を解離させてがん細胞の血管内侵入を助けるのが血管周囲のマクロファージで、VEGFAを分泌して一過性に血管透過性を亢進させるという機序が存在するということです。
Menaタンパク質の発現が亢進した(運動能が亢進した)がん細胞と、Tie2発現が亢進している血管周囲マクロファージと血管内皮細胞が一緒になっている部位を3重免疫染色で見つければ、その部位ががん細胞の血管内侵入の部位と同定できます。
この3種類の細胞が一緒にいる部位は転移の腫瘍微小環境(Tumor Microenvironment of Metastasis :TMEM)と呼ばれます。
このTMEMの密度(一定面積内の数)をスコア化して、転移との関連を検討すると、TMEMスコアは血行性転移のリスクと相関を示すことが明らかになっています。(詳しくは587話参照)

図:血管内に侵入しようとしているがん細胞はアクチン制御タンパク質のMenaの発現が亢進している(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2を持つ血管周囲マクロファージ(腫瘍関連マクロファージの1種)の手助けが必要(②)。したがって、がん細胞が血管に侵入している部位には、Mena発現がん細胞とTie2発現マクロファージと血管内皮細胞の3つの細胞が存在する。この部位ががん細胞の血管侵入部位で、Tumor Microenvironment of Metastasis(転移の腫瘍微小環境)、略してTMEMと呼ばれる。
術前補助化学療法を行うと、原発乳がんの化学療法前に比べて、化学療法の後ではTMEM 密度が大きくなっていることが報告されています。これは「術前補助化学化学療法ががん転移を誘発する」という可能性を示唆しています。(587話参照)
【シクロオキシゲナーゼ-2はM2型の腫瘍関連マクロファージを増やして抗腫瘍免疫を抑制する】
活性化したマクロファージとがん細胞はともにシクロオキシゲナーゼ-2(COX-2)の活性が亢進しています。COX-2活性亢進はプロスタグランジンE2(PGE2)の産生を増やします。
PGE2はがん細胞におけるPD-L1の発現を亢進して細胞傷害性T細胞(キラーT細胞)の活性を阻害します。
細胞傷害性T細胞は抗原提示細胞(樹状細胞やマクロファージ)から抗原を提示されると活性化されて、敵(病原菌やがん細胞など)を攻撃します。
細胞傷害性T細胞にはPD-1という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)の略です。
PD-1にリガンド(受容体に結合して作用する物質)となるPD-L1を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。つまり、PD-1受容体がPD-L1によって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しています。
細胞傷害性T細胞の働きを阻害するPD-L1はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。
プロスタグランジンE2はがん細胞におけるPD-L1の発現を亢進することによって細胞傷害性T細胞の働きを阻害します。(下図)

図:抗原提示細胞上にはMHCクラスII(MHC-II)といわれる分子があり、抗原を介してT細胞上のTCR(T細胞受容体)と反応して細胞傷害性T細胞を活性化する(①)。PD-1(Programmed death-1)は抗原提示細胞のPD-L1と結合することによって抑制型の免疫調節シグナルを活性化させる(②)。がん細胞もPD-L1が発現しており、細胞傷害性T細胞の働きを抑制している(③)。プロスタグランジンE2(PGE2)はがん細胞のPD-L1の発現を亢進して細胞傷害性T細胞の働きを抑制する(④)。
また、PGE2はT細胞を動員するケモカインのCXCL9の働きを阻害することによってT細胞の腫瘍内への動員を阻止しています。
また、PGE2はM1型マクロファージを阻害し、M2型マクロファージを亢進します。その結果、CTLの活性は抑制され、抗腫瘍免疫は低下します。したがって、COX-2阻害剤のcelecoxib(商品名:セレコックス)は抗腫瘍免疫を高める効果が期待できます。
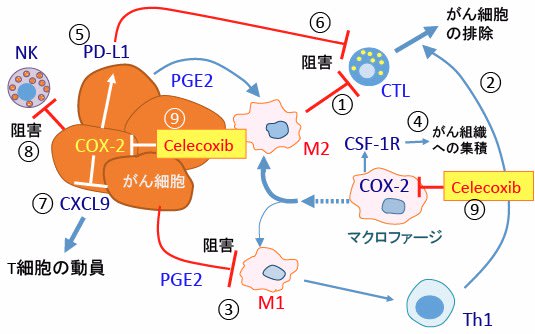
図:がん組織内のマクロファージやがん細胞はシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進し、プロスタグランジンE2(PGE2)の産生が増えている。PGE2によってM2型に誘導されたマクロファージ(M2)は細胞傷害性T細胞(CTL)の活性を抑制する(①)。M1型マクロファージはヘルパーT細胞タイプ1(Th1)を活性化してCTLの働きを亢進する(②)。しかし、PGE2はマクロファージのM1型への移行を阻害するので、PGE2はM1型マクロファージとTh1の阻害を介してCTLを抑制する(③)。PGE2はcolony stimulating factor-1受容体(CSF-1R)の発現を亢進してマクロファージのがん組織への集積を促進する(④)。がん細胞ではPGE2がPD-L1(Programmed Death-1 ligand)の発現を亢進する(⑤)。PD-L1はCTLのPD-1(Programmed Death-1)に作用してCTLの活性を抑制する(⑥)。PGE2は局所にT細胞を動員するケモカインのCXCL9の発現を抑制することによって、がん組織へのT細胞の移動・集積を阻害する(⑦)。PGE2はナチュラルキラー(NK)細胞の活性を阻止する(⑧)。以上のような様々なメカニズムでCOX-2は抗腫瘍免疫を抑制している。COX-2阻害剤のcelecoxib(セレコックス)はCOX-2活性を阻害することによって抗腫瘍免疫を亢進する効果がある(⑨)。(参考:Oncoimmunology. 2014 Jun 30;3:e29287. eCollection 2014.)
【抗がん剤治療は腫瘍関連マクロファージと血管内皮細胞を増やす】
高用量の抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいる線維芽細胞(がん関連線維芽細胞)などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。
炎症性サイトカインは免疫細胞や炎症細胞から分泌されるたんぱく質で炎症反応を制御に関わります。ケモカインはサイトカインの一種で、白血球などの遊走を引き起こして炎症反応に関わります。
ダメージを受けたがん組織からCCL2というケモカインが分泌されます。CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。CCL2はがん細胞に存在する受容体に結合してがん細胞の増殖や生存や浸潤を亢進します。
がん組織がダメージを受けるとCXCL12というケモカインの産生も増えます。CXCL12は本来は炎症などにおいてリンパ球や造血幹細胞の移動に関与していますが、骨髄の血管内皮前駆細胞はこのケモカインの受容体を持っているので、ダメージを受けたがん組織から産生されるCXCL12によって血管内皮前駆細胞が骨髄からがん組織に動員されて血管新生が促進されることが報告されています。
がん関連線維芽細胞はCCL2やCXCL12のようなケモカインだけでなく、HGF(Hepatocyte Growth Factor)などの様々な増殖因子や活性酸素を産生することによってがん細胞の増殖や浸潤を促進しています。
このように、抗がん剤治療によって強いダメージを受けると、損傷を受けたがん組織のダメージを修復する目的でケモカインや増殖因子を産生して血管内皮前駆細胞やマクロファージを動員し、その結果、がん細胞の増殖や浸潤は促進され、がんはさらに悪化するという経過を辿ることになります。
これが、高用量の抗がん剤治療がうまくいかない理由の一つです。抗がん剤治療のターゲットはがん細胞だけでなく、間質の細胞(線維芽細胞やマクロファージなど)とがん細胞の相互作用についても十分に考慮することが重要です。

図:抗がん剤治療によってがん組織はダメージを受ける(①)。ダメージを受けた組織を修復するために、がん組織中の線維芽細胞からケモカインや増殖因子が産生される(②)。がん細胞はケモカインや増殖因子に対する受容体が刺激され、増殖が亢進する(③)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(④)。その結果、抗がん剤でダメージを受けたがん組織は血管の新生・増生や炎症性サイトカインの産生、抗腫瘍免疫の抑制が起こる(⑤)。その結果、がん細胞の増殖が促進され、浸潤や転移が促進される(⑥)。
乳がん細胞がGM-CSF(顆粒球・マクロファージコロニー刺激因子)やケモカインのCCL3を産生して腫瘍関連マクロファージをがん組織内に動員するのをカンナビジオールが抑制する作用が報告されています。(562話参照)
腫瘍関連マクロファージの活性化抑制ではシクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(セレコックス)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)を阻害するオーラノフィンの併用が有効です。
NF-κBの活性を阻害する方法としてはIκBキナーゼを阻害するオーラノフィンやサリドマイドが有効です。
これらを併用すると、抗がん剤治療によるがん細胞の悪性進展や抗がん剤耐性を阻止する効果が期待できます。(トップの図)
| « 591)シスプラ... | 593) 若い女性... » |



