がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
495)ケトン体治療(その5):アセチル-L-カルニチンのヒストンアセチル化作用
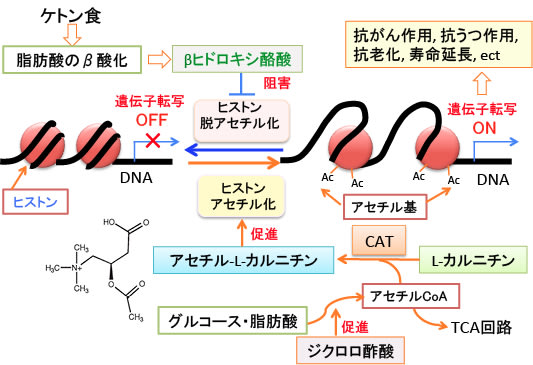
図:グルコースや脂肪酸が分解されて産生されるアセチルCoAは、ミトコンドリアのTCA回路でさらに代謝される。一部はL-カルニチンと結合してアセチル-L-カルニチンになり、ヒストンやその他のたんぱく質をアセチル化する際に使用される。ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進する。ジクロロ酢酸はピルビン酸からアセチルCoAの変換を促進する。アセチル-L-カルニチンとジクロロ酢酸はケトン食(=βヒドロキシ酪酸)の抗がん作用、抗うつ作用、抗老化作用、寿命延長作用を強化することができる。
495)ケトン体治療(その5):アセチル-L-カルニチンのヒストンアセチル化作用
【アセチル-L-カルニチンはアセチルコリンのアセチル基を供給する】
アセチル-L-カルニチン(Acetyl-L-Carnitine)はL-カルニチン(L-Carnitine)にアセチル基(CH3CO-)が結合した体内成分です。(下図)
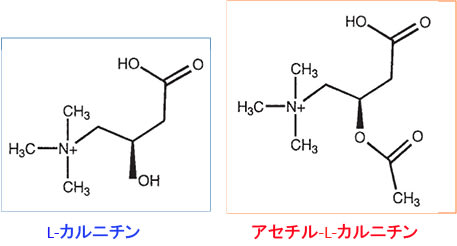
L-カルニチンは生体の脂質代謝に関与するビタミン様物質です。L-カルニチンは脂肪酸と結合し、脂肪酸をミトコンドリアの内部に運搬する役割を担っています。
脂肪酸を燃焼してエネルギーを産生する際には、脂肪酸を燃焼の場であるミトコンドリアに運ばなければなりません。中鎖脂肪酸(炭素の数が8~12個)の場合は直接ミトコンドリアに入ることができますが、長鎖脂肪酸(炭素数が13以上)の場合は、L-カルニチンが結合しないとミトコンドリアの中に入ることができません(下図)。

図:脂肪酸はミトコンドリアでβ酸化によって分解されてアセチルCoAが作られ、アセチルCoAはTCA回路で代謝されるかケトン体産生に使われる。炭素数が13以上の長鎖脂肪酸はミトコンドリアに入るのにカルニチンの助けが必要であるが、炭素数12以下の中鎖脂肪酸はカルニチンが無くてもミトコンドリアに入れる。
体内のL-カルニチンのうち約1割はアセチル-L-カルニチンの状態で存在しています。アセチル-L-カルニチンは、血液脳関門を通過して脳内に到達しアセチルコリンの量を増やします。
つまり、アセチル受容体であるコエンザイムA(CoA)にアセ チル基を転移させてアセチルCoAを生成させ、さらにそれがコリンに受け渡され、最終的にアセチルコリンが生成します。

図:アセチル-L-カルニチンのアセチル基はアセチルコリンの生成に使われる。
アセチルコリンは副交感神経や運動神経の末端から放出される神経伝達物質で、アセチルコリンの減少はアルツハイマー病との関連が指摘されています。
実際に、アセチル-L-カルニチンはアルツハイマー病初期症状の改善や進行を遅らせる効果が報告されています。高齢者の気分変調や抑うつ症状を軽減する効果や、認知能や記憶を改善する効果も報告されています。
アセチル-L-カルニチンは細胞内でL-カルニチンに変換するので、L-カルニチンと同じ効果(脂質の燃焼促進)があります。
さらに、アセチル-L-カルニチンは神経細胞のダメージの軽減や、ダメージを受けた神経細胞の修復・再生を促進する効果が報告されています。したがって、抗がん剤による神経障害の軽減にも有効です。抗がん剤の効き目を高める効果も報告されています。がん治療にもっと使用されて良いサプリメントの一つです。
【アセチル-L-カルニチンはヒストンアセチル化のアセチル基を供給する】
アセチル-L-カルニチンのアセチル基が、細胞核のヒストンのアセチル化に使われることが報告されています。以下のような論文があります。
Mitochondrial acetylcarnitine provides acetyl groups for nuclear histone acetylation.(ミトコンドリアのアセチルカルニチンが核のヒストンのアセチル化に必要なアセチル基を供給する)Epigenetics 4(6):399-403, 2009
【要旨】
細胞核のヒストンのアセチル化と脱アセチル化の調整は、染色体DNAと転写装置の相互作用の制御に重要な役割を果たしている。哺乳類の細胞核におけるヒストンのアセチル化に必要なアセチルCoAの供給源については明らかになっていない。我々は、ミトコンドリアで生成されたアセチルCoAは、カルニチン・アシルカルニチン・トランスロカーゼ(carnitine acylcarnitine translocase)の作用で細胞質に運ばれ、ついで細胞核に運ばれ、核でカルニチン・アセチルトランスフェラーゼ(carnitine acetyltransferase)によってアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となることを明らかにした。
トランスロカーゼの遺伝的欠損は、ミトコンドリアのアセチルカルニチン依存性の核ヒストンアセチル化を著明に低下させる。これはヒストンのアセチル化にカルニチン依存性のミトコンドリアのアセチル基の重要性を示唆している。
アセチル-CoAはグルコース(ブドウ糖)や脂肪酸の分解で生成されます。すなわち、グルコースが解糖系で代謝されてピルピン酸が作られ、ピルビン酸がミトコンドリアに入って、ピルビン酸脱水素酵素の働きでアセチル-CoAに変換されてTCA回路に入ります。
脂肪酸もミトコンドリアでβ酸化によって分解されてアセチル-CoAに変換されTCA回路に入ります。このとき、グルコースが枯渇しているとアセチル-CoAは肝臓でケトン体生成に使われます。
グルコース枯渇時にアセチル-CoAがケトン体に変換されるのは、アセチル-CoAが細胞膜を通れないので、細胞膜を通過できるケトン体に変換されて脳などの他の組織の細胞にエネルギー産生の原料として運ばれるためです。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われますが、このアセチル-CoAはミトコンドリアで作成され、ミトコンドリアから核への運搬にはL-カルニチンが必要ということです。この経路をまとめると以下のようになります。
図:グルコースや脂肪酸の分解によって産生されたミトコンドリア内のアセチル-CoAは、カルニチンアセチルトランスフェラーゼ(CAT)の作用により、L-カルニチンと結合してアセチル-L-カルニチンとしてミトコンドリア外の細胞質に輸送され、さらに細胞核に移行する。核に移行したアセチル-L-カルニチンは、L-カルニチンとアセチル-CoAに分解され、アセチル-CoAはヒストンアセチルトランスフェラーゼ(HAT)の作用によってヒストンをアセチル化する。
【アセチル-L-カルニチンはヒストンアセチル化作用によって抗うつ効果を示す】
アセチル-L-カルニチンはアセチル基を供給する作用によってヒストンやその他のたんぱく質のアセチル化を促進する作用があります。ヒストンのアセチル化はエピジェネシスの機序で遺伝子発現に影響します。
アセチル-L-カルニチンに抗うつ作用があることは良く知られています。この抗うつ作用がヒストンアセチル化作用と関連していることが報告されています。
以下のような論文があります。
L-acetylcarnitine causes rapid antidepressant effects through the epigenetic induction of mGlu2 receptors.(L-アセチルカルニチンはエピジェネシス機序によるmGlu2受容体の発現誘導によって急激な抗うつ効果を引き起こす)Proc Natl Acad Sci U S A. 2013 Mar 19;110(12):4804-9.
【要約】
うつ病性障害(抑うつ障害)の病態生理学に遺伝子発現のエピジェネシス機序が関与していることが知られており、うつ病のユニークな治療法のターゲットになっている。
アセチル化物質のL-アセチルカルニチン(L-acetylcarnitine ;LAC)は副作用が少なく、代謝型グルタミン酸受容体2(type 2 metabotropic glutamate receptors:mGlu2)のエピジェネシス機序による発現誘導によって抗うつ作用を示す。
遺伝的うつ病のラットモデル(Flinders Sensitive Line rats)と環境要因(慢性的に予測できないストレスによって誘導)によるマウスのうつ病モデルの両方の動物実験モデルにおいてLACは急速で長期間持続する抗うつ作用を示した。
両方の動物実験モデルにおいて、L-アセチルカルニチン(LAC)は、代謝型グルタミン酸受容体2(mGlu2)をコードするGrm2遺伝子のプロモーター領域に結合するヒストンH3の27番目アミノ酸のリシン(H3K27)のアセチル化のレベルを増やし、さらにNF-κBのp65サブユニットのアセチル化を亢進し、その結果、Grm2遺伝子の転写を促進し、海馬および前頭前皮質におけるmGlu2受容体の量を増やした。
重要な点は、L-アセチルカルニチンの3日間の投与によって、強制水泳試験における無動時間を減らし、蔗糖嗜好を増強した。一方、抗うつ剤のクロリミプラミン(chlorimipramine)は抗うつ作用を現すのに14日間を要した。
さらに、L-アセチルカルニチンの抗うつ作用は耐性が起こらず、薬剤投与を中止した2週間後も抗うつ作用を認めた。
NF-κB阻害剤はL-アセチルカルニチンによって誘導されるmGlu2発現亢進を阻害した。一方、ヒストン脱アセチル化酵素阻害剤はL-アセチルカルニチンによるエピジェネシス機序によるmGlu2発現誘導をさらに増強した。
さらに、mGlu2遺伝子を欠損させたマウスでは、慢性の予期しないストレスによって誘導される抑うつ状態をL-アセチルカルニチンは軽減しなかった。
また、mGlu2とmGlu3受容体の阻害剤(LY341495)の単回注射はL-アセチルカルニチンの抗うつ作用を部分的に阻止した。
L-アセチルカルニチンによる急速で長期間持続する抗うつ作用は、ヒトのうつ病性障害における遺伝子発現のエピジェネシス機序の関与を強く示唆し、作用の早い抗うつ剤の開発においてユニークなアプローチを示している。
抑うつに対する評価法として強制水泳テストがあります。強制水泳テストは、水を張った容器にネズミを入れ呼吸及び浮くために必要な動作以外は動かないでいる無動時間を測定する試験です。
初めは懸命に泳ぎますが、次第にあきらめて無動となりなります。この状態を「絶望状態」と呼び、10分間中の無動であった時間を計測します。
無動時間を短縮する効果は、絶望状態にさせないことを意味するので、抗うつ作用の指標になります。
スクロース嗜好試験と呼ばれる試験もあります。スクロースは蔗糖です。スクロース溶液あるいは通常の水の入ったボトルを同時にマウスにあたえスクロース溶液を飲んだ割合を測定します。
通常のマウスは甘いスクロース溶液を好んで飲みますが,うつ状態のマウスではスクロース溶液を飲む割合が少なくなります。スクロース(蔗糖)を好むようになることはうつ状態が軽減したことを意味します。
このような評価法で、L-アセチルカルニチンの抗うつ作用を証明しています。L-アセチルカルニチンはアセチル-L-カルニチンと同じです。
LACはすでに複数の臨床試験でうつ病の症状を改善することが報告されています。
気分変調性障害(抑うつ神経症や神経症性抑うつとも呼ばれる比較的軽度の慢性うつ症状)を対象にしたランダム化二重盲検試験で、L-アセチルカルニチンは抗精神病薬のアミスルピリド(amisulpride)と同等以上の有効性を示すことが報告されています。
LACは通常のヒストン脱アセチル化酵素阻害剤が示す副作用をほとんど引き起こさないので、安全性が極めて高いと考えられています。
通常、抗うつ薬の効果は十分ではなく、25〜40%のうつ病の患者が抗うつ薬による治療に抵抗性を示しています。しかも、通常の抗うつ薬がうつ病の患者の気分を改善するまでに少なくとも2〜3週間を要しています。したがって、うつ症状が深刻な患者の場合、治療の初期において自殺のリスクがあります。
この研究では、L-アセチルカルニチンが速効的に抗うつ作用を発揮し、しかも副作用もなく、長期間にわたって良好な有効性を維持することを明らかにしています。
したがって、うつ病治療薬としてALCの検討を進めるべきであり、人間におけるうつ病の発症におけるエピジェネシシ機序の関与の重要性を検討しなければならない、というのがこの論文の結論です。
【アセチル-L-カルニチンはmGlu2受容体の発現を亢進する】
記憶・学習などの高次脳機能において,グルタミン酸を認識するグルタミン酸受容体(GluR)は、神経細胞間の興奮性神経伝達に重要な役割を担っています。GluR は、イオンチャネル 型受容体(iGluR)と代謝型グルタミン酸受容体(mGluR) の2種類に大別されます。
代謝型グルタミン酸受容体(mGluR)は、我々の脳神経系に広く発現しているGタンパク質共役型受容体(GPCR)です。
記憶や学習・様々な感覚情報処理の分子基盤を担うほか、統合失調症やてんかん・不安などの精神疾患に対する治療薬のターゲットとしても注目されています。
前述の論文では、うつ病では海馬や前頭前皮質のmGlu2(代謝型グルタミン酸受容体2)が減少しており、アセチル-L-カルニチンはヒストン・アセチル化の機序によってmGlu2の発現を増やし、抗うつ作用を発揮するという結果です。
アセチル-L-カルニチンはNF-κBのp65サブユニットのアセチル化を亢進することによって、NF-κBの転写活性を亢進します。
代謝型グルタミン酸受容体2をコードしているGrm2遺伝子のプロモーター領域にはNF-κBに応答する部位(NF-κB–responsive elements)が多数存在するので、Grm2遺伝子の転写が亢進され、結果として脳の海馬と前頭前皮質の領域のmGlut2受容体の量は増えます。
NF-κBの転写活性を阻害するサリチル酸ナトリウム(sodium salicylate)を一緒に投与するとLACによるmGlu2受容体の発現亢進作用は阻止されました。これは、アセチル-L-カルニチンの作用がNF-κBの転写活性に依存することを支持しています。
この論文で重要な発見は、遺伝性うつ病のFSLラットでは、Grm2遺伝子のプロモーター領域のヒストンアセチル化が低下しており(Grm2遺伝子の転写が抑制されている)、アセチル-L-カルニチンの投与はこの領域のヒストンアセチル化を亢進したことです。
ヒストン脱アセチル化酵素阻害剤(MS-275)はLACと同様にmGlu2受容体の発現を亢進しました。これは、アセチル-L-カルニチンのヒストンアセチル化亢進作用がmGlu2受容体の発現亢進のメカニズムであることを支持しています。
うつ病の発症にエピジェネシス機序でのmGlu2受容体の遺伝子発現の異常の関与が明らかになっているので、この異常がうつ病治療のターゲットして注目されています。
mGlu2受容体の発現の制御にヒストンアセチル化が重要です。
ヒストン脱アセチル化酵素2(HDAC2)がGrm2遺伝子のプロモーター領域に結合が増えているとヒストンアセチル化が低下してGrm2遺伝子の発現が低下します。
アセチル-L-カルニチンはヒストンアセチル化を亢進してmGlu2受容体を増やして、うつ病の症状を軽減するというメカニズムです。
ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用があります。(322話参照)
したがって、ケトン食にアセチル-L-カルニチンを併用すると抗うつ作用や抗がん作用や抗老化作用を強化できます。
| « 494)ケトン体... | 496)医療大麻... » |



