がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
617)なぜ膵臓がんに抗がん剤や放射線や免疫療法が効かないのか?:結合組織増生と膵星細胞
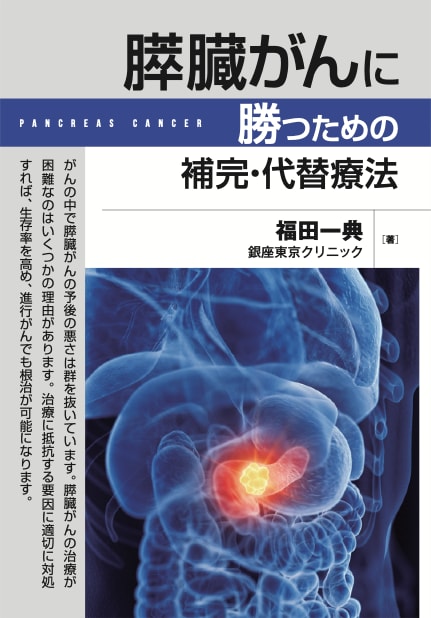
図:膵星細胞は膵臓中の主要な線維芽細胞で、組織修復を促進する細胞外マトリクス・タンパク質の合成および分解に関与し、膵腺房細胞に隣接して小膵管および血管周辺に分布している。正常状態ではビタミンA含有脂肪滴を多く含んで、静止状態になっている(①)。組織傷害や炎症反応で膵星細胞が活性化されると、脂肪滴は消失し、α平滑筋アクチンを発現して収縮性を持つ筋線維芽細胞様の形態を示す(②)。活性化した膵星細胞は増殖因子を産生してがん細胞の増殖や生存を促進し(③)、サイトカインやケモカインを産生して炎症反応を亢進する(④)。さらに、線維形成を誘導する細胞外マトリクス・タンパク質を多量に分泌する(⑤)。膵臓がん組織では間質における多量の結合組織の存在が、抗がん剤や免疫細胞の到達を阻害している(⑥)。ビタミンD3と全トランス・レチノイン酸は活性化した膵星細胞を静止状態に戻す作用がある(⑦)。
617)なぜ膵臓がんに抗がん剤や放射線や免疫療法が効かないのか?:結合組織増生と膵星細胞
【膵臓がんの3年生存率は15%、5年生存率は10%以下】
がんの中で、膵臓がんの予後の悪さは群を抜いています。
膵臓がんが比較的早期に見つかって切除ができた場合でも、生存期間の中央値は2年半程度です。切除手術を受けた膵臓がんの補助化学療法の生存期間中央値はジェムザール単独が25.5ヶ月、ジェムザール/カペシタビン併用療法が28.0ヶ月という臨床試験の結果が出ています。
原発の切除ができても、再発や転移の頻度が多いので、5年生存率は20%程度です。
しかし問題は、膵臓がんで切除手術の対象になるのは全体の2割くらいだということです。膵臓がんの80%以上はすでに切除不能か肝臓転移や腹膜播種で手術の適応にはなりません。切除不能膵臓がんに対して抗がん剤治療を行なっても、多くの患者さんの生存期間は半年~1年程度です。
切除不能膵臓がんの抗がん剤治療の臨床試験で、生存期間中央値はジェムザール単独が5.7ヶ月、ジェムザール+ナベルビンが8.5ヶ月、FOLFIRINOX療法で11.1ヶ月と報告されています。
FOLFIRINOX療法は他の抗がん剤治療に比べて延命効果が高いのですが、副作用も強いため、若くて全身状態が良好な患者さんしか使えない治療です。いずれにしても、手術不能の膵臓がんは、平均余命は1年以内となります。
膵臓がん全体では、3年生存率が15%程度、5年生存率は7〜9%程度です。ステージ4の膵臓がんの5年生存率は2%以下です。
ステージI(がんが2cm以内で膵臓内にとどまり、リンパ節転移の無いもの)にように早期の段階で見つかって手術を受けた場合は、5年生存率は50%前後と報告されていますが、このような早期の症例は膵臓がん全体の1割以下です。
現在日本では膵臓がんで亡くなる人の数は年間33000人を超えています。2016年のデータで男性は17,060人、女性は16,415人で、男女計で33,475人です。罹患数は2014年のデータで男性18,745人、女性17,411人で、男女計で36,156人です。90%以上が数年で亡くなっているようです。
男性では肺がん、胃がん、大腸がん、肝臓がんについで5番目に死亡数の多いがんです。
女性では大腸がん、肺がんに次いで3番目です。男女計では、肺がん、大腸がん、胃がんに次いで4番目です。
膵臓がんの罹患者数も死亡者数も年々増加していますが、その罹患者数と死亡者数がほとんど同じであることは、膵臓がんと診断された人のほとんどが数年以内に死亡していることを意味しています。
実際に、膵臓がんの生存期間中央値は局所進行癌では 8―12 ヵ月、転移癌では 3―6 ヵ月といわれており、診断される膵臓がんの8割が、局所進行がんあるいは転移がんなので、他のがんに比較して非常に治療成績の悪いがんと言えます。
膵臓がんが急速に増加している理由の一つは糖尿病の増加です。米国ではがん死の原因として膵臓がんは男女とも4位に位置しますが、数年後には乳がんと大腸がんを抜いて2位(1位は肺がん)になると推定されています。(詳しくは350話参照)。
飲酒や喫煙は膵臓がんの発症リスクを高めますが、飲酒や喫煙の率が低い女性が男性と同じくらいの発症率なので飲酒や喫煙以外のリスク要因が重要と思われますが、それは不明です。

図:膵臓がんの1年間の罹患数と死亡数は年々増加している。年間の罹患数と死亡数がほぼ同じということは、膵臓がん患者の90%以上は数年以内に亡くなっている現実を示している。
【膵臓がんは早期発見が困難で、周囲に広がりやすい】
膵臓がんの予後が悪いのは幾つかの理由があります。
一つは、膵臓のある場所が、早期発見と手術を困難にしているからです。
膵臓は胃や小腸や大腸や脊椎に接して隠れているために、検診などで早期に見つけようとしても腫瘍が小さい段階での発見が困難です。
膵頭部がんでは黄疸で発症するため腫瘍が比較的小さい段階で見つかる場合もありますが、膵体部や尾部では、かなり大きくなるまで症状がでないため発見が遅れます。
症状として腰痛や腹痛や体重減少が自覚されるときには、かなり進行した段階であり、このような症状が出て見つかった場合は、余命1年以内というのがほとんどです。
さらに、大きな血管や神経や胆管と接しているため、切除するためには、複雑で高度な手術技術が要求されます。大きくなった膵臓がんの多くは切除不能です。(下図)
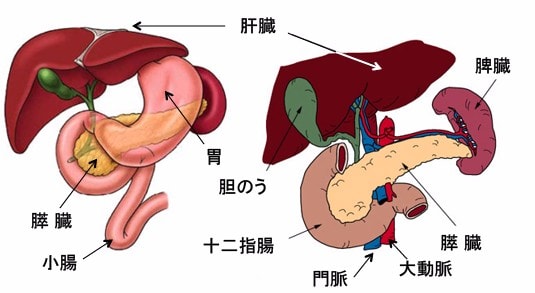
図:膵臓は周囲の臓器に囲まれて存在するという解剖学的特徴から、膵臓がんは早期に見つかりにくく、切除する場合も複雑で高度な手術技術が必要とされる。さらに、周囲組織への浸潤や転移を起こしやすいので、膵臓がんの80%以上は見つかった段階で既に手術不能の状態に進行している。
乳がんの治癒率が高いのは、乳房の解剖学的特性から、自分で気づくことも多く、マンモグラフィーなど早期診断のために有効な検査法があるからです。さらに、周囲に重要な臓器はないため切除手術は比較的簡単で、ホルモン療法や分子標的薬や、奏功率の高い抗がん剤、放射線治療など、有効な治療法が多く用意されていることも、治癒率を高める要因になっています。
膵臓がんは全くその逆です。解剖学的特徴によって早期診断と手術が極めて困難です。
がん細胞の性質としては、膵臓がんは浸潤傾向が高いがんで、神経に沿って浸潤性に広がります。
胃腸管の場合は、粘膜層、固有筋層、奨膜と行った組織が、がん細胞が他の臓器や腹膜へ直接浸潤する際のバリアになっていますが、膵臓にはこのような臓器壁のバリアがないため、発生した膵臓がんはすみやかに連続性に膵臓内および周囲組織に進展・浸潤しています(下図)。
したがって、根治手術を行なったつもりでも、術後に、高率に局所・肝・腹膜などに再発転移を起こします。

図:胃や大腸のような消化管から発生するがんは粘膜上皮細胞から発生し、粘膜層や固有筋層や奨膜と行った組織が、がん細胞が他の臓器や腹膜へ直接浸潤する際のバリアになっている。膵臓がんはこのようなバリアがないため、腹膜や周囲の臓器や組織に直接浸潤しやすい。さらに血行性に肝臓や肺への転移も起こりやすい。
膵臓がんは抗がん剤や放射線の感受性が低い(効果が弱い)ので、根治手術ができなければ、予後は極めて厳しくなります。そこで、なぜ、膵臓がんは抗がん剤や放射線治療や免疫療法が効きにくいかを理解してそれに対処しなければ、治療成績を高めることはできません。
【膵臓がんは結合組織が多いので、抗がん剤や放射線治療や免疫療法が効きにくい】
転移のある進行がんであっても、治療が効けば延命できます。
例えば、ステージ4の大腸がんでも、抗がん剤治療を行えば平均で2〜3年くらいは延命します。5年生存率は20%くらいです。しかし、ステージ4の膵臓がんは強い抗がん剤治療を行なっても生存期間中央値は6〜12ヶ月程度で、5年生存率は2%以下です。
つまり、「膵臓がん細胞は、なぜ抗がん剤や放射線や免疫療法が効かないのか」という、膵臓がんの生物学的な理由を理解する必要があります。
がん細胞自体が他の種類のがん細胞より強いのかというとそうではありません。がん細胞の性質より、間質の性質の方が重要であることが指摘されています。つまり、膵臓がん組織は「強い間質反応による結合組織の増生」というの組織学的特徴があります。
間質反応とは、がん細胞の周りに炎症細胞や線維芽細胞が増殖し、コラーゲンやヒアルロン酸が分泌されて結合組織ができ、その中に様々な間質細胞や血管が複雑に絡み合った構造ができる状態です。
この結合組織の増生はがん細胞への抗がん剤や免疫細胞への到達を妨げているから、治療効果が出ないという考えです。最近の総説論文として以下のようなものがあります。
Shattering the castle walls: Anti-stromal therapy for pancreatic cancer(城壁を粉砕する:膵がんの抗間質療法)World J Gastrointest Oncol. 2018 Aug 15; 10(8): 202–210.
【要旨】
5-フルオロウラシル、フォリン酸、イリノテカン、オキサリプラチン(FOLFIRINOX)、およびnab-パクリタキセル+ゲムシタビンなどの強力な化学療法が行なわれているが、転移のある膵臓がんにおける治療成果は依然として不十分である。
膵臓がんにおける豊富な線維性間質の存在が、抗がん剤治療が効きにくいという状態の決定的な要因であると考えられている。
明らかに、腫瘍間質は細胞傷害性薬物の腫瘍組織内への浸透を制限する物理的障壁として作用し、放射線療法の有効性を低下させる低酸素環境を作り出す。さらに、腫瘍間質は、がん細胞の増殖や進行において重要な支持的役割を果たしているので、腫瘍間質を構成する細胞性因子(例えば、膵星細胞)や非細胞性因子(例えば、ヒアルロナン)をターゲットにした薬剤の開発に研究者は注目している。本論文は、膵臓がん組織の間質の構造的特性と、がん細胞との相互作用を簡単にまとめ、転移のある膵臓がんの治療における抗間質療法(anti-stromal therapies)の現状を要約することを目的とする。
膵臓がんの病理所見の特徴の一つは間質における結合組織の増生です。結合組織の豊富な間質(desmoplastic stroma)が膵臓がんの病理所見の最大の特徴と言っても過言ではありません。(下図)

図:膵臓がん組織では、がん細胞(膵臓腺管がん細胞)を多量の結合組織が取り囲んでいる。結合組織や細胞外マトリックスは線維芽細胞や活性化した膵星細胞から産生される。
全てのがん組織にはがん細胞(実質細胞)の他に間質が存在します。間質には線維芽細胞や炎症細胞や免疫細胞のような細胞成分の他に、ヒアルロン酸(ヒアルロナン)やコラーゲン線維のような非細胞成分や、血管やリンパ管などが存在します。このような間質は、がん細胞を支持し、生存や増殖を促進する役割を担っています。
膵臓がんの間質も、その構成する細胞や非細胞成分は他のがんと基本的には同じです。ただ、間質組織の占める割合が他の固形がんに比べて極めて大きいという特徴があります。一般に、多くの膵臓がんでは間質ががん組織の80%以上を占めていると言われています。そのため、がん組織は硬くなります。
膵臓がんの間質ではヒアルロン酸(ヒアルロナン)が増えています。ヒアルロン酸はN-アセチルグルコサミンとグルクロン酸の二糖単位が連結した構造で、極めて高分子量で、水分を保持し、弾力性を高めるので、シワを消す目的で美容整形で注射されている成分と同じです。水との親水性が高い為、保水力が高く、肌のハリや弾力を保つ為には必要な成分です。変形性膝関節症などで痛みを軽減する目的で関節に注入する場合もあります。
このように水分を多量に保持する作用があるので、がん組織の間質にヒアルロン酸が増えると、がん組織の体積が増え、組織に圧力が高まります。その結果、がん組織内の血管を押しつぶして、抗がん剤や免疫細胞の到達を阻害すると考えられています。さらに、低酸素状態が強くなると放射線治療の効き目を弱めます。
結合組織の多いがんが治療成績が不良であることは、スキルス胃がんや乳がんの硬がんなどでも知られています。結合組織が増えているがんは予後不良と一般的に考えられています。したがって、がん組織の結合組織(特にヒアルロン酸)を減らす方法ががん治療法として研究されています。
【ヒアルロン酸を分解する酵素が抗がん剤の効き目を高める?】
膵臓がんの結合組織をターゲットにした膵臓がん治療が幾つも開発され、臨床試験が行なわれています。
現時点では、膵臓がん組織の結合組織のヒアルロン酸を分解する酵素が有望な治療薬として期待され、臨床試験が行なわれています。
ヒアルロン酸を分解する酵素が膵臓がんの抗がん剤治療の効果を高めることが第3相試験で確認されていますので、近いうちに膵臓がんの治療に使用されるようになると思います。この薬に関しては多数の臨床試験が行なわれています。以下のような報告があります。
HALO-109-301: a Phase III trial of PEGPH20 (with gemcitabine and nab-paclitaxel) in hyaluronic acid-high stage IV pancreatic cancer.(HALO-109-301:ヒアルロン酸が多いステージ4の膵臓がんにおけるPEGPH20とゲムシタビンとnab-パクリタキセルの第3相試験) Future Oncol. 2018 Jan;14(1):13-22. doi: 10.2217/fon-2017-0338.
HALO-109-301は臨床試験の名称です。ヒアルロン酸は、動物組織に広く存在し,ゲル状をなして細胞間および組織間をつなぐ粘度の高い結合物質で,ムコ多糖類の一種です。がん組織内で増えると、組織圧が増加して、血管が押しつぶされてがん組織への抗がん剤の到達が阻害されると考えられています。
この臨床試験では、ヒアルロン酸を分解する遺伝子組替えで作成したヒトのヒアルノニダーゼをポリエチレングリコールに結合した薬(PEGylated rHuPH20:PEGPH2)の効果を、ヒアルロン酸が多いステージ4の膵臓がん患者で検討しています。その結果、ゲムシタビンとnab-パクリタキセルを併用した抗がん剤治療の効果を高めることが示されています。
つまり、がん組織のヒアルロン酸を分解して除去すると、組織圧が低下して、血管が拡張して抗がん剤の浸透が亢進するので、抗がん剤治療が効くようになるという理由です(下図)。

図:膵臓がん組織は間質のヒアルロン酸が多く、水分を保持して組織圧が高くなって血管を押しつぶしている。そのため、抗がん剤のがん組織への到達が妨げられている。ヒアルロン酸を分解するヒアルノニダーゼをポリエチレングリコールに結合した薬(PPEGPH2)でヒアルロン酸を分解すると、組織圧が低下して血管が拡張し、抗がん剤ががん細胞に到達しやすくなる。その結果、抗がん剤の効果が高まる。
しかし、このPEGPH2とより作用の強い抗がん剤レジメのmFOLFIRINOXと併用すると全生存期間が短縮するという報告もあります。2018年の Gastrointestinal Cancers Symposium in San Francisco, Californiaでの学会発表です。
Ramanathan RK, McDonough S, Philip PA, et al. A phase IB/II randomized study of mFOLFIRINOX (mFFOX) + pegylated recombinant human hyaluronidase (PEGPH20) versus mFFOX alone in patients with good performance status metastatic pancreatic adenocarcinoma (mPC): SWOG S1313 (NCT #01959139). Oral presentation at: 2018 Gastrointestinal Cancers Symposium; January 18-20, 2018; San Francisco, CA.
この学会報告では、全身状態の良好な138例の膵臓がん患者(転移あり)を対象に、mFOLFIRINOX 単独とmFOLFIRINOX +PGEPH20併用療法で全生存期間を比較しています。
その結果、mFOLFIRINOX 単独に比べてmFOLFIRINOX +PGEPH20併用療法の全生存期間のハザード比は0.44で、生存期間中央値は、mFOLFIRINOX 単独が15.1ヶ月でmFOLFIRINOX +PGEPH20併用療法が7.6ヶ月という結果でした。しかも、PGEPH20併用の方が副作用が強かったという結果でした。
この研究は第IB/II 相研究ですが、この研究の報告者は、mFOLFIRINOX にPGEPH2を併用する第III相お臨床試験は行うべきでないと結論しています。
間質をターゲットにしたがん治療の研究は、結合組織を減らす治療法は抗がん剤の効き目を高めるという結果が多いのですが、一方で、結合組織を減らすとがんの進行が早くなるという報告もあります。結合組織はがん細胞の増殖を抑える作用をしており、結合組織が減ると、血流が良くなって増殖が促進されるという考えもあります。
つまり、がんの間質反応が必ずしも悪い結果だけでないことを示す研究結果も報告されています。
膵臓がん細胞が分泌するソニック・ヘッジホッグ(Shh)が間質反応を促進するという報告があり、この分子を欠損させた膵臓がんを作成し、間質反応がShhで誘導されるか調べる研究報告があります。結果は予想通りで、Shh欠損ガンでは間質反応が強く抑えられましたが、予想に反してがん細胞の増殖は亢進しました。この効果は血管新生を抑制すると消えるので、間質反応は血管新生を抑制してがん細胞の増殖を抑えると結論しています。
Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma.(間質の因子は膵管腺がんを支持するより阻害する) Cancer Cell. 2014 Jun 16;25(6):735-47.
つまり、間質の結合組織を減らす治療を行うときには、血管新生を阻害する治療を併用する方が良いということになります。
間質の活性化線維芽細胞を薬剤で除去できるようにしたマウスを使って、がん細胞の増殖に及ぼす線維芽細胞の役割を調べると、線維芽細胞を除去すると膵臓がん細胞の増殖が亢進するという報告もあります。
Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival.(がん関連線維芽細胞と結合組織の除去は免疫抑制を誘導し、膵臓がんの進行を促進し生存率を減少させる)Cancer Cell. 2014 Jun 16;25(6):719-34.
つまり、がん組織の間質反応を組織をがん細胞の浸潤から守る反応とも考えられるので、単純に結合組織を排除する治療が成功するとも限らないようです。
【膵臓がんの間質反応を制御する膵星細胞】
全身にビタミンA 貯蔵細胞が分布しています。最も多くビタミンAを貯蔵しているのが肝臓の星細胞です。そのほかにも、ビタミンAを貯蔵する能力のある細胞は全身の器官に分布しており,全体としてビタミンA貯蔵細胞系(星細胞系)ともいうべきシステムを構築しています。
膵臓にもビタミンAを貯蔵し、コラーゲン等の細胞外マトリックスを合成・分泌する細胞が発見され、膵臓星細胞と呼ばれ、慢性膵炎や膵臓がんにともなう線維症の責任細胞として注目されています。膵星細胞(Pancreatic Stellate Cells)は、膵臓中の主な線維芽細胞です。1998年に分離・同定されて以来、慢性膵炎や膵臓がんにおける線維化の主たる細胞外基質産生細胞であることが明らかになっています。
膵星細胞は、組織修復を促進する細胞外マトリクス・タンパク質の合成および分解に関与し、膵腺房細胞に隣接して小膵管および血管周辺に分布します。膵星細胞が活性化されると、筋線維芽細胞様の形態を示し、慢性膵炎および腺癌で線維形成を誘導する細胞外マトリクス・タンパク質を多量に分泌します。つまり、慢性膵炎や膵臓がんにおける線維形成に中心的役割を果たします。
さらに、膵星細胞は膵臓がん細胞と相互作用し、増殖因子を産生してがん細胞の増殖を刺激し、アポトーシスを阻害し、血管新生を促進します。
したがって、膵星細胞は慢性膵炎と膵臓がんの治療のターゲットとして注目されています。

図:膵星細胞は正常状態ではビタミンA含有脂肪滴を多く含んで、静止状態になっている(①)。組織傷害や炎症刺激で膵星細胞が活性化されると、脂肪滴は消失し、α平滑筋アクチンを発現して収縮性を持つ筋線維芽細胞様の形態を示す(②)。活性化した膵星細胞は増殖因子を産生してがん細胞の増殖や生存を促進し(③)、サイトカインやケモカインを産生して炎症反応を亢進し、さらに線維形成を誘導する細胞外マトリクス・タンパク質を多量に分泌する(④)。
【ビタミンDは膵星細胞の活性化を抑制する】
ビタミンDが膵臓がんの予後を良くすることは多くの報告があります。例えば、以下のような報告があります。
Expression of vitamin D receptor as a potential prognostic factor and therapeutic target in pancreatic cancer. (膵臓がんにおける予後因子および治療標的としてのビタミンD受容体の発現)Histopathology. 2015 Sep;67(3):386-97.
【要旨】
目的:ビタミンDの不足や欠乏は膵臓がん患者には一般的に見られるが、疫学的研究ではビタミンDの摂取量や血中レベルと膵臓がんの発症リスクの関連については一致した結果が得られていない。この研究の目的は、患者の生存、および膵臓がん細胞株の増殖または生存に及ぼすビタミンDの影響を調べることである。
方法と結果:本研究では、61例の患者からの膵臓正常組織およびがん組織におけるビタミンD受容体の局所的発現を調べ、ビタミンD受容体と疾患予後を含む病理学的特徴との関連を分析した。 61組の正常および腫瘍標本のうち、ビタミンD受容体はすべての正常組織で検出され、分化度の高い膵臓がんでは、62.5%(15/24)の膵臓がん組織でビタミンD受容体は強い発現を認めた。一方、分化度が中程度および低分化型のがん組織では、75.7%(28/37)において有意に低いまたは検出不能な発現レベルを示した(P = 0.004)。
さらに、小さい腫瘍(腫瘍径が25mm以下)では63.6%(14/22)においてビタミンD受容体の高発現を認めたが、大きい腫瘍(腫瘍径が 25mm以上)ではビタミンD受容体の高発現を認めたのは25.6%(10/39)であった(P = 0.06)。 Kaplan-Meier分析は、腫瘍組織におけるビタミンD受容体の低発現が予後不良と関連していることを示した(P = 0.037)。
結論:ビタミンD受容体の発現は、膵臓腺がん患者の予後因子となる可能性があり、その効果は前向き研究で調べるべきである。 ビタミンD類縁体は、がん組織における高いビタミンD受容体の発現を有し、血中のビタミンDレベルの低い患者に治療上の選択肢を提供し得うる。
ビタミンDのサプリメントでの投与が膵臓がんの治療に有効である可能性を示唆しています。また、ビタミンDが膵星細胞の活性化を抑制することが報告されています。以下のような報告があります。
Vitamin D receptor-mediated stromal reprogramming suppresses pancreatitis and enhances pancreatic cancer therapy.((ビタミンD受容体を介する間質細胞のリプログラミングは膵臓炎を抑制し、がん治療を増強する)Cell. 2014 Sep 25;159(1):80-93. doi: 10.1016/j.cell.2014.08.007.
この論文は米国のソーク研究所(Salk Institute)やコールドスプリングハーバー研究所(Cold Spring Harbor Laboratory)など10カ所以上の研究機関からの29人が著者になっており、生物系では超一流学術雑誌のCellに掲載されているので、その研究結果はかなり重要だと考えらます。
【要旨】
膵管腺がんの治療成績が不良な理由は、がん細胞の抗がん剤抵抗性と増殖を促進する腫瘍微小環境に起因する。 休止の状態から活性化された膵星細胞(pancreatic stellate cells)への変換は、膵管腺がんを特徴付ける重度の間質反応を引き起こす。
ここ研究では、ビタミンD受容体がヒト膵臓がんの間質で発現し、ビタミンD受容体のリガンドのカルシポトリオール(calcipotriol)による治療が、膵炎およびヒト膵臓がんの間質における炎症および線維化のマーカーを著しく減少させることを明らかにする。
ビタミンD受容体が膵星細胞の最重要な転写調節因子として働き、活性化した膵星細胞を静止状態に誘導して間質リモデリングを誘導する。その結果、抗がん剤単独の場合と比べて、カルシポトリオールの併用は、腫瘍内ゲムシタビンの増加、腫瘍容積の減少、および生存率の57%の増加をもたらすことを示す。
この研究は、腫瘍間質細胞の遺伝子転写の再プログラミングが化学療法応答性を高め、膵管腺がんの治療における補助物質としてのビタミンDの有用性を示唆する。
この研究では、ras遺伝子の活性型突然変異とp53癌抑制遺伝子欠損を膵管細胞で誘導して、人間の膵臓がんに近いがんを発生させるモデルを使っています。
がん組織から膵臓の間質反応に重要な細胞として知られている膵星細胞を分離して遺伝子発現を比べ、ビタミンD受容体が、マウスでもヒトでも膵星細胞に強く発現している事を明らかにしています。
このビタミンD受容体は間質細胞で発現しており、炎症における組織化に関与していると考えられています。従って膵星細胞での発現の意味を調べるために、ビタミンD受容体をcalcipotriolという薬剤で刺激すると、星細胞の活性化状態が収まり、元々の脂肪を貯めた細胞の形に戻りました。さらに、マウスの膵臓炎症も同じ薬剤で押さえられる事が明らかになりました。
すなわち、ビタミンD受容体の刺激は膵星細胞の活性化を押さえ、炎症を抑える働きがあるということです。
同じように膵臓がんで起こってくる膵臓の炎症性変化に対するビタミンD受容体刺激の効果を調べると、炎症や線維化が強く押さえられる事が示されました。
さらに、膵臓がんをジェムシタビンで治療するモデル実験系でビタミンD受容体刺激を行なうと生存期間が約50%伸びることが示されています。
以上をまとめると、膵星細胞が活性化されると、様々な炎症性因子を分泌し間質反応を促進し、がん細胞の増殖も促進されるが、これをビタミンD受容体刺激で押さえる事ができるということです。
ビタミンD3のサプリメントを大量に服用して膵臓がんの進行が止まった状態で長く維持したいという症例報告があります。
Published Online:1 May 2016https://doi.org/10.1089/crpc.2016.0003
83歳女性の膵臓がん患者が、ビタミンD3のサプリメントを通常の量の10倍以上に相等する1日に50,000 IUを自分の判断で服用したところ、他の治療を受けずにがんの進行が長期間(報告するまでの10ヶ月間)止まったという症例報告です。副作用は全く認められていません。
進行した膵臓がんの代替療法として1日1万単位程度のビタミンD3の服用を試してみる価値はあると思います。
【全トランス・レチノイン酸は膵星細胞の活性化を抑制する】
レチノイドが膵星細胞の活性化を抑制することが報告されています。
ATRA modulates mechanical activation of TGF-β by pancreatic stellate cells.(全トランス・レチノイン酸は膵星細胞によるTGF-βの活性化メカニズムを制御する)Sci Rep. 2016 Jul 4;6:27639. doi: 10.1038/srep27639.
【要旨の抜粋】
膵管腺がんの特徴は、がん細胞を取りまく多量の結合組織の増生であり、この結合組織の産生は膵星細胞によって制御されている。
正常状態では膵星細胞は活動を停止しているが、膵臓がんの進行に伴って活性化すると、収縮性の性質を持つ筋線維芽細胞に変化し、細胞外マトリックスを産生して硬い結合組織を作る。
膵星細胞はトランスフォーミング増殖因子β(TGF-β)を活性化する。その活性化は、TGF-βとTGF-β結合タンパク質(LTBP)との不活性複合体からTGF-βを遊離することによって行なわれる。
オートクリン(自己分泌)機序で、膵星細胞はTGF-βを活性化し、活性化したTGF-βは膵星細胞をさらに活性化する。
全トランス・レチノイン酸(ATRA)は膵星細胞を不活性な静止状態に誘導することによってTGF-βの活性化を阻止し、結合組織の産生を抑制する。
全トランス・レチノイン酸は膵星細胞によるTGF-βの活性化を阻止してオートクリン機序による膵星細胞の活性化を阻止するということです。
ATRA mechanically reprograms pancreatic stellate cells to suppress matrix remodelling aninhibit cancer cell invasion.(全トランス・レチノイン酸は、膵星細胞を再プログラム化して、細胞外マトリックスの再構成を抑制し、がん細胞浸潤を抑制する) Nat Commun. 2016 Sep 7;7:12630.
この論文では、ビタミンAの活性代謝産物である全トランス・レチノイン酸(ATRA)が、レチノイン酸受容体ベータ(RAR-β)依存性に膵星細胞を静止状態に回復する作用があることを報告しています。
現在、膵臓がんの間質をターゲットにした治療で、ビタミンDとレチノイドの組合せの治療が臨床試験で検討されています。そこでビタミンDとレチノイドの関係を知っておく必要があります。
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。
レチノイドは生体内では活性型であるオールトランス・レチノイン酸(All-trans retinoic acid :ATRA)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやペルオキシソーム増殖因子活性化受容体(PPAR)やビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。
リガンドというのは、受容体に特異的に結合してその受容体を活性化する物質です。「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体です。
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるオールトランス・レチノイン酸 (ATRA) と 9-シス-レチノイン酸 (9-cis RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9-cis RAのみです。異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物です。レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9-cis RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9-cis RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。すなわち、炭素間に二重結合がある所で「シス型」と「トランス型」という2種類の構造を取ります。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)

図:オールトランス・レチノイン酸(All-trans RA)と9-シス・レチノイン酸(9-cis RA)と13-シス・レチノイン酸(13-cis RA)の3つの分子式は同じであるが、立体構造が異なる。二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並び、シス型の2重結合のところで炭化水素の鎖は曲がる。
All-trans RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。この立体構造の違いによって分子式は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子とは細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったオールトランスレチノイン酸(ATRA)は急性前骨髄球性白血病の特効薬になっています。急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でオールトランスレチノイン酸に変換されて効果を発揮します(下図)。オールトランスレチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるオールトランス・レチノイン酸(All-trans RA)はレチノイン酸受容体(retinoic acid receptor: RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。レチノイン酸の異性体である9-シス・レチノイン酸(9-cis RA)はレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-シス・レチノイン酸(13-cis RA:イソトレチノイン)はプロドラッグであり、細胞内でオールトランス・レチノイン酸に変換されて、同様の遺伝子発現の調節を行う。
ビタミンD受容体とレチノイン酸受容体はヘテロダイマーを形成して、一緒になって遺伝子発現に関与します。(370話)
【膵臓がんの抗がん剤治療はやっても多くは無駄かもしれない】
膵臓がんの病理学的特徴を理解すると、抗がん剤治療も免疫療法も多くは効果が出にくいということが理解できます。
膵臓がん細胞は、防弾チョッキの上に鎧を着ているようの状態、あるいは強固な要塞の中にいるような状況にあります。一方、正常細胞はそのような防御手段は持っていません。無防備です。このような状況で抗がん剤治療を行なうと、がん細胞の死滅より正常細胞の犠牲の方が多くなります(下図)。
強い抗がん剤治療を行なえば、がん細胞も多少は死滅し、画像や腫瘍マーカーでがんの縮小が見られます。しかし、それ以上に正常細胞のダメージが強くなり、体力や抵抗力は徐々に低下していきます。強い抗がん剤治療を繰り返えしても、がんが消滅することはなく、いずれ体力の限界が来ます。体力の限界が来るまでの期間は、若くて体力があれば2〜3年くらいですが、高齢だったり体力が無ければ1年以下です。進行がんの抗がん剤治療は体力勝負です。
膵臓がん細胞は豊富な間質で守られている以上、抗がん剤も免疫療法もほとんど効きません。抗がん剤も免疫細胞も膵臓がん細胞には到達できないからです。

図:膵臓がん細胞は鎧を着て強固な要塞に守られている状態にある。正常細胞は爆撃(抗がん剤)に対して無防備状態である。このような状況で空爆(抗がん剤治療)を行っても正常細胞の犠牲の方が多く、ほとんどメリットは無い。
理論的に考察すると、無駄な抗がん剤治療は止めて、がん細胞の増殖刺激(増殖因子や炎症性サイトカイン)を減らし、血流をさらに減らす(血管新生阻害剤など)方法を組み合せて、膵臓がん細胞の増殖活性を阻止する方が良いというのが、私の結論です。
膵臓がん細胞の増殖を刺激する増殖因子を産生している膵星細胞を静止状態に誘導するビタミンD3のサプリメントと、レチノイドのイソトレチノイン(13-シス・レチノイン酸)の併用は抗腫瘍効果が期待できます。
ビタミンD3のサプリメントは1日1〜5万国際単位くらい使用します。
レチノイドの全トランス・レチノイン酸は前骨髄性白血病の治療薬として入手できますが、高額であるのと副作用が強いので、ニキビの治療薬として使用されている13-シス・レチノイン酸(1日20mg程度)で代用します。13-シス・レチノイン酸は体内で全トランス・レチノイン酸に変換されます。ATRAより安価で副作用も軽微です。
血管新生阻害にはサリドマイド、COX-2阻害剤のセレコックス(celecoxib)、低用量(50mg/日)のシクロホスファミドが有効です。サリドマイドには、TNF-αとNF-κBを阻害する作用もあります。
さらに、IL-6/JAK/STAT3経路を阻害するジインドリルメタン、オーラノフィンも有効です。このような正常細胞にほとんど害の及ばない方法で、膵臓がん細胞の増殖活性を抑えて、膵臓がんと共存する方法を試してみる価値はあります。

図:膵臓がん組織では炎症応答が起こっている(①)。炎症反応で産生されるIL-1βやTNF-αや活性酸素は炎症性転写因子のNF-κBを活性化し、IL-6遺伝子の発現を亢進する(②)。炎症応答でTGFβ(Transforming Growth Factor β)とCOX-2(シクロオキシゲナーゼ-2)の発現が誘導され、COX-2はPGE2(プロスタグランジンE2)の産生を高める。TGFβとPGE2はIL-6の産生を亢進する(③)。IL-6はIL-6受容体を介してJAK(ヤーヌスキナーゼ)を活性化し、細胞の増殖と生存を制御するSTAT3経路、PI3K/AKT経路、MAPK経路を活性化する(④)。その結果、がん細胞の増殖や転移やアポトーシス抵抗性が促進される(⑤)。PGE2は直接的に作用してがん細胞の増殖や転移を促進する(⑥)。セレコキシブはCOX-2活性を阻害し(⑦)、オーラノフィンはSTAT3の活性を阻害する(⑧)。ジインドリルメタンはJAK/STAT3経路を阻害し(⑨)、サリドマイドとオーラノフィンはTNF-αの発現とIκBキナーゼを阻害してNF-κBを阻害する(⑩)。低用量のシクロホスファミドは血管新生阻害作用と免疫増強作用(骨髄由来抑制細胞の阻害)があり(⑪)、ビタミンD3とレチノイドは膵星細胞の活性化を阻止して増殖因子を減らし、間質反応を抑制する(⑫)
膵臓がんの補完・補完代替療法は多数の種類があります。その一部を以下の書籍でまとめています。
| « 616)骨髄由来... | 618)膵臓がん... » |