がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
607)ミトコンドリアをターゲットにしたがん治療:ジクロロ酢酸とメトホルミンと2-デオキシグルコース
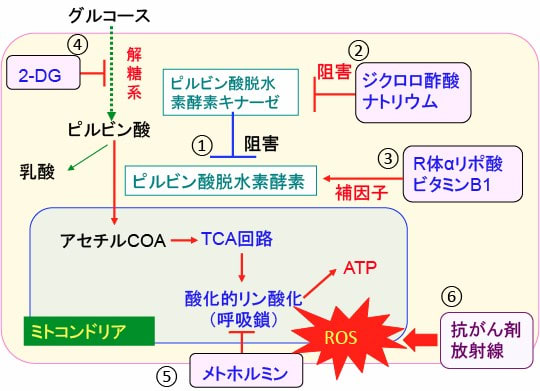
図:がん細胞ではピルビン酸脱水素酵素キナーゼの発現と活性が亢進してピルビン酸脱水素酵素の活性を阻害している(①)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害する(②)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働く(③)。ジクロロ酢酸ナトリウムとR体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性を高めて、ピルビン酸からアセチルCoAの変換を亢進してミトコンドリアでの代謝を亢進する。2−デオキシ-D-グルコース(2-DG)は解糖系を阻害する(④)。メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアでのATP産生を低下させ、活性酸素の産生を亢進する(⑤)。抗がん剤や放射線治療も活性酸素の産生を亢進する(⑥)。したがって、これらの組合せは相乗効果が期待できる。
607)ミトコンドリアをターゲットにしたがん治療:ジクロロ酢酸とメトホルミンと2-デオキシグルコース
【がんの代替医療ではミトコンドリアをターゲットにした治療法が増えている】
このブログで「ワールブルグ(Warburg)」と「ジクロロ酢酸」の名前が最初に出て来るのは2008年3月30日の『69話:がん細胞のワールブルグ効果と生薬の抗腫瘍効果』です。10年以上前です。
がん細胞のエネルギー産生は細胞質における解糖に依存しているため、解糖系酵素を阻害する薬はがん細胞をエネルギー枯渇に陥らせて殺す作用が期待できる可能性を解説しています。その頃、がんの漢方治療で使用される半枝蓮(ハンシレン)が解糖系酵素を阻害する作用があることが報告されています(66話参照)。そこで、半枝蓮の抗腫瘍効果のメカニズムの一つとして、解糖系の阻害を考察しています。
つまり、私が代謝やミトコンドリアをターゲットにした治療に興味を持ったきっかけは、抗がん生薬の代表である半枝蓮による抗がん作用のメカニズムとして、がん細胞で亢進している解糖系の阻害作用が報告されたからです。
その後、半枝蓮は解糖系だけでなくミトコンドリアの酸化的リン酸化も阻害して、がん細胞の解糖系と酸化的リン酸化を阻害して、エネルギー枯渇を引き起こして死滅させることが報告されています。(303話参照)
この頃(2007年)の総説論文に以下のような論文があります。
Metabolic targeting as an anticancer strategy: dawn of a new era?(抗がん戦略として代謝を標的にする:新しい時代の幕開け?)Sci STKE. 2007 Apr 10;2007(381):pe14.
【要旨】
一連のミトコンドリア異常の結果として、腫瘍細胞は酸素が存在する場合でも、解糖系を選択的に使ってしてアデノシン三リン酸(ATP)を生成する場合が多い。この現象は好気性解糖または「ワールブルク効果」として知られている。
ピルビン酸脱水素酵素キナーゼ(PDK)は、ピルビン酸がミトコンドリアのトリカルボン酸(TCA)回路へ入る経路の門番となるピルビン酸脱水素酵素(PDH)を阻害する。ジクロロ酢酸(DCA)はこのミトコンドリアPDKの阻害剤である。
マウスを使った実験では、ジクロロ酢酸(DCA)投与により、がん細胞内でミトコンドリア呼吸が再活性化され、がん細胞が選択的に死滅され、がんの増殖が抑制される。
これらの観察結果は、がん細胞の代謝の可塑性に関して興味深い考えを提供し、新たな治療法の開発につながるかもしれない。
2007年から2008年にかけて、ジクロロ酢酸がミトコンドリアを活性化して、がん細胞を死滅する作用が報告されています。以下の論文は、ジクロロ酢酸の抗腫瘍効果を最初に報告したカナダのアルバータ(Alberta)大学のMichelakis博士の総説です。
Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer.(がんの代謝をターゲットにした治療法としてのジクロロ酢酸)Br J Cancer. 2008 Oct 7;99(7):989-94.
【要旨】
大部分の固形腫瘍に見られる特異な代謝(好気性解糖、すなわちワーバーグ(Warburg)効果)は、代謝イメージングによるがんの診断(注:PET検査のこと)の基礎であるだけでなく、がん細胞を特徴付けるアポトーシスに対する抵抗性と関連している可能性がある。
がん細胞における解糖系亢進は、がん細胞における多様な機能異常の共通点であり、ミトコンドリア機能の(潜在的で可逆的な)抑制と関連している可能性がある。
ジェネリック医薬品のジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害することによりピルビン酸のミトコンドリアへの流入を増加させ、解糖に対してミトコンドリアでのグルコース酸化を促進する経口利用が可能な小分子の薬剤である。
ジクロロ酢酸は、がん細胞において抑制されているミトコンドリアを介したアポトーシスに対する抵抗性を阻止し、インビトロ(in vitro)およびインビボ(in vivo)での腫瘍増殖の抑制をもたらす。
ここでは、この有望な代謝調節物質の臨床試験を早く行なう必要性を支持する科学的および臨床的根拠を考察する。
つまり、2007年ころから、ワールブルグ効果を主体とする「代謝をターゲットにしたがん治療」の可能性が認識され初め、そのきっかけがピルビン酸脱水素酵素を活性化してミトコンドリアを活性化するジクロロ酢酸であったことが判ります。
【ジクロロ酢酸はミトコンドリアを活性化してがん細胞の増殖を抑制する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります(下図)。
小児のミトコンドリア病の乳酸アシドーシスの治療薬として古くから使用されており、水に容易に溶解するので、バイオアベイラビリティ(生体利用率)も高い物質です。移植腫瘍などの動物実験でも、経口投与で抗腫瘍作用が証明されています。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。
がん細胞では低酸素誘導因子-1(HIF-1)の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生(酸化的リン酸化)が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(下図)。

図:がん細胞では、低酸素や増殖シグナル(PI3K/Akt/mTOR)の活性化によって低酸素誘導因子-1(HIF-1)の発現が亢進している(①)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導して(②)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害する(③)ので、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。HIF-1は解糖系酵素や乳酸脱水素酵素の発現を亢進して解糖系代謝と乳酸産生を亢進する作用もある(⑤)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高め、ピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑥)。ミトコンドリアでの酸化的リン酸化が亢進すると(⑦)、活性酸素の産生が増えてがん細胞が死滅する(⑧)。ジクロロ酢酸ナトリウムでミトコンドリアが活性化されるとHIF-1の活性が抑制される機序も報告されている。
がん細胞のミトコンドリアでの酸素呼吸を亢進すると、がん細胞の増殖が抑制できます。十分に酸化ストレスを高めれば、がん細胞を死滅させることもできます。(506話参照)
ジクロロ酢酸はがん細胞の酸化ストレスを高めてがん細胞を死滅させる「がんの酸化治療」の中心になる薬です(352話)。
【メトホルミンとジクロロ酢酸の相乗効果】
メトホルミンとジクロロ酢酸の抗がん作用は併用することによって相乗効果が期待できます。以下のような論文が発表されています。
Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells.(メトホルミンで治療した乳がん細胞において、ジクロロ酢酸は酸化傷害によるアポトーシスを促進し、乳酸産生を低下させる)Breast Cancer Res Treat. 2014 Oct;147(3):539-50.
【要旨】
乳がん細胞における代謝の特徴を治療に利用することが注目されている。乳がんに対して確実な治療効果を示すことが報告されているメトホルミンはミトコンドリアの呼吸鎖の複合体1を阻害して活性酸素の産生を増やしてがん細胞を死滅させる。
呼吸酵素複合体1を阻害すると、解糖系における乳酸の産生が増える。乳酸の産生増加はがん組織の酸性化などによってがんの治療効果を弱めるので予後を悪くする。
乳酸の産生を抑制すればメトホルミンによるがん細胞のアポトーシス誘導作用は増強されると予想される。乳酸アシドーシスの治療に使われるジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する酵素)を活性化してミトコンドリアの活性を高める。
そこで、メトホルミンとジクロロ酢酸は乳がん細胞のアポトーシス誘導において相乗効果が得られるかどうかとそのメカニズムを検討した。
実験の結果、ジクロロ酢酸とメトホルミンを併用すると、乳がん細胞のアポトーシス誘導を相乗的に高めることができた。
メトホルミンによる酸化傷害はジクロロ酢酸ナトリウムによって増強され、メトホルミン投与によって誘導される乳酸産生は阻止された。
すなわち、メトホルミンとジクロロ酢酸の併用はがん細胞の酸化傷害を増強し、乳酸の産生を減らし、カスパーゼ依存性のアポトーシスを増強させる。したがって、この組合せは乳がんの治療法として効果が期待できる。
この論文の結果をまとめると以下の図のようになります。

図:がん細胞では低酸素誘導因子-1(HIF-1)が恒常的に活性化しており、ピルビン酸脱水素酵素キナーゼ(①)と乳酸脱水素酵素(②)の活性が亢進して、解糖系が亢進し、ミトコンドリアでの酸素呼吸が抑制されている。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めて、ミトコンドリアでの酸素呼吸を亢進する(③)。メトホルミンは呼吸酵素複合体Iを阻害してATP産生を阻害し、同時に活性酸素の産生を高める(④)。したがって、メトホルミンとジクロロ酢酸の併用は、がん細胞において活性酸素の産生を高めて、酸化ストレスを亢進し、細胞増殖を抑制し、細胞死を誘導する(⑤)。
がん細胞では、HIF-1(低酸素誘導因子-1)の作用によって乳酸脱水素酵素やピルビン酸脱水素酵素キナーゼ(ピルビン酸脱水素酵素をリン酸化して阻害する酵素)の活性が亢進しているため、ミトコンドリアでのATP産生は低下し、解糖系が亢進して乳酸の産生が増えています。
メトホルミンはミトコンドリアの呼吸酵素複合体1をターゲットにして阻害するため、ATP産生が阻害され、同時に活性酸素の発生が増えます。活性酸素が増えるとミトコンドリアが破綻して細胞のアポトーシスが起こります。
メトホルミンでミトコンドリアでのATP産生が低下すると、それを代償するために解糖系が亢進し乳酸の産生が増えます。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害する作用によってピルビン酸脱水素酵素を活性化してミトコンドリアでのTCA回路を回します。その結果、メトホルミンによって生じる乳酸の産生増加が阻止され、ミトコンドリアでの活性酸素の産生が増えて、アポトーシスが増強されます。
また、乳酸の産生が減れば、がん組織の酸性化が軽減され、様々なメカニズムでがん細胞の増殖が抑制できます。
つまり、この2つの薬を併用するとがん細胞のアポトーシス誘導が増強されるというメカニズムです。別の研究グループから同様な報告があります。
Sensitization of metformin-cytotoxicity by dichloroacetate via reprogramming glucose metabolism in cancer cells.(がん細胞におけるグルコース代謝の再プログラミングを介するジクロロ酢酸によるメトホルミンの細胞毒性の増強)Cancer Lett. 2014 May 1;346(2):300-8.
【要旨】
メトホルミンによる細胞毒性の感受性を高める効果を検討する目的で、がん細胞をピルビン酸脱水素酵素キナーゼの阻害剤であるジクロロ酢酸で処理した。
メトホルミンの細胞毒性は主にグルコースの使用可能性(availability)とペントースリン酸経路によって産生される還元能(NADPH)に依存しているが、ジクロロ酢酸を同時に投与すると、ジクロロ酢酸によるピルビン酸脱水素酵素キナーゼの阻害とミトコンドリアでの呼吸の亢進によってグルコース代謝の再プログラミング(=正常化)が起こり、メトホルミンの細胞毒性が増強される。
グルコースとグルタチオンの濃度が高い状態でも、メトホルミンとジクロロ酢酸の同時投与は細胞死を誘導する。
以上をまとめると、ジクロロ酢酸はグルコース代謝を再プログラミング(正常化)して、好気生解糖からミトコンドリアでの呼吸に変更することによって、メトホルミンの細胞毒性を増強する。
グルコース代謝の再プログラミング(reprogramming)というのは、がん細胞の特徴であるワールブルグ効果(酸素があっても解糖系でのグルコース代謝が亢進し、ミトコンドリアでの代謝が低下している)を正常化(初期化)するということです。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めることによってミトコンドリアでの呼吸(酸素を使ったATP産生)が活性化され、解糖系でのATP産生は抑制されることになります。
一方、メトホルミンはミトコンドリアの呼吸酵素複合体1の働きを阻害するので、ATP産生は阻害され、活性酸素の発生が増加します。
がん細胞ではもともとミトコンドリアでの酸素を使った代謝が低下しているので、メトホルミン単独では細胞を死滅させる作用が弱いのですが、ジクロロ酢酸でミトコンドリアにおける酸素利用を高めれば、がん細胞は酸化傷害によって死滅するというストーリーです。
【メトホルミンと2-デオキシグルコースとジクロロ酢酸による抗がん作用】
2-デオキシ-D-グルコース(2-DG)はグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用があります。
したがって、2-DGとメトホルミンを併用すると、がん細胞のエネルギー産生を阻害する効果を高めることができます。実際に、マウスの移植腫瘍の実験モデルで、2-DGとメトホルミンを併用すると相乗的な抗腫瘍効果が得られることが報告されています。(Mol Cancer Ther. 10(12): 2350-2362, 2011年)
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果は得られませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。
様々な種類のがん細胞をマウスに移植した動物実験において、2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は弱いのですが、この2つを併用すると強い腫瘍縮小効果が認められています。すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
体内の乳酸は肝臓で糖新生に使われます。メトホルミンは肝臓での糖新生を抑えるので、乳酸アシドーシスを引き起こす副作用があります。乳酸が増えて、血液が酸性になる状態です。
大きながん組織があると乳酸の産生が増えています。乳酸アシドーシスを防ぐために、肝臓では乳酸をブドウ糖に変換する糖新生が亢進します。メトホルミンは糖新生を阻害する効果があるので、乳酸産生の増加した状態でメトホルミンを服用すると乳酸アシドーシスを起こしやすくなるのです。
ジクロロ酢酸はピルビン酸脱水素酵素の活性を高め、ミトコンドリアでの酸素呼吸を亢進します。その結果、乳酸の産生を抑え、メトホルミンによる乳酸アシドーシスの発生を防ぐことができます。特にジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に古くから使用されています。
つまり、2-デオキシグルコースとメトホルミンとジクロロ酢酸(+ビタミンB1とR体αリポ酸)を併用すると、がん細胞のエネルギー産生と乳酸産生を抑制し、がん細胞の増殖を抑制できます。メトホルミン使用時の乳酸アシドーシスの予防にも有効です。
つまり、乳酸産生抑制を目的としたがん治療法として、メトホルミンと2-デオキシグルコースとジクロロ酢酸は試してみる価値はあります。有効性を実感しており、副作用はほとんど経験しません。
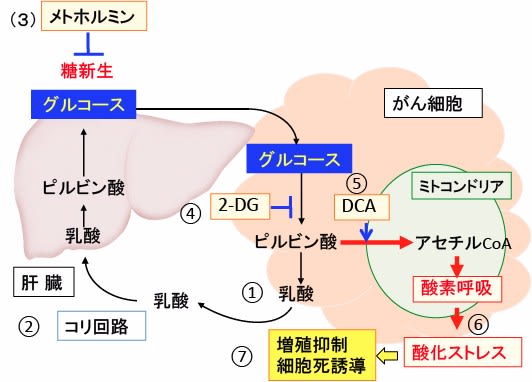
図: がん細胞は解糖系が亢進して乳酸の産生が増えている(①)。乳酸によるアシドーシス(酸性血症)を防ぐため、肝臓で乳酸をグルコースに変換する。これをコリ回路という(②)。メトホルミンは糖新生を阻害するので、乳酸アシドーシスの副作用を起こしやすい(③)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(④)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(⑤)。その結果、2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぎ、活性酸素の産生を高めて酸化ストレスを亢進する(⑥)。これらは相乗効果で、乳酸産生を抑制し、がん細胞の酸化ストレスを亢進し、乳酸アシドーシスの副作用を起こさずに、がん細胞の増殖を抑制できる(⑦)。
【Celecoxib(セレコックス)がジクロロ酢酸の抗腫瘍効果を高める】
以下のような論文があります。
Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells(シクロオキシゲナーゼ2の阻害は子宮頚がん細胞におけるジクロロ酢酸の感受性を増強する)Oncotarget. 2017 Aug 1; 8(31): 51748–51757.
【要旨】
ミトコンドリア機能を高めるジクロロ酢酸は、子宮頚がんを含む多くの悪性腫瘍の治療において、抗がん剤感受性を高める増感剤として有望な可能性を示している。しかし、子宮頚がんに対するジクロロ酢酸単独の効果については不明である。
さらに、以前の報告は、シクロオキシゲナーゼ-2(COX2)発現の増加が、化学療法抵抗性および子宮頚がの予後不良と関連することを実証している。しかし、COX2が子宮頚がん細胞におけるジクロロ酢酸の感受性に影響を与えるかどうかは依然として不明である。
この研究では、子宮頚がん細胞がジクロロ酢酸に対して感受性が無いことがわかった。さらに、ジクロロ酢酸が子宮頚がん細胞のCOX-2の発現を亢進し、子宮頸がん細胞におけるジクロロ酢酸の化学感受性を妨げていることを初めて明らかにした。
メカニズムに関する研究は、ジクロロ酢酸がRNA binding protein quaking(QKI)のレベルを低下させ、COX2 mRNAの分解を抑制してCOX2タンパク質の増加を引き起こすことを示した。
COX2阻害剤のセレコキシブの併用は、インビトロおよびインビボの両方の実験系でジクロロ酢酸に対する子宮頚がん細胞の感受性を高め、子宮頸がん細胞の増殖を抑制した。
これらの結果は、COX2がジクロロ酢酸の新規な抵抗因子であり、セレコキシブとDCAとの組み合わせが子宮頚がんの治療に有益であり得ることを示している。
RNA binding protein quaking(QKI)はRNA結合タンパク質で、mRNA前駆体のスプライシング、mRNAの輸送、安定性、翻訳、miRNAのプロセシング、環状RNAの形成などに関与しています。
ジクロロ酢酸(DCA)は子宮頚がん細胞にアポトーシスを誘導できますが、DCAはCOX2の発現を増加し、COX-2は子宮頚がん細胞のDCA感受性を低下させます。その機序としてDCAはCOX2のmRNAの安定性を亢進して、COX2たんぱく質を増やすと報告しています。
それで、COX2阻害剤のcelecoxibは、DCAの抗腫瘍効果を高めることができるという理由です。
つまり、子宮頚がんを含めて、抗がん剤に対するがん細胞の感受性を高める目的でジクロロ酢酸を併用するときはシクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(商品名:セレコックス)を併用するのが良いということです。
以上のことから、ジクロロ酢酸+メトホルミン+2デオキシグルコースの組合せにCOX-2阻害剤のcelecoxib(セレコックス)を併用すると抗腫瘍効果を高めることができそうです。
【ジクロロ酢酸ナトリウムを使った治療はがんの代替医療としてかなり有効】
ジクロロ酢酸(DCA)は1988年以降、小児のミトコンドリア病や乳酸アシドーシスの治療に使われています。安全性は確認されています。
がん細胞では酸素が存在する状況でも、ミトコンドリアでの酸素呼吸が抑制され、解糖系が亢進し、乳酸の産生が亢進しています。この状態を好気性解糖やワールブルグ効果と言います。
がん細胞の乳酸産生を抑える治療は、がん細胞の増殖を抑制できます。その方法として、ジクロロ酢酸、2-デオキシグルコース、メトホルミンの組合せが有効です。さらに酸化ストレスを高めるジスルフィラムやオーラノフィンなどの併用も有効です。(511話参照)
非ステロイド性抗炎症剤のスリンダクとジクロロ酢酸ナトリウムを併用すると酸化ストレスを高めて、がん細胞を死滅させるという報告があります。(365話参照)
ジクロロ酢酸ナトリウム(DCA)の使い方は以下のようになります。
1日に体重1kg当たり10から15mgで、1〜2回に分けて服用します。
注意する副作用は末梢神経障害です。この副作用を予防(軽減)するために、ビタミンB1製剤のベンフォチアミン、アセチル-L-カルニチン、R体αリポ酸を併用します。
1日量が体重1kg当たり10〜15mgで毎日服用か、少し多め(15〜20mg/kg)で2週間服用して1週間休むというサイクルでの服用など幾つかのレジメで使用されています。
DCAは熱で不活性化しやすいので、水に溶かして服用します。胃粘膜に刺激になるので食後に服用します。
ジクロロ酢酸ナトリウムと併用して抗腫瘍効果を高める方法として、ケトン食、2−デオキシ-D-グルコース、メトホルミン、ジスルフィラム、オーラノフィン、スリンダクなどがあります。
がん細胞のミトコンドリアを活性化して活性酸素の産生を高め、酸化ストレスを亢進して、がん細胞の増殖を抑え、アポトーシスを誘導する治療法は試してみる価値があると思います。
具体的方法については以下のサイトをご参照下さい。
http://www.ketogenic-diet.org/oxidation-therapy/ketogenic-diet+oxidation-therapy.html
標準治療では、まだ代謝やミトコンドリアをターゲットにした治療法はありません。しかし、自由診療の代替療法では、既存の医薬品で代謝やミトコンドリアに作用するものが多数あり、これらを併用すると「代謝やミトコンドリアをターゲットにしたがん治療」が実践できます。しかし、標準治療では保険適用外使用ができないので、メトホルミンやジスルフィラムやオーラノフィンやスリンダクをがん治療に使用できません。
これが、代謝やミトコンドリアをターゲットにした治療法ががんの代替医療では盛んに実践されていて、標準治療で実践できない理由です。
| « 606)乳酸はが... | 608)漢方治療... » |



