左図: ①がん組織内ではシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している。②COX-2はプロスタグランジンE2(PGE2)の産生を増やし、PGE2は免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する。③一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増える。④この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する。⑤がん細胞は解糖系が亢進し、乳酸や水素イオンの産生が増え、がん組織は酸性化している。組織の酸性化は、免疫担当細胞の働きを抑制するが、骨髄由来抑制細胞の働きは活性化する。したがって、PGE2の産生やがん組織の酸性化や骨髄由来抑制細胞の動員を阻止すれば、がん細胞を攻撃・排除する免疫担当細胞の働きを高めることができる。
右図:⑥がん細胞はグルコースの取込みと解糖系が亢進し、⑦乳酸と水素イオン(プロトン)の産生が増え、細胞外に排出される。⑧細胞外に排出された乳酸と水素イオンはがん組織を酸性化し、Tリンパ球やNK細胞や樹状細胞などの免疫担当細胞の働きを阻害する。⑨一方、乳酸やプロトン(H+)の産生増加によってpHが低下し酸性になると骨髄由来抑制細胞が動員され活性が亢進する。⑩骨髄由来抑制細胞は制御性T細胞を誘導して免疫担当細胞の働きを阻害する。
このような複数のメカニズムでがん組織内ではエフェクター細胞の働きは抑制され、がん細胞を排除できない環境になっている。
【イミキモドは樹状細胞の働きを高める】
樹状細胞はトル様受容体(TLR)を介して活性化されると、貪食作用、成熟、流域リンパ節への移動、Th1サイトカインの分泌、リンパ球への抗原提示能が亢進します。
TLRのアゴニストはがんの免疫療法において有望な治療薬となりうると考えられており、多くの物質が臨床使用に向けて開発中です。
腫瘍局所にTLRアゴニストを投与すると、自然免疫と獲得免疫を誘導し、さらに腫瘍の微小環境に様々な作用を及ぼして、腫瘍を免疫学的に排除することができます。
TLRアゴニストは樹状細胞を活性化し、T細胞応答を増強し、制御性T細胞の免疫抑制作用を減弱させるので、がんワクチン療法の効果を増強します。
樹状細胞が死滅したがん細胞を取り込んで、タンパク質を分解してペプチドにしてMHCに乗せて抗原を提示し、この抗原にぴったり結合する受容体(T細胞抗原認識受容体:TCR)をもつナイーブヘルパーT細胞やナイーブキラーT細胞が活性化されます。
これがT細胞の抗原特異的な活性化です。
樹状細胞が提示している抗原とぴったり合うTCRをもつナイーブT細胞は極めて少数です。そのため、出会いの確率を増やすためには、樹状細胞は動き回るしかありません。
樹状細胞を成熟させ、さらに活性化する方法として最近注目されているのが、
TLR7のリガンドである
イミキモドです。イミキモドについては
451話で解説しています。
イミキモド(Imiquimod)は合成イミダゾキノリン(imidazoquinoline)で、樹状細胞やマクロファージなどに発現しているTLR7(Toll-like receptor 7)にリガンドとして直接結合し、シグナルを伝えることによって、I型インターフェロンを誘導し自然免疫を活性化します。
I型インターフェロンとはインターフェロンファミリーのうち、インターフェロンα(IFN-α)とインターフェロンβ(IFN-β)などを含めた総称で、ウイルス感染で誘導される抗ウイルス作用をもつサイトカインです。免疫系細胞から分泌されてマクロファージを活性化するインターフェロンγ(IFN-γ)はII型インターフェロンと言います。
I型インターフェロンは抗原提示、T細胞増殖、樹状細胞の成熟、ナチュラルキラー細胞の活性化を促進します。
イミキモドは欧米では塗布薬(5% imiquimodクリーム)として販売され、基底細胞がんや尖圭コンジローマに対して使用され、さらに日光角化症、ボーエン病など表在性の皮膚悪性腫瘍でも有効性が認められています。
欧米で実施された基底細胞がんを対象にした臨床試験では、表在型基底細胞がんに対し6週間毎日または5回/週の外用で、80%前後の腫瘍の病理学的消失率が認められています。
このような皮膚がんに対する効果は、イミキモドがTLR7のアゴニストで、自然免疫を活性化して、皮膚がんに対する特異免疫を誘導して、免疫機序で腫瘍を縮小・消滅させるためと考えられています。
したがって、皮膚がん以外の転移性皮膚腫瘍に対しても効果が期待でき、実際に、乳がんの皮膚転移に有効であった症例報告や臨床試験の結果が報告されています。悪性黒色腫の皮膚転移を縮小させる効果も報告されています。
さらには、皮膚投与でイミキモドが腫瘍近くのリンパ節に取り込ませることも可能なので、皮膚転移以外の原発部位や転移のがんにも抗腫瘍効果が期待できます。
イミキモドクリームの外用で体内の腫瘍に対する抗腫瘍免疫が活性化することが報告されています。
【イミキモドクリームの外用でグリオーマが縮小する】
イミキモドクリームを皮膚に塗布すると、皮下の樹状細胞が活性化して、離れた部位の腫瘍が縮小する効果が動物実験で示されています。以下のような報告があります。
Topical imiquimod has therapeutic and immunomodulatory effects against intracranial tumors.(イミキモドの外用投与は頭蓋内腫瘍に対して治療効果および免疫調整効果を有する)J Immunother. 34(3): 264-269, 2011
【要旨】
イミキモドクリーム(商品名:Aldara)はトル様受容体7(TLR7)のアゴニストで、皮膚腫瘍の治療に認可されている。さらにAldaraは、グリオーマやその他の腫瘍に対するワクチン療法において補助療法として使用され、臨床試験が行われている。
Aldaraを皮膚に塗布すると、塗布した部分のTLR7陽性細胞を刺激する。
この論文では、マウスの実験において、Aldaraの皮膚塗布による投与が頭蓋内腫瘍を免疫機序によって縮小させるという予想外の結果を得たので報告する。
Aldaraを皮膚に繰り返し塗布すると、グリオーマ細胞(GL261)および乳がん細胞(EMT6)を頭蓋内に移植したマウスの生存期間を顕著に延長した。
Aldara投与は血中および脳腫瘍部位におけるCD4(+)Foxp3(+)制御制T細胞の数を減少させた。
Aldaraで治療したマウスは、血中のリンパ球は減少していたが、頭蓋内腫瘍の組織内ではCD4(+)T細胞とCD8(+)T細胞と樹状細胞の数が増えていた。
腫瘍内に浸潤したCD8(+)T細胞は腫瘍細胞(GL261)に依存性に脱顆粒とインターフェロン-γ分泌を行うことが確認され、腫瘍細胞に反応性のキラーT細胞であった。
さらに、可溶化したイミキモドはGL261細胞の増殖をTLR7依存性の機序で直接的に阻害した。
この報告は、皮膚塗布によるイミキモドが頭蓋内腫瘍に対するT細胞の反応を促進することを確認した最初のものである。
マウスとヒトの種の違いがあるから、ヒトでも効果があるかどうかは慎重に検討する必要がある。
Aldaraは臨床試験でワクチン治療のアジュバンド(免疫賦活剤)として使用されているが、Aldaraは単独でも外来性抗原の存在とは関係なく直接的な抗腫瘍効果を示す可能性が示唆された。人間でのさらなる研究が必要である。
CD4(+)T細胞はヘルパーT細胞、CD8(+)T細胞はキラーT細胞です。CD4(+)Foxp3(+)はT細胞の働きを抑制する制御性T細胞のマーカーです。
グリオーマ細胞にも幾つかのTLRを発現しており、例えばリポ多糖で活性化されるTLR4を刺激するとグリオーマ細胞の増殖が亢進されることが報告されています。TLR2とTLR9の刺激もグリオーマ細胞の増殖を促進します。
TLR7はグリオーマに発現していて、TLR7の刺激はがん細胞の増殖を抑制する方向で作用するという結果です。
Aldaraは5%イミキモド・クリームの商品名です。現在はジェネリックも販売されています。米国ではFDAが皮膚がんなどの治療に認可しています。
一般的には、イミキモドを皮膚の腫瘍の部分に塗布すると、樹状細胞が活性化され、がん細胞に対する抗腫瘍免疫が活性化されて、皮膚のがんを排除するという作用機序が推測されています。
さらに、皮膚に転移した乳がんなどでも、腫瘍がある部分にイミキモドを塗布するとがんを縮小あるいは排除できる例が報告されています。
イミキモドはトル様受容体7(TLR7)のリガンドで樹状細胞を活性化して、がん細胞に対するT細胞の作用を亢進して、抗腫瘍免疫を活性化します。
そのため、がんワクチンの効き目を高めるアジュバントとしても使用されています。
アジュバント (Adjuvant) とは、ラテン語の adjuvare(助ける)に由来し、医学領域では「効果を高める(増強する)」という意味で免疫学やがん治療の領域で使用される用語です。
マウスに蛋白抗原で免疫するとき、蛋白抗原だけを投与しても弱い免疫反応しか起こりませんが、蛋白抗原に少し細菌の菌体成分を混ぜると免疫反応が強く起こる現象が昔から知られており、このような免疫附活剤(アジュバント)のことを「little dirty secret」と呼んでいました。抗原に汚いものを少し混ぜるのが免疫反応を起こすコツということです。
アジュバントは免疫賦活剤や免疫刺激剤などと呼ばれるもので、抗原に対する免疫応答を促進させ、獲得免疫を増強する物質の総称です。その多くは細菌菌体由来の物質ですが、これはトル様受容体を活性化して自然免疫を活性化することが獲得免疫を亢進するために必要であることを意味しています。
がんに対する免疫反応を強く起こすためには、自然免疫を活性化するアジュバントが重要な役割を果たすと考えられています。
細菌やウイルスなどの微生物が侵入すると、宿主にはない構造(病原体関連分子パターン)をトル様受容体が認識して、まず自然免疫が活性化かれ、抗原提示がスムーズに行われ、獲得免疫が効率的に発動されます。
しかし、がん細胞が持つ変異タンパク質を抗原として認識する場合、自然免疫が活性化されないので、十分に獲得免疫が発動しません。そのためがんに対する免疫療法の効果を高めるには、樹状細胞の働きを亢進して自然免疫を発動させるために、アジュバントによって免疫応答の活性化を助ける必要があります。
この報告ではイミキモドはがんワクチンと併用しなくても単独で抗腫瘍効果を示すということも言っています。
【イミキモドの外用で肺の樹状細胞とNK細胞が活性化する】
イミキモドクリームを皮膚に外用塗布すると、肺組織の免疫活性が増強することが報告されています。以下のような報告があります。
Skin TLR7 triggering promotes accumulation of respiratory dendritic cells and natural killer cells.(皮膚のTLR7の活性化は肺組織の樹状細胞とナチュラルキラー細胞の集積を促進する)
PLoS One. 2012;7(8):e43320. doi: 10.1371/journal.pone.0043320. Epub 2012 Aug 22.
【要旨】
トル様受容体7(TLR7)アゴニストのイミキモドは、ウイルス関連性のいぼや基底細胞がんの治療のアジュバンドとして使用され、効果を発揮している。
皮膚のTLR7の活性化が肺組織の白血球の働きに対する影響については知られていない。
プラセボを対象にした動物実験で、イミキモドを皮膚に塗布した後の肺組織の白血球組成をマルチカラー・フローサイトメトリー法を用いて系統的に解析した。
プラセボ群に比べて、イミキモドを皮膚に投与した群では、肺組織の樹状細胞とナチュラルキラー細胞の数が顕著に増加していた。しかし、白血球の総数、肺胞マクロファージ、CD4+ヘルパーT細胞、CD8+キラーT細胞の数はほとんど変化を認めなかった。
肺組織の樹状細胞の増加は、単球性樹状細胞(monocytic dendritic cell)とCD11b(hi)樹状細胞の増加によるものであった。
リンパ球の亜分画の解析では、肺組織のナチュラルキラー細胞の顕著な増加とB細胞の顕著な減少を認めた。
低用量のTLR7リガンドでの7日間の刺激後、クレブシエラ肺炎桿菌で刺激した後の肺組織の白血球が産生するサイトカインの解析では、IFN-γとTNF-αの発現の低下、IL-10とIL-12p70の発現増加を認めた。
一方、肺組織の病理所見や気管支肺胞細胞の数には変化がなく、これは皮膚のTLR7の刺激が、肺組織の炎症に影響を与えずに肺組織の白血球組成に影響することを示唆している。
これらの結果は、クレブシエラ肺炎桿菌のような病原体に対する肺組織の白血球組成やサイトカイン産生が、臨床的に認可されているTLR7リガンドの皮膚への投与によって影響を受けることを示唆している。以上の結果より、合成TLR7リガンドの皮膚投与は、呼吸器の免疫応答を調節する目的で新規で非浸襲的な手段になりうる可能性がある。
樹状細胞は全身を回って、抗原を提示する働きがあります。
イミキモドは皮下の樹状細胞を刺激して成熟・活性化させ、この活性化した樹状細胞が流域のリンパ節や血中に入って、病原菌やがん細胞などに対する獲得免疫の発動に働いています。
したがって、樹状細胞の成熟や活性化に有効なTLR7のリガンドのイミキモドの外用は他の部位の腫瘍に対する免疫療法にも有効です。
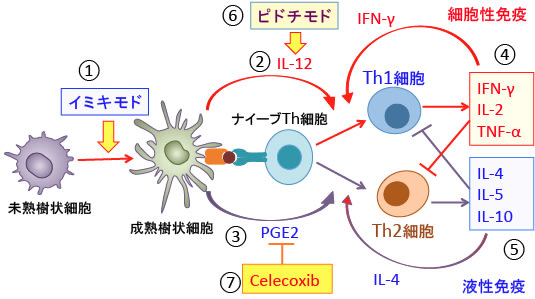
例えば、リンパの流れから、がん組織が存在する部位の近くや、流域リンパ節の近くの皮膚にイミキモドクリームを塗布することは効果が期待できます。鼠蹊部や頚部や腋下のリンパ節の周囲や、がん性胸膜炎や腹膜炎の場合は胸や腹の皮膚に塗布するといった具合です。さらに、樹状細胞の成熟を促進し、IL-12の産生を増やすピドチモドを併用するとさらに樹状細胞の活性化を増強できます。
【術後に感染症を合併すると生存率が高くなる】
骨肉腫を対象にした臨床研究で、手術後に感染症を合併した患者の生存率が極端に良いという報告があります。例えば、以下のような報告があります。
Postoperative infection and survival in osteosarcoma patients: Reconsideration of immunotherapy for osteosarcoma.(骨肉腫患者における術後感染症と生存率:骨肉腫に対する免疫療法の再考)Mol Clin Oncol. 2015 May;3(3):495-500.
【要旨】
骨肉腫患者における長期予後における感染症の関与に関しては相反する意見がある。この問題に関する臨床研究や基礎研究に基づいて、骨肉腫患者の免疫療法に関して再検討をする必要がある。
125例の骨肉腫の患者の臨床経過を検討した。平均追跡期間は5.1±3.9年(0.5-19.8年)であった。
慢性的な限局した感染(全身的な感染症ではない)は6例(4.8%)に見られた。感染のある群とない群の2群の間に、抗がん剤治療のレジメや組織学的反応の違いは認めなかった。
感染群では脛骨近位端の腫瘍が多かった。感染群では、感染症のコントロールが困難であったため、切断せざるを得なかった症例が多かった。
感染群の5年後の全生存率と無再発生存率はいずれも100%であった。非感染群では、5年後の全生存率は54%、無再発生存率は43%であった。
これらの結果は、骨肉腫の患者において、感染症の発症は患者の生存にプラスに作用することを示している。しかし、機序については不明である。
骨肉腫患者の予後と感染症との関連を再検討することは、新規の治療手段の開発に役立つと思われる。
感染群の症例が少ないので、まだ結論を出すには不十分ですが、術後に感染症を起こさなかったグループでは5年間再発しなかったのは43%に対して、感染症を起こしたグループでは全員が5年間再発しなかったので、術後感染症の発症が再発予防に寄与していると推測しています。
感染症の発症は自然免疫を発動させます。がん細胞に対する抗原特異的な獲得免疫の成立には自然免疫の活性化が必須です。
したがって、手術後の感染症の発症が、自然免疫を活性化し、さらにがん細胞に対する獲得免疫を促進して、再発を抑制している可能性が示唆されています。
がん細胞に対する獲得免疫が働くためにはToll様受容体などを介した自然免疫の作動が必要であることが明らかになっています。
死んだ細菌の成分を注射で投与するとがん細胞に対する免疫が増強することが100年以上前から知られています。有名はものとしてはコーリー毒素(Coley toxin)があります。
ウィリアム・コーリー(William Coley)はがんに対する免疫療法で先駆的な研究を行った医師です。肉腫の患者が丹毒にかかって高熱を出したあとに腫瘍が消失した症例を経験し、死んだ化膿レンサ球菌とセラチア菌の混合物を注射する治療を行い、著効例を多く報告しています。
当時はそのメカニズムは不明でしたが、現在では、「自然免疫の活性化ががん抗原に対する獲得免疫を活性化して、腫瘍が消滅した」と解釈できます。
コーリー毒素と同様な機序でがんを縮小させようというのが、BCGやOK-432(ピシバニール)や丸山ワクチンです。
コーリーの免疫療法は効果はあったのですが、手術や放射線治療の発達によって、効果が不確実な免疫療法は次第に重視されなくなりました。
しかし、近年の免疫学の知識を活用すれば、より効果の高い免疫療法が可能になってきました。
つまり、自然免疫と獲得免疫の両方を活性化することと、免疫抑制性のメカニズム(骨髄由来抑制細胞、制御性T細胞、PD-1/PD-L1、CTLA-4、免疫抑制性のサイトカインやケモカインなど)を十分に抑制できれば、免疫療法も十分な効果が期待できます。
元来、樹状細胞やマクロファージは身内の細胞であるがん細胞に対してはあまり積極的に異物として認識しない寛容の状態(tolerogenic state)にあります。そこで自然免疫を活性化する目的でTLRのアゴニストが抗腫瘍免疫を高める目的で使用されています。
ダメージ関連分子パターン(DAMPs)を発現させる細胞死の誘導(
447話参照)と、マクロファージやNK細胞を活性化して、がん細胞の対する自然免疫を活性化すると、サイトカインの産生や樹状細胞による抗原提示が促進され、がん抗原特異的な獲得免疫が活性化されることが明らかになっています。