がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
453)抗腫瘍免疫の増強法(その9):シクロフォスファミド

上パネル:①高用量の抗がん剤治療によってがん組織がダメージを受けると、ダメージを受けた組織を修復するために、がん組織中にがん関連線維芽細胞が増える。②がん関連線維芽細胞からケモカインや増殖因子が産生され、③これらの因子は骨髄の血管内皮前駆細胞や炎症細胞をがん組織に動員する。④その結果、抗がん剤でダメージを受けたがん組織は血管の新生・増生や炎症性サイトカインの産生、酸化ストレスの亢進が起こる。⑤その結果、がん細胞の増殖が促進され、浸潤や転移が促進される。⑥高用量の抗がん剤治療は樹状細胞やリンパ球やナチュラルキラー細胞(NK細胞)などの免疫細胞の働きを阻害する。⑦免疫細胞が正常に働かないと、がん細胞の増殖や転移を防ぐことができない。
下パネル:⑧低用量の抗がん剤投与はキラーT細胞を抑制する制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)の活性を阻害する作用がある。⑨その結果、がん細胞を排除するキラーT細胞など抗腫瘍免疫が増強される。⑩低用量の抗がん剤は血管新生を阻害する作用がある。規則的に低用量の抗がん剤を頻回に投与していくメトロノミック・ケモテラピーに、自然免疫や獲得免疫を活性化する方法を併用すると、免疫機序でがんを排除できる可能性が高まる。
453)抗腫瘍免疫の増強法(その9):シクロフォスファミド
【標準治療の抗がん剤治療は免疫力を犠牲にしている】
標準治療における抗がん剤治療は、最大耐用量(副作用に耐えられる最大量)の抗がん剤を投与することが基本になっています。
患者さんが副作用に耐えられる(死なない)範囲で最大限の投与量を設定するのが最も腫瘍の縮小効果(奏功率)が高いというのが、最大耐用量を投与する根拠になっています。
この方法は白血病や悪性リンパ腫のように抗がん剤が効きやすい腫瘍の場合は有効ですが、抗がん剤が効きにくい腫瘍の場合は、むしろ高用量の抗がん剤投与は、正常細胞のダメージによる副作用が強くなるだけでなく、がん細胞の増殖や浸潤や転移を刺激する可能性が指摘されています。
例えば、高用量の抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいるがん関連線維芽細胞などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。このような因子によって血管内皮前駆細胞が骨髄から動員されて、血管形成が促進されて、がん細胞の増殖や転移が促進することが明らかになっています。(397話参照)
骨髄の血管内皮前駆細胞はケモカイン受容体のCXCR4を持っているので、がん組織から産生されるケモカインのCXCL12によってがん組織に動員されて血管新生が促進されます(406話参照)。
抗がん剤投与ががん細胞の増殖能や浸潤能を高めることも指摘されています。
さらに、最大耐用量の抗がん剤投与はリンパ球やナチュラルキラー細胞や樹状細胞などの免疫細胞の働きを阻害します。(トップの図参照)
抗がん剤治療でがん細胞が死滅すると、その死骸を樹状細胞が取り込んで、がん抗原をリンパ球に提示します。抗原特異的な獲得免疫が発動すれば、免疫細胞による腫瘍の排除が促進されます。しかし、高用量の抗がん剤を投与している限り、免疫細胞は働くことができません。
免疫力を犠牲にして高用量の抗がん剤をやみくもに使用する戦略だけでなく、低用量の抗がん剤と免疫増強を組み合せた戦略も検討する必要があります。

図:通常の抗がん剤治療は、副作用に耐えられる最大量(最大耐用量)の抗がん剤を投与する。この場合、正常組織へのダメージも強いので副作用も強く現れる。また、正常組織のダメージを回復させる必要があるため、抗がん剤投与の間に休薬期間が必要であるが、この休薬期間に腫瘍血管が急速に再生し、生き残ったがん細胞が増殖する。がん組織のダメージは、がん関連線維芽細胞や血管内皮前駆細胞を動員する。抗がん剤が効きにくい強いがん細胞が選択的に生き残るので、がん組織は次第に抗がん剤が効きにくい細胞が多くなってくる。
【低用量のシクロフォスファミドはワクチン療法の効果を増強する】
シクロフォスファミド(商品名:エンドキサン)はナイトロジェンマスタードの流れをくむアルキル化剤で、DNAをアルキル化してがん細胞(分裂している細胞)を死滅させます。
がん治療の場合は、1日100~200mgの服用で、自己免疫疾患の場合は1日50mg程度の低用量を服用します。
低用量の場合は、免疫細胞や炎症細胞の働きを抑制して炎症反応を抑える作用(抗炎症作用)によって自己免疫疾患を治療します。
シクロフォスファミドは、自己免疫疾患に使用されるのとほぼ同じ服用量が、がんのメトロノミック・ケモテラピーでも使用されています。
メトロノミック・ケモテラピー(Metronomic Chemotherapy)とは、メトロノームのように規則的に低用量の抗がん剤を頻回に投与していく抗がん剤治療法です。(397話参照)
メトロノミック・ケモテラピーではがん細胞を死滅させるのではなく、がん間質の細胞に作用して炎症性サイトカインの産生や血管新生を阻害することによって抗腫瘍効果を得ることを目標にしています。
自己免疫疾患(膠原病)の治療に炎症細胞や血管内皮細胞や線維芽細胞の働きを抑制することが有効なのと同様に、がん組織に存在する炎症細胞や血管内皮細胞や線維芽細胞の働きを抑制するとがん細胞自体の増殖や転移も抑制できることが明らかになっています。
シクロフォスファミドの低用量投与ががんワクチンの効果を高めることが報告されています。以下のような報告があります。
Metronomic cyclophosphamide enhances HPV16E7 peptide vaccine induced antigen-specific and cytotoxic T-cell mediated antitumor immune response.(メトロノミック投与のシクロフォスファミドはHPV16E7ペプチド・ワクチンで誘導した抗原特異的な細胞傷害性T細胞による抗腫瘍免疫を増強する)Oncoimmunology. 2014 Nov 14;3(8):e953407.
【要旨】
腫瘍組織による免疫抑制状態を抑制する目的でメトロノミック(低用量頻回投与)なシクロフォスファミドの併用が、多くの臨床試験で検討されている。
本研究では、ヒトパピローマウイルス(HPV16)で誘導した腫瘍モデルにおけるHPV16E7をターゲットにしたペプチドワクチンとメトロノミックなシクロフォスファミド投与との併用の効果を検討した。
C3 腫瘍を移植したマウスに隔週でシクロフォスファミドのメトロノミック投与を行い、HPV16E749-57ペプチド抗原を含むDepoVaxワクチンを3週ごとに投与した。
ワクチンとシクロフォスファミドの併用群で腫瘍増殖の顕著な抑制を認めた。
メトロノミックなシクロフォスファミド投与はリンパ節のリンパ球を顕著に減らす作用を示したが、ワクチンで誘導される抗原特異的なCD8+T細胞(キラーT細胞)の増殖は抑制しなかった。
ワクチンとメトロノミックなシクロフォスファミド投与を受けたマウスの脾臓のリンパ球は腫瘍細胞を死滅させる活性を亢進していた。この抗腫瘍活性は、ワクチンとメトロノミックなシクロフォスファミド投与を受けた腫瘍を移植したマウスから採取したCD8+キラーT細胞によって、別のマウスに移行できた。
Low-dose cyclophosphamide administered as daily or single dose enhances the antitumor effects of a therapeutic HPV vaccine.(低用量のシクロフォスファミドの連日投与あるいは1回投与は治療目的のヒトパピローマウイルス・ワクチンの抗腫瘍効果を増強する)Cancer Immunol Immunother. 62(1):171-82. 2013年
【要旨】
ヒトパピローマウイルス(HPV)ワクチンは、HPVに特異的な全身性の免疫応答を引き起こすが、その臨床効果はワクチン誘導性のCD8陽性T細胞(キラーT細胞)のレベルとは必ずしも相関しない。その理由として、腫瘍組織における免疫抑制性の微小環境の存在が指摘されている。
細胞傷害性T細胞(CD8陽性T細胞)の働きを阻害する細胞として制御性T細胞(Treg)が知られている。
シクロフォスファミドは抗がん剤の一種で、Tregを含めて免疫細胞を減らす作用がある。ワクチン治療に併用して適度な量のシクロフォスファミドを使うと、ワクチン誘導性のT細胞応答は抑制せずに、Tregだけを減らすことができる。しかし、シクロフォスファミドの投与量や投与法(投与スケジュール)については十分に検討されていない。
そこで、HPVワクチンと併用してシクロフォスファミドを使用する場合の用量や投与スケジュールについて、動物モデル(HPV腫瘍を移植したマウス)を用いて検討した。
シクロフォスファミドの単回投与と連日投与は、HPVワクチンと併用することによって、相乗的な抗腫瘍効果を認めた。
この抗腫瘍効果のメカニズムとして制御性T細胞(Treg)の数の減少と、抗原特異的CD8陽性T細胞の腫瘍内浸潤の増加が示唆された。CD8陽性T細胞とTregあるいは骨髄由来抑制細胞(MDSCs)の比(CD8+/TregとCD8+/MDSCs)はシクロフォスファミドの併用によって上昇した。
シクロフォスファミドの連日投与は、ワクチン誘導性のCD8陽性T細胞の数を減らす傾向を認めた。
以上の結果から、シクロフォスファミドはワクチンを投与する前に単回で投与する方が、連日投与より有効で、しかも簡便で、ワクチン誘導性のT細胞の活性化にも悪影響を及ぼさないことが明らかになった。
腫瘍を移植したマウスの実験系で、メトロノミックなシクロフォスファミドは免疫機能が正常なマウスでは抗腫瘍効果を示し、免疫不全マウス(ヌードマウス)で抗腫瘍効果が認められなかったという実験結果が報告されています。
これは、シクロフォスファミドを低用量で用いた場合の抗腫瘍効果は、がん細胞に対する直接的な作用や血管新生阻害作用とは関係なく、免疫細胞による作用であることを示唆しています。
腫瘍組織には制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)が増えており、これらの細胞がCD8陽性のキラーT細胞(細胞傷害性T細胞)の働きを阻害するので、がんワクチンを使ってがん抗原特異的なキラーT細胞が増えても、がん細胞を死滅させることができません。
そこで、TregやMDSCを減らす方法が抗腫瘍免疫を高める上で大切になってきます。
このような抑制性の免疫細胞を減らす方法としてメチオニン・エンケファリン(445話参照)、シメチジン(449話)、セレコキシブ(446話)などがあります。
さらに、低用量のシクロフォスファミドは実際にがんワクチンとの併用で多くの研究が報告されています。ただし、投与量が多いと抗原特異的なキラーT細胞も抑制して免疫抑制状態になります。したがって、シクロフォスファミドの投与量と投与スケジュールが重要になります。
他の報告では、低用量連日投与(メトロノミック)で有効という報告もありますが、この論文では、ワクチンを投与する前の単回投与が良いという結果でした。
シクロフォスファミドは投与量が多いと、キラーT細胞やナチュラルキラー(NK)細胞などエフェクター細胞も抑制されますが、適度な量だと、キラーT細胞やNK細胞は抑制せず、制御性T細胞や骨髄由来抑制細胞の働きを抑制して、抗腫瘍免疫を高めることができます。
ただ、この「適度な量」というのが問題です。
自己免疫疾患の治療で使われる量は細胞傷害性T細胞の活性を抑制する量であるため、それよりも少ない量が良いのかもしれません。
間歇的な投与が良いという報告があります。
【低用量のシクロフォスファスファミド単独で大きな腫瘍が消滅する】
シクロフォスファミドのメトロノミック投与が、抗腫瘍免疫を活性化して、大きな腫瘍を消滅できるという実験結果も報告されています。以下のような報告があります。
Metronomic cyclophosphamide eradicates large implanted GL261 gliomas by activating antitumor Cd8+ T-cell responses and immune memory.(シクロフォスファミドのメトロノミック投与は、抗腫瘍性のCD8陽性T細胞応答と免疫記憶を活性化することによって、大きなGL261グリオーマ移植腫瘍を消滅させる)Oncoimmunology. 2015 Feb 18;4(4):e1005521. eCollection 2015.
【要旨】
細胞毒性のある抗がん剤治療は免疫原性細胞死を誘導する。しかし、大きな腫瘍を免疫細胞だけの作用で縮小させ、しかも長期間の免疫記憶を成立させるために有効な方法は確立されていない。
免疫系が正常なマウスにGL261グリオーマ細胞を移植した実験系を用い、6日おきのシクロフォスファミドのメトロノミック投与の効果を検討した。
シクロフォスファミドの6日おきのメトロノミック投与の2サイクルの治療で、腫瘍細胞特異的なCD8陽性細胞傷害性T細胞(CTL)とナチュラルキラー(NK)細胞、マクロファージ、その他の免疫細胞を増やし、活性化した。
このようなCTLやNK細胞といったエフェクター細胞はシクロフォスファミド投与の6日後にピークになりその後減少した。制御性T細胞の数はCTLやNK細胞と逆の動きを示した。
間歇的なシクロフォスファミドを数回繰り返すことによって腫瘍は縮小し、消滅した。
腫瘍の消滅にはCD8陽性キラーT細胞(CTL)が必要であった。GL261細胞の再移植に対して、末梢血中のCTLの増加と腫瘍組織でのCTLの浸潤が認められ、抗原特異的な免疫記憶が成立していた。
以上の結果から、抗がん剤のシクロフォスファミドの単独の投与でも、その投与量と投与スケジュールを適切化すれば、大きな腫瘍を縮小させ、さらに消滅させ、免疫記憶を成立させることも可能であることが示された。
シクロフォスファミドを使ったメトロノミック・ケモテラピーは血管新生阻害作用によって抗腫瘍効果を示すと考えられています。しかしながら、最近の研究では、自然免疫の活性化など免疫機能を介したメカニズムの関与が指摘されています。
この研究グループは、がん抗原特異的なキラーT細胞の活性化と移植腫瘍の縮小に、シクロフォスファミドの間歇的な投薬スケジュールが有効だと報告しています。
シクロフォスファミドで死滅すると免疫細胞が認識しやすい免疫原性細胞死を誘導します。
高用量だと、免疫原性細胞死を誘導しますが、免疫系も抑制されます。また、がん組織がダメージを受けると血管新生が促進され、がん組織の増大を招く場合もあります。
一方、低用量のメトロノミック投与の場合、免疫原性細胞死は起こりにくいのですが、血管新生が起こらず、骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)の活性は抑制され、細胞傷害性T細胞(CTL)やナチュラルキラー(NK)細胞は抑制されないので、抗原特異的な抗腫瘍免疫を活性化することができます。
つまり、低用量のメトロノミック投与は、最大耐用量を投与する通常の抗がん剤治療とは異なるメカニズムで腫瘍縮小効果を発揮します。
しかも、免疫記憶が成立するので、再発を予防できることになります。
低用量頻回(メトロノミック)あるいは間歇的なシクロフォスファミド投与と、樹状細胞の活性化による自然免疫の発動(イミキモド、ピドチモド)と、抗原特異的な細胞傷害性T細胞の活性化をサポートする方法(COX-2阻害剤、シメチジン、漢方薬など)を組み合わせると、免疫機序での腫瘍の排除ができるかもしれません。

図:①抗がん剤のシクロフォスファミドは高用量でがん細胞の免疫原性細胞死を引き起こすが、低用量では細胞死は誘導できない。②腫瘍組織の血管新生は低用量で阻害されるが、高用量では、細胞死によって産生されるサイトカインや増殖因子によってむしろ血管新生が促進される。③T細胞の働きを抑制する骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)はシクロフォスファミドの低用量で活性が抑制され、高用量でも細胞死によって活性が抑制される。④低用量ではMDSCとTregの活性低下によって、細胞傷害性T細胞(CTL)とナチュラルキラー細胞(NK細胞)の活性は亢進するが、高用量では細胞死によって抑制される。
【抗がん剤治療は免疫原性細胞死(immunogenic cell death)を起こす】
シクロフォスファミドなどの抗がん剤は通常の壊死やアポトーシスに比べて免疫応答を惹起しやすい形でがん細胞を死滅させます。このような細胞死は免疫原性細胞死(Immunogenic cell death)と呼ばれています。
何らかのダメージやストレスで細胞が傷害されたときは、それを認識して対応する必要があります。細胞がダメージを受けたとき、そのような細胞からは通常であれば細胞内に隠れている成分が放出され、炎症細胞や免疫細胞を活性化するメカニズムが存在します。
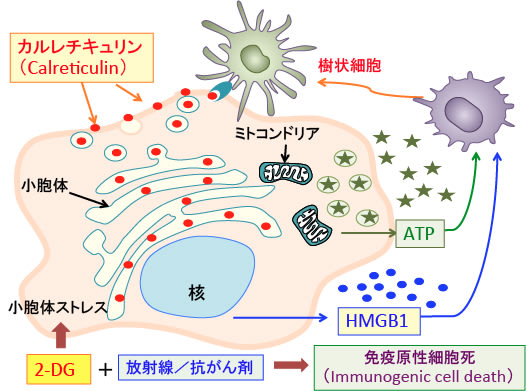
このような炎症を引き起こす細胞内にある成分をDAMPs(damage-associated molecular patterns; ダメージ関連分子パターン)と総称しています。
細胞傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のことです。
DAMPsが細胞外や細胞膜上に露出するような細胞死が起こると、炎症反応が引き起こされ、ダメージを受けた組織の修復が起こります。
抗がんや放射線を使ったがん治療の場合は、このダメージ関連分子パターン(DAMPs)を誘導する細胞死のメカニズムを利用すると、がん特異免疫を増強できることが知られています。
DAMPsは、細胞質や核やミトコンドリアや小胞体などに存在する成分が放出されたもので、炎症細胞や免疫細胞を刺激します。例えば、ミトコンドリアのATP, DNA, フォルミルペプチド、核のヒストンやHigh-mobility group box 1 protein(HMGB1)、High-mobility group nucleosome binding protein 1(HMGN1)、細胞質のATPやF-アクチン、小胞体のカルレチキュリン(Calreticulin)などが知られています。
2-デオキシ-D-グルコース(2-DG)は小胞体ストレスを高めて免疫原性細胞死を増強する作用が知られています。(下図)

しかし、免疫原性細胞死を誘導しても、最大耐用量の抗がん剤を使用し続ければ、リンパ球や樹状細胞も増殖を阻害されるので、抗腫瘍免疫は発動も活性化もできません。
免疫細胞ががん細胞を攻撃しやすい条件と微小環境を作るという治療法も検討する価値があります。
つまり、放射線照射や短期間の抗がん剤治療によってがん細胞の免疫原性細胞死を誘導し、その後に抗腫瘍免疫を高める治療法を積極的に行うという治療法です。
| « 452) 抗腫瘍免... | 454)抗腫瘍免... » |



