がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
670)低酸素誘導因子-1(HIF-1)をターゲットにしたがん治療
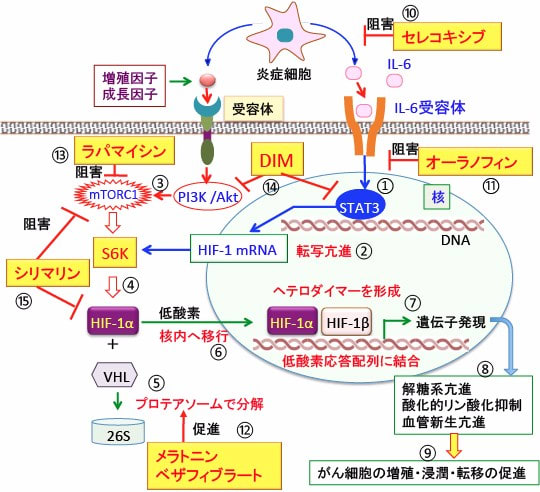
図:活性化した炎症細胞から産生される炎症性サイトカインのIL-6は受容体を介してSTAT3を活性化し(①)、低酸素誘導因子-1(HIF-1)の転写を亢進する(②)。増殖因子や成長因子によるシグナルはPI3K/Aktシグナル伝達系を介してmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を活性化する(③)。mTORC1はリボソームの生合成を促進するS6Kをリン酸化して活性化して蛋白質合成を促進し、HIF-1タンパク質の産生を増やす(④)。酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される(⑤)。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行し(⑥)、HIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する(⑦)。その結果、解糖系が亢進し、酸化的リン酸化が抑制され、血管新生を促進されて(⑧)、がん細胞の増殖・浸潤・転移が促進される(⑨)。シクロオキシゲナーゼ-2阻害剤のセレコキシブ(celecoxib)は炎症細胞の活性を抑制し(⑩)、オーラノフィンはSTAT3の活性化を抑制する(⑪)。メラトニンとベザフィブラートはHIF-1αの分解を促進してHIF-1活性を抑制し(⑫)、ラパマイシンはmTORC1を直接的に阻害する(⑬)。ジインドリルメタン(DIM)はSTAT3とAkt活性を阻害し(⑭)、シリマリンはmTORC1とHIF-1活性を阻害する(⑮)。これらを組み合せると、がん細胞における低酸素誘導因子−1(HIF-1)の活性を抑制し、がん細胞の増殖・浸潤・転移を抑制する効果が期待できる。
670)低酸素誘導因子-1(HIF-1)をターゲットにしたがん治療
【低酸素誘導因子-1はがん細胞のワールブルグ効果を引き起こす】
10月7日に発表された今年(2019年)のノーベル医学生理学賞は、「細胞の低酸素応答の仕組みの解明」に貢献した米英の3人の科学者が受賞しました。
低酸素は低酸素誘導因子-1(Hypoxia Inducible Factor-1: HIF-1)という転写因子を活性化します。このHIF-1は何百という遺伝子の発現を亢進し、細胞は低酸素に適応できるようになります。このHIF-1の発見とその活性化の機序を解明した功績です。
このHIF-1は、がん治療の重要なターゲットとなっています。がん細胞の特徴的な代謝異常であるワールブルグ効果を根本で制御しているのがHIF-1です。がん細胞におけるHIF-1活性の阻害が、がん細胞の増殖抑制と細胞死誘導に有効であることが明らかになっています。
正常細胞とがん細胞ではエネルギー産生の状況に大きな違いがあります。正常細胞ではミトコンドリアで酸素を使って効率的にエネルギー(ATP)を産生しているのに対して、がん細胞では酸素が十分に存在する状況でもミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)は抑制され、細胞質における解糖系によるATP産生が亢進しています(下図)。

図:解糖系ではグルコース(ブドウ糖)1分子当たり2分子のATPが産生される(①)。ミトコンドリアで酸素を使った酸化的リン酸化ではグルコース1分子当たり32分子のATPが産生される(②)。がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(③)。取り込まれたグルコースは核酸や脂肪酸やアミノ酸の合成にも利用される(④)。がん細胞では、酸素が十分に利用できる状況でも、ピルビン酸からアセチルCoAへの変換が阻害され、ミトコンドリアでのTCA回路と酸化的リン酸化によるATP産生は低下している(⑤)。このようながん細胞の代謝の特徴をワールブルグ効果あるいは好気的解糖と言う。
このがん細胞における解糖系の亢進は80年以上前にオットー・ワールブルグ(Otto Warburg、1883年~1970年)により発見され、一般にワールブルグ効果と呼ばれています。酸素が存在する条件でも解糖系が亢進しているので、好気的解糖とも言います。
ワールブルグ博士自身は、ミトコンドリアにおける酸化的リン酸化の機能欠損が細胞のがん化の原因だと考えていました。しかし、その後の研究で、多くのがん細胞においてミトコンドリアの機能自体は障害されていないことが明らかになっています。
そこで、がん細胞が解糖系を好む理由とそのメカニズムの解明が、がん研究における重要なテーマになっています。様々ながん遺伝子の異常や活性化が、がん細胞のワールブルグ効果の成り立ちに関与していることが明らかになっています。
そして、がん細胞のワールブルグ効果を成立させる最も重要な因子が低酸素誘導因子-1(HIF-1)だと考えられています。
ワールブルグ効果に中心的に関わっている低酸素誘導因子-1 (HIF-1)の活性阻害、グルコース取り込みの阻害、HIF-1を活性化するシグナル伝達系の阻害、HIF-1による遺伝子発現誘導の阻害などによってがん細胞のワールブルグ効果を阻害する治療法ががん治療法として有効であることが明らかになっています。
【低酸素になると低酸素誘導因子-1(HIF-1)が活性化される】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia Inducible Factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
(HIFのαサブユニットにはHIF-1α, -2α and -3α、βサブユニットにはHIF-1β, -2β and -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用しています。)
HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリル・ヒドロキシラーゼは酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【がん組織は低酸素になりやすい】
正常な組織では、血液の供給が不足して低酸素や低栄養の領域ができないように整然とした血管網が構築されています。
一方、がん組織では、血管網の整備が細胞の増殖に追いつかないので、血液供給が途絶えた低酸素の領域が至る所に存在します。
がん細胞が増殖し、がん組織が大きくなるためには腫瘍組織を養う血管の新生が必要です。血管内皮細胞の増殖速度はがん細胞の増殖に追いつかないので、不完全な血管網が形成されます。
正常組織のような整然とした血管網ではなく、血管壁構造は不完全(血管周皮細胞や基底膜がない、血管平滑筋が不完全、細胞の受容体が無いなど)で、血管のネットワークも不規則でいびつです。
血管抵抗が高く、血流も滞りやすく、血管自体がもろく、漏れ易い状況です。
リンパ管の発達も不完全で、がん組織では組織液の圧が高くなっています。
酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています(下図)。

図:正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では血管網が不完全で、血液が十分に行き渡らないところが多く、低酸素領域が多く存在する(②)。酸素は血液から拡散によって組織に広がるので、血管から離れた領域のがん細胞は低酸素になっている(③)。
血液は肺胞(酸素分圧100mmHg程度)の毛細血管を通過する間に平衡に達して動脈血の酸素分圧は80〜100mmHgとなります。組織の酸素分圧は20~30mmHg程度であり、動脈血と酸素分圧に差があるため、末梢の毛細血管では組織液と血液が平衡に達しようとして酸素が血液から組織液に移ります。酸素を運び終えた静脈血の酸素分圧は40mmHg程度です。
ステンレス針のなかに小さな電極を入れて、腫瘍組織内の酸素分圧を測定する装置(pO2 Histograph)を使ってがん組織内の酸素分圧を測定した報告は数多くあります。例えば、以下のような報告があります。
Detection and characterization of tumor hypoxia using pO2 histography.(酸素分圧ヒストグラフィー法を用いた腫瘍低酸素の検出と特徴付け)Antioxid Redox Signal. 2007 Aug;9(8):1221-35.
この論文では、がん組織の酸素分圧をpO2ヒストグラフィー法で測定した125件の研究データをまとめています。
子宮頚がんと頭頚部がんと乳がんのがん組織における酸素分圧(pO2)の中央値は10mmHgで、pO2が2.5 mmHg以下の低酸素領域が25%を占めていると報告しています。転移巣の腫瘍組織の酸素分圧も同様の値でした。
患者のヘモグロビン濃度(8〜15g/dL)は正常組織では組織の酸素分圧に影響しませんが、がん組織では貧血が組織の低酸素状態をより増強することが明らかになっています。
がん組織の低酸素状態は、がん細胞の悪性化を進行し、治療に抵抗性になるため、患者の予後を不良にします。
したがって、がん組織の低酸素状態を評価することは、患者の予後を予測し、治療法を選択するときに役立つと言っています。
正常組織の酸素分圧は20~30mmHgですが、がん組織の酸素分圧の平均は10 mmHg程度で、2.5 mmHg以下の高度に低酸素の領域が25%を占めるというのが、がん組織一般の状態のようです。
酸素分圧(pO2)が10mmHg以下のがん組織は予後不良という報告もあります。低酸素のがん組織は抗がん剤や放射線治療に抵抗性を示すからです。
【がん組織の低酸素状態はがん細胞の悪化を促進する】
低酸素の状態では弱いがん細胞は死滅し、強いがん細胞(死ににくいがん細胞)が選択的に生き残るという選択圧がかかります。
例えば、がん抑制遺伝子のp53が正常ながん細胞は、低酸素状態では直ぐに死滅します。しかし、p53に変異のあるがん細胞は細胞死(アポトーシス)に抵抗性を示すので、低酸素状態でも生き残ります。
つまり、低酸素状態はアポトーシスを起こしにくい強いがん細胞を選別して増やす推進力になっています。以下のような報告があります。
The Hypoxic Tumor Microenvironment: A Driving Force for Breast Cancer Progression(低酸素腫瘍微小環境:乳がん進行のための推進力)Biochim Biophys Acta. 2016 Mar; 1863(3): 382–391.
【要旨】
腫瘍組織内の低酸素状態は乳がんで共通に認められ、転移リスクと患者死亡率の有意な増加に関連している。
低酸素誘導因子は、原発腫瘍の血管新生および増殖、間質細胞の動員、細胞外マトリクスの再編成、転移を促進する微小環境形成、細胞運動、局所組織浸潤、転移部位における血管外浸入、および転移腫瘍を形成するのに必要ながん幹細胞の性状の維持などを促進するタンパク質をコードする大量の遺伝子の転写を活性化する。
最近の前臨床試験の結果は、細胞毒性薬剤による化学療法と低酸素誘導因子を阻害する薬剤との組み合わせが、トリプルネガティブ乳がんの女性の転帰を改善する可能性があることを示唆している。
低酸素状態で活性化される低酸素誘導因子-1(HIF-1)は多くの遺伝子の発現を誘導して、がん細胞の増殖や転移を促進し、治療抵抗性を引き起こしています。したがって、通常の抗がん剤治療にHIF-1の発現や活性を阻害する治療法を併用することは抗腫瘍効果を高めることができます。
がん組織の低酸素ががん細胞の悪性度や治療抵抗性を亢進する理由を以下にまとめています。

図:低酸素のがん細胞は浸潤性や転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線や抗がん剤に対する感受性が低下する(①)。さらに、解糖系亢進が亢進する結果(②)、乳酸とプロトン(水素イオン)の産生増加によってがん組織の酸性化が起こる(③)。組織の酸性化は免疫細胞の働きを阻害し、がん細胞の浸潤性と血管新生を亢進する(④)。以上のような多くのメカニズムによって、低酸素はがん細胞の悪性化と治療抵抗性を亢進する(⑤)。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系での代謝が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORやSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。

図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼやVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。
【HIF-1活性が高いがん細胞は浸潤・転移しやすい】
急速に増大するがん組織の中で、がん細胞は常に低酸素、低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
HIF-1αは解糖系酵素の発現を亢進してがん細胞のエネルギー産生に影響します。すなわち、解糖系に関与する10種類の酵素のうち9種類がHIF-1αによって制御されています。
HIF-1はピルビンン酸脱水素酵素キナーゼ(ピルビン酸脱水素酵素をリン酸化して活性を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖系(ピルビン酸から乳酸の変換)を亢進します。
さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、VEGFを介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(下図)

図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の黄色地で赤字で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
【ジインドリルメタンはAkt活性を阻害する】
今までの説明から、mTORC1(あるいは上流のPI3K/Aktシグナル伝達系)とSTAT3を同時に阻害し、さらにがん組織の低酸素状態を軽減すると、HIF-1の活性を低下させることができます。
あるいは、がん組織の低酸素状態を維持しながらHIF-1の活性を阻害すると、低酸素のがん細胞は死滅します。
PI3K/Akt/mTORC1経路とSTAT3経路の阻害には、ジインドリルメタン(STAT3阻害+HIF-1阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)などが使用できます。
ブロッコリーやカリフラワーやキャベツなどのアブラナ科の植物や野菜には抗がん作用のある成分が多く含まれていますが、その代表的な成分がGlucobrassicin(グルコブラシシン)です。(667話参照)
グルコブラシシンは加水分解してインドール-3-カルビノール(Indole-3-carbinol)になり、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります(下図)。

図:アブラナ科の植物(ブロッコリーやケールなど)には多くの抗がん作用が知られている。アブラナ科植物に含まれるグルコブラシシンは加水分解してインドール-3-カルビノールになり、さらに胃の中の酸性の条件下でインドール-3-カルビノールが2個重合したジインドリルメタンになる。このジインドリルメタンに様々なメカニズムによる抗がん作用が報告されている。
ジインドリルメタンは消化管から容易に吸収され、体中の臓器や組織に移行することが知られています。ジインドリルメタン(DIM)には様々なメカニズムによる抗がん作用が報告されています。
例えば、乳がんや前立腺がんをはじめ、多くのがん細胞の増殖を抑え、細胞死(アポトーシス)を誘導することが報告されています。
Akt活性を阻害する作用も複数報告されています。
Akt (プロテインキナーゼBまたはPKBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。以下のような報告があります。
Regulation of YAP through an Akt-dependent process by 3, 3'-diindolylmethane in human colon cancer cells.(ヒト大腸がん細胞における3,3’ジインドリルメタンによるAkt依存性機序を介するYAPの制御)Int J Oncol. 2013 Dec;43(6):1992-8.
この論文では、ジインドリルメタンはヒト大腸がん細胞において、Hippo経路を活性化してPI3K/Akt経路を阻害するメカニズムでアポトーシスを誘導することを報告しています。
3,3'-Diindolylmethane exhibits antileukemic activity in vitro and in vivo through a Akt-dependent process.(3,3’ジインドリルメタンはAkt依存性機序によってin vitroとin vivoにおいて抗白血病活性を示す)PLoS One. 2012;7(2):e31783.
ジインドリルメタンは白血病細胞に対して、細胞培養(in vitro)とマウスの移植腫瘍(in vivo)の実験系で、抗腫瘍作用を示し、その作用メカニズムとしてAkt活性の阻害が重要であることを報告しています。
Diindolylmethane suppresses ovarian cancer growth and potentiates the effect of cisplatin in tumor mouse model by targeting signal transducer and activator of transcription 3 (STAT3)(ジインドリルメタンはSTAT3を標的にすることによってマウスの移植腫瘍の実験モデルにおいて卵巣がんの増殖を抑制し、シスプラチンの抗腫瘍効果を増強する)BMC Med. 2012; 10: 9.
この論文では、ヒト卵巣がん細胞株6種類を用いた培養細胞の実験系と、マウスに卵巣がん細胞を移植した動物実験モデルを用い、ジインドリルメタン単独の効果とシスプラチンとの併用効果について検討しています。
その結果、ジインドリルメタンは培養細胞の実験系で、6種類のヒト卵巣がん細胞全てに対してアポトーシス(細胞死)を誘導しました。
STAT3のTyr-705(チロシン705)とSer-727(セリン727)におけるリン酸化は、ジインドリルメタンによって用量依存的に抑制されました。
さらに、ジインドリルメタンはSTAT3の核内への移行とDNA結合と転写活性を阻害しました。インターロイキン-6によって誘導されるTyr-705におけるSTAT3のリン酸化もジインドリルメタンによって顕著に阻害されました。
一方、遺伝子導入によってSTAT3を過剰発現させると、ジインドリルメタンによって誘導されるアポトーシスは阻止されました。これは、ジインドリルメタンのアポトーシス誘導作用がSTAT3阻害作用と関連していることを示しています。
ジインドリルメタンは低酸素誘導性因子1α(HIF-1α)と血管内皮細胞増殖因子の発現を抑制してがん細胞の浸潤と血管新生を阻害しました。
さらに、ジインドリルメタンはシスプラチンの作用をSTAT3を介する機序で増強しました。すなわち、ジインドリルメタンの経口投与とシスプラチンの投与は移植腫瘍の増殖を著明に抑制し。腫瘍組織におけるアポトーシスの増加と、STAT3活性の抑制が認められました。
STAT3は、STAT (Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子) ファミリーに属する蛋白質で、その名の通り、シグナル伝達と遺伝子転写活性化の両方において働きます。STAT3は非活性化状態においては細胞質に存在しますが、Janusキナーゼ(JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
IL-6ファミリーのサイトカインあるいはEGF等の成長因子がそれらの受容体に結合することによりJanusキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。STAT3は種々の腫瘍に恒常的に発現しておりますが、STAT3の機能を阻害するとアポトーシスが誘導されることから、STAT3阻害剤は新たな抗がん剤のターゲットとして着目されています。
この論文では、ジインドリルメタンは卵巣がんに対するシスプラチンの効果を増強し、その機序としてSTAT3の活性化を抑制する効果を示唆しています。STAT3活性を抑制することはHIF-1の活性抑制にも効果があります。
ジインドリルメタンがHIF-1の発現量を減少させるという実験結果も報告されています。以下のような論文があります。
3,3'-diindolylmethane reduces levels of HIF-1alpha and HIF-1 activity in hypoxic cultured human cancer cells.(ジインドリルメタンは低酸素で培養したヒトがん細胞におけるHIF-1αの量とHIF-1活性を減少させる)Biochem Pharmacol 75(9):1858-67, 2008
この論文では、がん細胞が低酸素状態になったときに活性化される転写因子のHIF-1の発現をジインドリルメタンが阻害することを培養がん細胞を使った実験で報告しています。HIF-1は血管内皮細胞増殖因子(VEGF)などの血管新生に関与する蛋白質の発現を誘導します。したがって、ジインドリルメタンは、腫瘍の血管新生を阻害してがん細胞の増殖を抑制する効果が示唆されたという内容です。
ジインドリルメタンに関しては、Akt/NF-κBシグナル伝達系を阻害する作用によって、がん細胞の細胞死(アポトーシス)を誘導する作用や抗がん剤に対する感受性(抗がん剤が効きやすくなること)を高める効果が報告されています。
例えば、乳がん細胞に対するタキソールの効果、前立腺がん細胞の対するタキソテールの効果、膵臓がんに対する抗がん剤(シスプラチン、ジェムシタビン、オキサリプラチン)やタルセバ(erlotinib)の効果を高めることが報告されています。
さらに、NF-κBの活性を阻害することによって、NF-κBによって調節を受け、血管新生やがん細胞の浸潤や転移に関与しているVEGFやIL-8やMMP-9やuPAなどの遺伝子発現を抑え、がん細胞の増殖や転移を抑える効果も報告されています。
様々な機序によって抗がん剤感受性を高める効果が報告されていますので、ジインドリルメタンは抗がん剤治療と併用するサプリメントとして極めて有用だと言えます。(インターネットで購入できます)
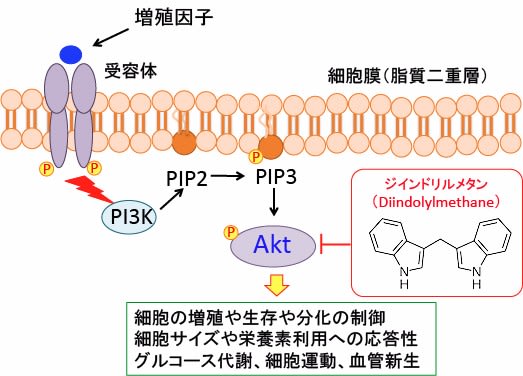
図:PI3キナーゼ-AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。ジインドリルメタンはAKT経路を阻害する。
【シリマリンはがん細胞のワールブルグ効果を阻害する】
ミルクシスルは学名をSilybum marianum と言い、マリアアザミ、オオアザミ、オオヒレアザミなどと呼ばれます。原産は地中海沿岸で、ヨーロッパ全土、北アフリカ、アジアに分布しています。日本においても帰化植物として分布しています。
葉に白いまだら模様があるのが特徴で、この模様はミルクがこぼれたようにみえるためmilk thistle(thistleはアザミの意味)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名があります。
このミルクシスルの種子には、シリビニン(silibinin), シリジアニン(silydianin), イソシリビン(isosilybin), シリクリスチン(silychristin)などのフラボノリグナン(flavonolignan)が含まれています。ミルクシスル種子に含まれるフラボノリグナンを総称してシリマリン(silymarin)と呼ばれています。このシリマリンの主成分(含有量は50~60%程度)がシリビニンです。
つまり、ミルクシスルの種子の薬効成分はシリマリン(多種類のフラボノリグナン類の総称)であり、シリマリンの主成分がシリビニンということです(下図)。

図:ミルクシスルの葉の縁は尖った波形で、葉脈に沿って白い縞模様がある。この模様がミルクがこぼれたように見えるためミルクシスル(シスルはアザミのこと)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名前がついている。種子が薬用として利用され、その薬効成分はシリマリンと呼ばれるフラボノリグナン類で、シリマリンの主成分がシリビニンで、シリビニンは最も生物活性の高いシリマリンと考えられている。
以下のような報告があります。
Silibinin inhibits hypoxia-induced HIF-1α-mediated signaling, angiogenesis and lipogenesis in prostate cancer cells: In vitro evidence and in vivo functional imaging and metabolomics(シリビニンは前立腺がん細胞における低酸素によって誘導されるHIF-1α介在性のシグナル伝達、血管新生および脂肪酸合成を阻害する:in vitroの証拠およびin vivoの機能的イメージングおよびメタボロミクス)Mol Carcinog. 2017 Mar; 56(3): 833–848.
この論文では、ヒト前立腺がん細胞を用いて、シリビニンが低酸素によって誘導されるHIF-1の発現を阻害し、血管新生と脂肪酸合成を抑制して、がん細胞の増殖を抑制する効果を報告しています。
シリマリンには、グルコ-スの取り込みの阻害作用、低酸素誘導因子-1(HIF-1)活性の阻害作用、PI3K/Akt/mTORシグナル伝達系の阻害作用、抗酸化作用などによって転写因子のNF-κB活性を阻害する作用、がん細胞の浸潤や転移を抑制する効果など多彩な抗がん作用が報告されています(図)。

図:シリマリンはワールブルグ効果に中心的に関わっている低酸素誘導因子-1 (HIF-1)の活性阻害、グルコース取り込みの阻害、HIF-1を活性化するシグナル伝達系の阻害、HIF-1による遺伝子発現誘導の阻害など複数の作用点においてがん細胞のワールブルグ効果を阻害する作用が報告されている。
ミルクシスルはヨーロッパにおいて古くから肝障害の治療薬として民間療法として利用されており、シリマリンの肝細胞保護作用や肝機能改善作用の有効性は多くの動物実験や臨床試験で確かめられています。 抗がん剤による肝臓のダメージを軽減し、傷害を受けた肝細胞の再生を促進する作用が確かめられています。
シリマリンは毒性が極めて低く、抗がん剤治療による副作用を軽減する効果が多くの臨床試験で確認されており、抗がん剤や放射線治療の効果を高める作用や、直接的な抗がん剤作用も報告されています。サプリメントとして販売されています。比較的安価で、がん治療に利用するメリットの大きいサプリメントです。
伝統的な使用法は、1日3~9g程度の潰した種子をお湯で煎じて、これを1日数回に分けて服用しています。しかし、シリマリンは水に難溶性であるため、煎じ液を服用する方法では十分にシリマリンを摂取できないと考えられています。薬効を高める目的では、すり潰した種子を料理や飲み物に混ぜて摂取する方法が推奨されています。
ミルクシスル種子は4~6%のシリマリンを含有します。9gの種子にはシリマリンが360~540mg程度含まれている計算になります。
サプリメントとして商品化されているものは、70-80%のシリマリンを含有するように調整されており、臨床試験の多くはこのようなスタンダードな製品を用いています。
臨床試験では、シリマリンを1日に140mgを3回(420 mg/日)の用量で行われています。抗がん作用を目的とする場合は1日1000mg以上のシリマリンを使うこともあります。
ミルクシスルやその成分のシリマリンにはほとんど副作用が無いことが多くの臨床試験で示されています。副作用としては、便が軟らかくなることが稀にあるくらいです。胆汁の分泌が多くなって軟便や下痢の原因になる場合があるからです。
ドイツのコミッションEによると、通常の量を摂取した場合にはミルクシスルによる副作用は報告されていません。米国ハーブ協会の分類では、適切に使用される場合、安全に摂取できるハーブに分類されています。長期投与でも全く毒性は認められていません。
抗がん剤治療の副作用軽減の目的でもよく使用されています。抗がん剤の多くは肝臓で代謝され、肝臓にダメージを与えます。このような抗がん剤治療による肝臓障害に対しても、ミルクシスルの有効性が報告されています。
肝機能障害を発症した急性リンパ性白血病の50人の子供を対象に、ミルクシスルのサプリメントの治療効果がランダム化二重盲検試験で検討されています。その試験結果によると、ミルクシスルの投与によって、肝機能が著明に改善し、副作用によって抗がん剤を減らす必要があった症例の率が低下し、抗がん剤の効き目には差はなかった(抗がん剤の効き目を妨げない)ことが報告されています。
ミルクシスルは肝臓保護作用の他にも、抗がん剤による腎臓や心臓のダメージを軽減する効果も報告されています。放射線による腎臓のダメージにもミルクシスルは保護作用を示します。ラットを使った実験で、ドキソルビシンの心臓毒性と肝臓毒性に対して保護作用を示すことが報告されています。
全身麻酔による副作用や合併症を予防するために、手術前にミルクシスルの服用を推奨する意見があります。シリマリン(420mg/日)の投与によって全身麻酔による肝障害が予防できることが臨床試験で示されています。シリマリンは肝細胞の蛋白質合成能を高め、ダメージを受けた肝細胞の修復や再生を促進します。ラットを使った実験ではγ線照射の1時間前にシリマリンを投与すると脾臓や肝臓や骨髄のダメージが緩和することが報告されています。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1α誘導性のVEGF発現誘導をメラトニンが阻害することが多くの研究で示されていますが、その分子メカニズムに関しては幾つかの説があります。
他の多くの抗酸化剤と異なり、メラトニンには脳や様々な末梢組織の細胞の細胞膜に受容体が存在します。すなわち、メラトニンには、受容体に依存性の作用と非依存性の作用が知られています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
VEGF遺伝子のプロモーター領域のHREにおいて、HIF-1αとコアクチベーターの結合を阻害する作用も知られています。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。
内皮増殖因子(VEGF)の産生を抑制して血管新生を阻害する可能性も指摘されています。最近の総説で以下のような論文があります。
Melatonin as an angiogenesis inhibitor to combat cancer: Mechanistic evidence.(がんと戦うための血管新生阻害剤としてのメラトニン:メカニズム的証拠)Toxicol Appl Pharmacol. 2017 Nov 15;335:56-63.
【要旨】
松果体から産生されるインドラミンであるメラトニンは、さまざまな身体機能に関与し、抗腫瘍作用などの多様な生物学的活性を有することが示されている。血管新生阻害は、メラトニンがその抗腫瘍効果を発揮するメカニズムの1つある。
血管新生の増加は腫瘍進行の主な特徴であり、したがって血管新生阻害はがん治療における重要なステップである。メラトニンは、がん細胞への栄養素と酸素供給を標的にするためにさまざまなメカニズムで作用している。転写レベルでは、低酸素誘導因子-1α(HIF-1α)およびその制御下にある遺伝子、例えば血管内皮増殖因子(VEGF)は、血管新生の阻害のためのメラトニンの主な標的である。
メラトニンは、HIF-1αの核内への移行を妨げ、それによってVEGFの発現を妨げ、また血管新生関連遺伝子の発現に関与するHIF-1α、リン酸化-STAT3およびCBP / p300複合体の形成も妨げる。
メラトニンの血管新生抑制作用はまた、VEGFR2の活性化および発現を阻害する作用も関与している。
さらに、メラトニンのその他の血管新生抑制メカニズムには、内皮細胞遊走と浸潤と脈管形成の阻害が含まれる。本研究では、メラトニンによって媒介される血管新生阻害の経路と、in vitroとin vivoの両方における様々な種類のがんにおける原因となる血管新生阻害のメカニズムを検討した。
この論文では、メラトニンが転写因子の低酸素誘導因子-1α(HIF-1α)の活性化を阻止し、血管内皮増殖因子(VEGF)の産生を阻害して血管新生阻害作用を発揮することを報告しています。
リンパ球を刺激する作用があるため、自己免疫疾患(慢性関節リュウマチなど)や悪性リンパ腫や白血病など免疫細胞の腫瘍の場合は、メラトニンの服用は病気を悪化させる可能性があるため使用できません。血液凝固を抑える作用があるため、血液凝固に異常がある場合や、ワーファリンのような血液凝固を阻害する薬を服用中は注意が必要です。
血圧を低下させる作用があるため、降圧剤を服用中は注意して服用します。
これらの点に注意していれば、副作用はほとんど無く、がん治療にメラトニンの使用はメリットが高いと言えます。がん治療には1日1回、就寝前に10〜40mgを目安に服用します。
【PPARα(ペルオキシソーム増殖因子活性化受容体α)はHIF-1活性を低下する】
PPARを活性化する薬や食品成分は脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt/mTORC1)を抑制する作用や、抗炎症作用、血管新生阻害作用、分化誘導作用などの抗腫瘍効果も報告されています。
がん細胞のワールブルグ効果の根本的な原因である低酸素誘導因子-1(HIF-1)の活性をPPARの活性化によって抑制できることが報告されています。以下のような論文があります。
Activation of peroxisome proliferator-activated receptor α (PPARα) suppresses hypoxia-inducible factor-1α (HIF-1α) signaling in cancer cells.(ペルオキシソーム増殖因子活性化受容体αの活性化はがん細胞における低酸素誘導因子-1αシグナルを抑制する)J Biol Chem. 287(42): 35161-9, 2012年
【要旨】
ペルオキシソーム増殖因子活性化受容体α(PPARα)の活性化はがん細胞の増殖と血管新生を阻害することが報告されているが、その作用機序に関しては十分に解明されていない。
この研究では、ヒト乳がん細胞(MCT-7)とヒト卵巣がん細胞(A2780)を使って、低酸素誘導因子-1α(HIF-1α)シグナル伝達系に対するPPARα活性化の作用について検討した。
酸素濃度が1%の状態でがん細胞を16時間培養するとHIF-1αの発現量が著明に増加する。低酸素で培養する前にPPARαのアゴニスト(受容体を活性する物質)で処理すると、低酸素で誘導されるHIF-1αの発現と活性が抑制され、PPARαのアンタゴニスト(受容体の作用を阻害する物質)を投与するとPPARαのアゴニストによるHIF-1αシグナルの抑制作用が減弱した。このような作用はPPARγでは認めなかった。
PPARαの活性化は、低酸素で誘導されるHIF-1αタンパク質の量を減少させたが、変異したHIF-1αタンパク質の発現量には変化はなかった。このことは、PPARαの活性化はHIF-1αの分解を促進することを示している。この作用機序は、低酸素条件で誘導されるHIF-1α発現に対するPPARα活性化による抑制が、タンパク分解酵素を投与すると阻止されるという、タンパク分解酵素阻害剤を用いた実験で確かめられた。
共免疫沈降法(co-immunoprecipitation)を用いた実験で、HIF-1αのユビキチン-プロテアソーム経路での分解を促進するタンパク質であるvon Hippel-Lindauタンパク質とHIF-1αとの結合をPPARαの活性化によって促進されることを示した。
PPARαの活性化によってHIF-1αシグナル伝達経路が抑制されると、がん細胞からの血管内皮細胞増殖因子(VEGF)の分泌は著明に減少し、腫瘍血管の新生は阻害された。
以上の結果から、PPARαを活性化するとがん細胞における低酸素で誘導されるHIF-1αシグナル系が抑制されることが確かめられた。この結果は、PPARαのアゴニストの抗がん作用の新しい作用機序を提示している。
この論文では、PPARαの活性化がHIF-1αの分解を促進するという作用機序を示しています。分解を促進する機序として、HIF-1αとVHLとの結合を促進すると考察していますが、HIF-1αとVHLとの結合促進はプロリル・ヒドロキシラーゼの活性化によるものかもしれません。いずれにしても、PPARαの活性化はHIF-1αの分解を促進して低酸素で誘導されるHIF-1の活性を抑制するということです。
HIF-1の活性阻害を目的とする場合にはPPARαのリガンドであるフィブラート系薬剤の使用は有効かもしれません。
以上のことから、ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ジインドリルメタン(STAT3阻害)、ベザフィブラート(PPARの汎アゴニスト)、フェノフィブラート(PPARα選択的アゴニスト)、メラトニン、シリマリン(ミルクシスル)などの組合せは、がん細胞におけるワールブルグ効果を引き起こす最大の因子である低酸素誘導因子-1(HIF-1)の発現と活性を阻害することによって、がん細胞の増殖抑制に寄与できると思います。(トップの図を参照)
| « 669)オーラノ... | 671)断酒薬ジ... » |



