がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
643)クエン酸は鉄とキレートしてがん細胞の増殖を抑える
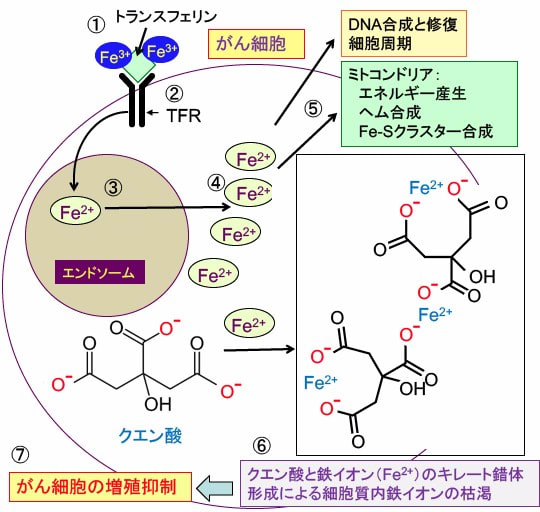
図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン (Fe3+)を2個運搬できる(①)。がん細胞では細胞膜に存在するトランスフェリン受容体の発現が亢進して鉄の取り込みが亢進している(②)。3価鉄イオン (Fe3+)はエンドソーム(endosome)内の酸性の環境では2価の鉄イオン (Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し(④)、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(⑤)。クエン酸は2価の鉄イオン (Fe2+)とキレート錯体を形成して細胞質内の2価鉄イオンを枯渇する事によって(⑥)、がん細胞の増殖を阻害する(⑦)
643)クエン酸は鉄とキレートしてがん細胞の増殖を抑える
【クエン酸はレモンから見つかった】
クエン酸は炭素原子6個、水素原子8個、酸素原子7個から成り、 C6H8O7という分子式を持つ分子量192の化合物です。カルボキシ基(COOH)を3個持つ弱酸性の有機化合物です。構造式は様々な書き方がありますが、その幾つかを下図に示しています。(図)。
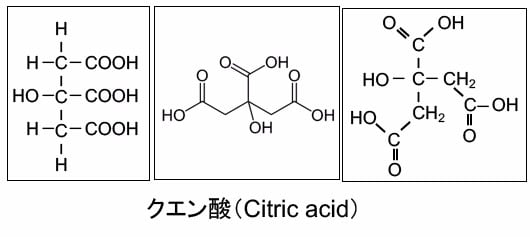
図:クエン酸はカルボキシ基(COOH)を3個持つ弱酸性の有機化合物で、構造式は様々な書き方があり、その代表的な物を示している。
クエン酸はレモンやライムなどの柑橘類に多く含まれています。柑橘類はみかんの仲間です。ミカン科の常緑樹の果実で、世界中に数百種類もあります。温州みかん、オレンジ、レモン、グレープフルーツ、ライムなど様々な柑橘類が販売されています。柑橘は英語で「Citrus」と言います。
クエン酸は1784年にレモン汁から発見されました。クエン酸は英語で「Citric acid」と言い、Citric acidは「柑橘類に含まれる酸」という意味です。
漢字では枸櫞酸と書きます。枸櫞(クエン)とは漢名でマルブシュカン(丸仏手柑)のことで、広く柑橘類の果物を指す場合もあります。
つまり、「Citric acid」も「クエン酸」もレモンをはじめ柑橘類に多く含まれていることから由来します。
柑橘類の酸味の原因はクエン酸の味に依るものです。
レモンが酸っぱいのはビタミンCによるものと思っている人が多くいます。広告で「レモン〇〇個分のビタミンC」などと宣伝されているので、レモンの酸味をビタミンCによるものと思っている人が多いのですが、ビタミンC自体には強い酸味はありません。レモンの酸味はクエン酸によるものです。
商業用のクエン酸は初めはレモン汁から抽出されていましたが、1919年にデンプンや糖をコウジカビの一種( Aspergillus niger)で発酵させて製造する方法が発見され、きわめて安価に大量のクエン酸を製造できるようになっています。
クエン酸は爽やかな酸味を持つことから食品添加物として多用されています。クエン酸は酸味により、唾液や胃液の分泌を促して食欲を増進させる効果があります。
さらに弱酸性の性質を利用して、トイレの黄ばみや、お風呂やポットの水垢の除去など、様々な汚れを落とす目的にもクエン酸は利用されています。
【キレートと錯体とキレートレモン】
「キレートレモン」という飲料があります。レモンの主な健康成分のビタミンCとクエン酸が主体の飲料です。「ビタミンCは活性酸素を消去して美容に良く、クエン酸は代謝を活性化して疲労回復を促進する」というような宣伝文句が記述されています。
この商品では「キレート」という一般の人には耳慣れない用語が使われています。なんらかの健康作用を示唆しています。
宣伝文句では「クエン酸は金属イオンと結合する性質があり、これをキレート作用と言う。この働きによって、カルシウムや鉄、亜鉛などのミネラルを包み込んで、消化管からの吸収率がUPする」などと記述されています。
つまり、クエン酸はキレート作用によってミネラルの消化管からの吸収を良くして、体の治癒力を高める効果を発揮するという説明です。
キレート(chelate)という言葉は、ギリシャ語の「カニのはさみ(chela)」から派生した言葉で、分子の立体構造によって生じた隙間に金属を挟む姿から命名されました。
カニのはさみのように物質を挟み込むことを「キレート化する」と言います。このようなキレート化作用のある物質は様々な健康食品や病気の治療にも用いられています。
例えば、吸収されにくい必須ミネラルを挟み込んで、小腸からの吸収を促進してくれるという目的で使う場合があります。
ミネラルは単独では吸収が悪いので、アミノ酸などでキレート化した製品が米国では主流になっています。動物では小腸の上皮細胞からミネラルなどの栄養を吸収していますが、水にイオン化したミネラルはそのままでは小腸からの吸収は極めて悪いことが知られており、アミノ酸などと結合しキレート化されることによって吸収が促進されるのです。
これとは逆に、体内に吸収された有毒な物質を体外に排泄する目的でキレート剤が使われています。米国等では「キレーション療法」という方法が有毒ミネラルを体外に排泄するデトックス療法として盛んに行われています。
キレーション療法とは、金属をキレート化するEDTAという薬剤を点滴し、このEDTAが水銀や鉛などの重金属とキレート化して結合し、体外への排泄を促進して血液を浄化する方法です。金属性の必須ミネラルも一緒に排泄されるので、不足する必須ミネラルをサプリメントで補充すれば、差し引き勘定で、有毒ミネラルが減ることになります。米国ではすでに50年以上の歴史があり、1日に数十万人が受けているといわれています。
点滴のキレーション療法よりもっと簡単で経済的な方法として、クエン酸が役立つ可能性が指摘されています。
金属と強いキレート作用をもつクエン酸は、体内に吸収された有毒な金属を体外に排泄する効果が知られています。
クエン酸はカルシウムときレートして、カルシウムの小腸からの吸収を促進します。一方、クエン酸は採血の時の抗凝固薬としても利用されています。カルシウムは血液の凝固に必要ですが、クエン酸がカルシウムイオンをキレートして血液凝固に利用できなくするからです。
クエン酸ががん細胞内で増えると、カルシウムや鉄や銅や亜鉛などとキレートして、細胞増殖に関与するタンパク質や抗酸化酵素の働きを阻害して、がん細胞の増殖を抑制したり、細胞死を誘導する作用が報告されています。
銅や亜鉛やセレニウムとキレートして、スーパーオキシド・ディスムターゼ(SOD)やグルタチオン・ペルオキシダーゼの活性を阻害して酸化ストレスを高めて、がん細胞を死滅させる作用が動物実験などで報告されています。

図:クエン酸にはカニのはさみのように物質を挟み込む作用があり、これをキレート作用という。例えば、クエン酸のカルボン酸部分のマイナス電荷とカルシウムイオン(Ca2+)のプラス電荷が相互作用してキレート錯体を形成する。この作用は食品中のカルシウムの小腸からの吸収を促進する。一方、細胞内のカルシウムの働きを阻害する場合もある。
【がん細胞は鉄を多く取り込んでいる】
鉄は原子番号26の元素で、地球で最も多い元素で、地球重量の約30%を占めています。生命の発生の段階から、鉄は生命の機能に密接に関係してきました。
私たちの体内には、体重60kgで平均4g程度(2~6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。
鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在し、酸素を運搬する働きを担っています。ヘモグロビンに含まれる鉄は、酸素と結び付いて、体内の至る所に酸素を運びエネルギーを生み出す役割を果たします(下図)。

図:ヘモグロビンはα鎖とβ鎖と呼ばれる2種類のサブユニットから構成される四量体構造をしている。各サブユニットには1つのヘムが結合している。ヘム(Heme)は2価の鉄原子とポルフィリン(IX型プロトポルフィリン)から成る錯体で、赤血球中のヘモグロビンは、ヘムの鉄原子が酸素分子と結合することで酸素を運搬する。
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(ferrous: Fe2+)と三価イオン(ferric : Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。
例えば、NADPHオキシダーゼ、キサンチンオキシダーゼ、リポキシゲナーゼ、チトクロームP450酵素など、活性酸素を産生させるような酵素の活性に必要です。
ATPを生産するミトコンドリアの電子伝達系のタンパク質など電子を輸送する様々なタンパク質にも使われています。ペルオキシソームで過酸化水素(H2O2)を分解するカタラーゼの活性にも鉄が必須です。
カタラーゼはタンパク質と鉄からできている酵素で、過酸化水素(H2O2)を水と酸素に分解します。
つまり鉄は、体内の酸素をエネルギーとして有効利用し、細胞内の活性酸素の産生を高めると同時に、余分な活性酸素を無害化するといった、相反する2つの大きな役割を果たしています。
このように、鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、がん細胞は鉄の需要が増え、鉄の取り込みが増えています。血液中では鉄イオンはトランスフェリンに結合して細胞まで運ばれます。1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。 トランスフェリンは細胞膜にあるトランスフェリン受容体と結合し,エンドサイトーシスによって取り込まれ、リソソーム(エンドソーム)内で酸性の環境になると鉄イオンが解離し、2価の鉄(Fe2+)になって細胞内に取り込まれます。
フリーの2価鉄イオンは鉄の利用の主要な器官であるミトコンドリアへの供給に必要な細胞質鉄プール(酸化還元活性のある不安定鉄プール)として蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。
利用されない細胞質鉄プールのFe2+は、鉄を介した細胞の損傷を防ぐためフェリチンと結合して酸化還元反応を起こさない三価鉄(Fe3+)として貯蔵されるか、あるいは、フェロポーチンにより細胞外に排出されます。 フェリチンは体内で鉄を貯蔵するタンパク質で、鉄とアポフェリチンによって構成され、多くの鉄イオンの周りをミセルで覆うことによって鉄を貯蔵します。(下図)

図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン( Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、STEAP3の還元酵素活性(ferrireductase activity)によって3価の鉄イオン( Fe3+)は2価の鉄イオン( Fe2+)に還元される(③)。鉄が離れたトランスフェリンとトランスフェリン受容体は細胞膜に戻り、再利用される(④)。 2価の鉄イオンは2価金属トランスポーター1(divalent metal transporter 1 :DMT1)を通ってエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入る(⑤)。鉄イオンは、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(⑥)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に貯蔵される(⑦)。鉄イオンは鉄排出ポンプであるフェロポーチン(ferroportin)によって細胞外に排出される(⑧)。この際、セルロプラスミン(ceruloplasmin)やヘフェスチン(hephaestin)のような酸化酵素によって2価の鉄イオンは3価に酸化され、トランスフェリンによって体内を運搬される。 細胞質の2価鉄イオンは過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシラジカル(・OH)を発生させ、細胞傷害を引き起こす(⑨)。したがって、鉄による細胞傷害を避けるためには、細胞内での鉄イオンの利用や貯蔵や排出の調節が極めて重要となる。
【鉄のキレート剤ががん細胞の増殖を阻害する】
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。
この現象に対して、がん治療法は2つの全く異なるアプローチがあります。
一つは、がん細胞に多く含まれる鉄によって活性酸素の産生を高めてフェロトーシスという細胞死を誘導するという方法です。(615話参照)
もう一つは、がん細胞内の鉄を枯渇させて、増殖を阻止する方法です。
鉄はDNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。したがって、細胞質内の鉄が枯渇すると細胞の増殖が阻害されます。
どちらも、がん治療として有効ですが、成功するかどうかは、どこまで徹底できるかです。
がん細胞にフェロトーシスを誘導するときは、がん細胞を死滅するのに十分な活性酸素の産生が達成できるかにかかっています。抗がん剤治療や放射線治療や、抗酸化システムを阻害する治療(ジスルフィラム、オーラノフィンなど)と併用すると有効性を高めることができます。
がん細胞の鉄を枯渇する場合は、どれだけ枯渇できるかにかかっています。枯渇の程度が弱ければ、効果は期待できないかもしれません。
後者の方法として、鉄のキレート剤をがん治療に応用しようとする試みは多くあります。以下のような報告があります。
A class of iron chelators with a wide spectrum of potent antitumor activity that overcomes resistance to chemotherapeutics.(化学療法薬に対する耐性を克服する、広範囲の強力な抗腫瘍活性を有する鉄キレート剤)Proc Natl Acad Sci U S A. 2006 Oct 3;103(40):14901-6.
【要旨】
顕著かつ選択的な抗腫瘍活性を有する新規の化学療法剤、特に確立された治療に対する耐性を克服することができるものを開発することが不可欠である。鉄は細胞周期の進行およびDNA合成にとって重要であるため、新しい抗がん剤の開発のための新規なターゲットとしての可能性を有している。
本研究の目的は、ヒトの腫瘍を用いた新しいクラスの鉄キレート剤の抗腫瘍活性と鉄キレート効果を評価することである。この研究において、鉄キレート剤は広い抗腫瘍活性を示し、そして確立された抗腫瘍剤に対する耐性を克服することができた。
最も効果的なキレート剤でとしてdi-2-pyridylketone-4,4,-dimethyl-3-thiosemicarbazone (Dp44mT)が同定され、このDp44mTのインビボでの有効性を、ヒトのがん細胞をヌードマウスに異種移植した動物実験モデルを用いて評価した。
悪性黒色腫を移植したマウスの実験系で、Dp44mT投与群の7週間後の腫瘍増殖は、対照マウス(薬剤非投与群)のわずか8%であった。
さらに、Dp44mT処置マウスと対照との間の血液学的指標に差は見られなかった。Dp44mT投与マウスは、対照の非投与マウスを比較して、顕著な全身性鉄欠乏は観察されなかった。これは、おそらく抗がん活性を誘導するのに必要とされる鉄キレート剤が非常に低い用量のためと思われる。
Dp44mTは、鉄応答性の腫瘍増殖と転移を抑制する因子のNdrg1の発現を腫瘍細胞においては亢進したが、肝臓においては発現量は変化しなかった。これはDp44mTが選択的な抗がん活性化を示すメカニズムとの関連を示唆している。
これらの結果は、この新規の鉄キレート剤が強力かつ広範な抗腫瘍活性を有し、そしてそれらの独特の作用機序のために、確立された化学療法剤に対する耐性を克服し得ることを示している。
鉄キレート作用は、現在行われている抗がん剤治療や放射線治療などの耐性を克服する効果が期待できることを示唆しています。
鉄のキレーターであるデスフェラールで細胞を処理するとDNA合成が低下することが報告されています。その作用機序として、リボヌクレオチド還元酵素活性の抑制が示唆されています。
トランスフェリンレセプターのモノクローナル抗体で細胞を処理すると鉄の取り込みが低下し、リボヌクレオチド還元酵活性およびDNA合成が低下することが報告されています。
リボヌクレオチド還元酵素はDNAを有するほぼ全ての生物種に保存される酵素で、リボヌクレオチドを還元して 2’-デオキシリボヌクレオチドを生成し、DNAの修復や複製に必要な全ての核酸塩基を供給しています。リボヌクレオチド還元酵素の活性には鉄が必須です。
がん細胞内にクエン酸を増やすと、様々なメカニズムでがん細胞の増殖を抑制します。その機序とクエン酸を増やす方法については590話と637話で解説しています。クエン酸の抗腫瘍活性のメカニズムの一つとして鉄やカルシウムなどのミネラルをキレートする作用も寄与していると思われます。
新刊紹介

(ご購入はこちらへ)
銀座東京クリニックでも販売しています(詳細はこちらへ)
| « 642)がんは「... | 644)ヒストン... » |



