がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
526)ジクロロ酢酸の抗がん作用:症例報告
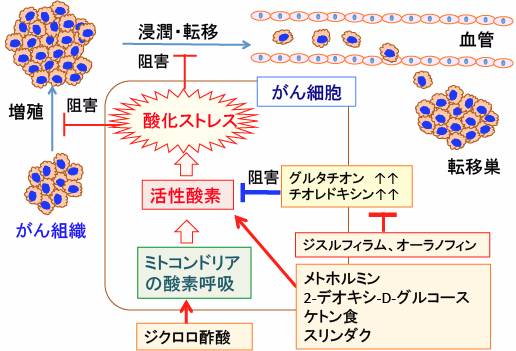
図:ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素の活性を高め、ミコトンドリアでの酸素呼吸を亢進し、酸化ストレスを高めて、がん細胞の増殖や浸潤や転移を阻害する。がん細胞はグルタチオンやチオレドキシンなどの抗酸化酵素の発現亢進などによって抗酸化力を高めて、酸化傷害から細胞を守ろうとしている。活性酸素の産生を高める方法(ジクロロ酢酸、メトホルミン、2-デオキシ-D-グルコース、ケトン食、スリンダクなど)と抗酸化力を弱める方法(ジスルフィラム、オーラノフィンなど)を併用すると、がん細胞の増殖や浸潤・転移を抑制し、アポトーシスを誘導できる。
526)ジクロロ酢酸の抗がん作用:症例報告
【in vitroの実験とin vivoの実験とバイオアベイラビリティ】
培養細胞を使った実験をin vitro(イン・ビトロ)の実験と言います。In vitroとは「試験管内で(の)」という意味です。
一方、動物や人体を使った研究を in vivo(イン・ビボ)の研究と言います。in vivoとは、「生体内で(の)」という意味で、マウスなどの実験動物を用い、生体内に被験物質を投与し、生体内や細胞内での薬物の反応を検出する試験のことです。人間での臨床試験も含まれます。
培養がん細胞を使ったin vitroの実験で、ある物質ががん細胞の増殖を抑えたりアポトーシスを誘導するような薬効が認められても、それが動物や人間で効果が出るという保証はありません。消化管からほとんど吸収されなかったり、生体内ですぐに分解されてしまう場合もあるからです。
例えば、培養がん細胞を用いた実験で10μg/mlの濃度でがん細胞の増殖を抑える効果が認められても、それを人間が服用して血中濃度が10ng/ml(10μg/mlの1000分の1)程度しかならないのであれば、効果は全く期待できません。
実際に、in vitroの実験で抗がん作用が示されている物質の中には、人体では全く効果が出ないものも多いのです。
例えば、抗がん作用が報告され抗がんサプリメントとして人気の高いウコンのクルクミンや赤ブドウのレスベラトロールでも、消化管からの吸収率が極めて低いことが知られています。
クルクミンもレスベラトロールも培養細胞を使った実験では数10μg/ml程度の濃度で抗がん作用を示しますが、人間がクルクミンやレスベラトロールを大量に服用しても血中濃度はその有効濃度(数10μg/ml)の100分の1~1000分の1くらいという状況です。したがって、消化管粘膜からの吸収率を高めるような製剤の開発が重要な課題になっています。(285話、513話参照)
動物実験で効果が示されても、その投与のルートを確認する必要があります。
確実に投与できて結果も出やすいので、動物実験では静脈注射や腹腔内投与が用いられますが、その物質が人間では経口摂取されている場合は、動物実験も経口摂取で行われた実験しか意味がありません。
静脈注射や腹腔内投与は投与した量の全てが体内に入りますが、経口摂取の場合は、その物質の吸収率が低い場合があるからです。
投与された薬物の何パーセントが血中に入って体に作用するかを表す指標を薬学の分野では「生物学的利用能(バイオアベイラビリティ:bioavailability)」と言います。
薬を静脈内に投与すると、投与された薬物はほぼ完全に生体で利用されるので、バイオアベイラビリティは100%ということになります。一方、口から摂取(経口投与)した場合は、薬剤の消化管からの吸収の程度によってバイオアベイラビリティは影響を受けます。腸管からの吸収が悪いとバイオアベイラビリティの数値は極端に低くなります。
一般的に、水に溶けにくい成分(高脂溶性の化合物)は消化管内で凝集し、消化管粘膜からの吸収性が悪いことが知られています。
内服薬の場合、バイオアベイラビリティが十分に高い医薬品を創製できるかどうかが医薬品として成功するかどうかを決定する最も重要な要因の一つであるとされています。
薬剤のバイオアベイラビリティを高める製剤技術が開発され、サプリメントの分野でも体内吸収性を高めた製品の開発が行われています。
つまり、培養細胞や動物を使った基礎研究で薬効が認められても、人間に効くという保証はありません。
標準治療で用いられている医薬品は、ヒトの臨床試験での有効性が証明されたものです。
しかし、代替医療などで使用されているサプリメントや薬の中には、培養細胞や動物実験レベルの研究までで、人間での効果が確認されていないものが数多くあります。
がんの補完・代替医療でサプリメントなどを利用するときには、症例報告や臨床試験などで人間での効果が確認されているものを使用することが重要です。
【ジクロロ酢酸はミトコンドリアを活性化してがん細胞の増殖を抑制する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります(下図)。

小児のミトコンドリア病の乳酸アシドーシスの治療薬として古くから使用されており、水に容易に溶解するので、バイオアベイラビリティ(生体利用率)も高い物質です。
移植腫瘍などの動物実験でも、経口投与で抗腫瘍作用が証明されています。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。
がん細胞では低酸素誘導因子-1(HIF-1)の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生(酸化的リン酸化)が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(下図)

図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。HIF-1は乳酸脱水素酵素の発現を亢進して解糖系代謝を亢進する作用もある。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高め、ピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増えてがん細胞が死滅する。ジクロロ酢酸ナトリウムでミトコンドリアが活性化されるとHIF-1の活性が抑制される機序も報告されている。
がん細胞のミトコンドリアでの酸素呼吸を亢進すると、がん細胞の増殖が抑制できます。十分に酸化ストレスを高めれば、がん細胞を死滅させることもできます。(506話参照)
がん細胞の酸化ストレスを高めてがん細胞を死滅させる「がんの酸化治療」の中心になる薬です。(352話参照)
特許が取れる場合は、専売的に販売できて莫大な利益が得られるので、製薬会社は何十億円や何百億円という莫大な費用をかけて大規模な臨床試験を行います。その結果、人間での有効性を証明した論文が数多く報告されます。
しかし、古くから知られている物質など特許がもはや取れない場合は、製薬会社はそれを医薬品として開発しません。医薬品として開発しても、独占的に販売できなければ利益が得られないからです。
そのような物質は、グラント(科学研究などを支援する目的で個人や組織などに対して政府機関や民間の財団から交付される補助金や寄付金)を取得して小規模な臨床試験を計画したり、あるいは医療機関から症例報告として発表されたりして、人間での効果が報告されています。
ジクロロ酢酸はがんの代替医療では、かなり有望な治療薬として認識されています。
特許が取れないので大規模な臨床試験は行われていませんが、症例報告や小規模な臨床試験で、人間での抗がん作用が報告されています。
最近の報告として以下のような論文があります。
【ジクロロ酢酸治療で長期間の病状安定が得られているステージ4大腸がんの症例】
Long-term stabilization of stage 4 colon cancer using sodium dichloroacetate therapy (ジクロロ酢酸治療によるステージ4大腸がん患者の長期病状安定) World J Clin Cases. 2016 Oct 16; 4(10): 336–343.
【要旨】
ジクロロ酢酸ナトリウム(dichloroacetate sodium;DCA)がヒトの肺がん細胞や乳がん細胞や脳腫瘍細胞にアポトーシスを誘導するというBonnetらの報告に基づいて、2007年以降、様々ながんに対する新規の代謝治療として経口のジクロロ酢酸ナトリウムの治療が検討されている。
臨床試験における治療効果の判定は、画像検査における腫瘍の消失や縮小の程度によって判定する標準的なRECIST(Response Evaluation Criteria In Solid Tumors)によって行われる。
Blackburnらは、ジクロロ酢酸ががん細胞にアポトーシスを誘導することなく、増殖を停止させる作用によって抗腫瘍効果を発揮することを報告している。
この論文では、経口のジクロロ酢酸治療によって、重度の毒性を示すことなく、がん細胞の増殖が約4年間抑えられているステージ4の大腸がんの57歳の女性の症例を報告する。
ステージ4大腸がんの自然経過は、腫瘍が進行性に増大し、最終的には死に至る。したがって、がんの進行を抑えて病状安定の状態を維持できる可能性を有する増殖停止剤(cytostatic agent)としてのジクロロ酢酸の新規の使用法をこの症例は示している。
RECIST(Response Evaluation Criteria In Solid Tumors)は固形がんに対して抗がん剤治療の効果を評価する世界統一基準です。がんの数や大きさ(標的病変)とそれ以外の測定項目(炎症や腹水など、非標的病変)の両方をあわせて判定します。総合評価は「完全奏効(complete response;CR)」「部分奏効(partial response;PR)」「安定(stable disease; SD)」「進行(progressive disease; PD)」に分類されます。
この論文では、遠隔転移があるステージ4の大腸がん患者が、ジクロロ酢酸ナトリウムを経口摂取する治療だけで、腫瘍の増大が抑えられ、病状の安定(SD)の状態が4年近く続いているという症例の報告です。以下、論文の内容の抜粋です。
ジクロロ酢酸ナトリウム(dichloroacetate sodium;DCA)はミトコンドリアのピルビン酸脱水素酵素を阻害することによってミトコンドリアでの酸素呼吸を亢進する作用があり、
ミトコンドリアの異常によって引き起こされる先天性の乳酸アシドーシスの治療に使われている。
このような使用経験からDCAの安全性は確かめられている。実際、循環器系や呼吸器系や泌尿器系や骨髄に対する毒性は認められていない。
最も多い副作用は末梢神経障害であるが、これは可逆性であるため、薬を中断すれば回復する。
肝臓酵素の血中レベルの上昇が少数例で報告されている。
がん治療におけるDCAの効果について臨床試験が行われ、その有効性が示されている。
しかし、これらの臨床試験は末期がん患者が対象で、使用期間も比較的短期間の検討である。
DCAの抗がん作用のメカニズムはミトコンドリアでの酸素呼吸の亢進だけでなく、他にも様々な機序が報告されている。
この中には、血管新生阻害、低酸素誘導因子-1α(HIF-1α)の発現抑制、V-ATPaseやMCT1への作用などがある。
DCAはcytotoxic(殺細胞作用)というよりcytostatic(増殖停止)に作用するが、抗がん剤など他の薬によるアポトーシスを亢進する作用がある。
DCAはアセチル-L-カルニチンとR体αリポ酸とベンフォチアミンを併用すると末梢神経障害の副作用を予防し、抗腫瘍効果を高めることができる。
300例以上の進行がん患者の観察的研究では、DCA治療は60〜70%の症例で有効性が認められている。
体重1kg当たり1日20〜25mgの用量で2週間服用して1週間休薬する投与法で、末梢神経障害を起こる確率は約20%程度である。
一方、この投与法で肝臓酵素の血中濃度の上昇は2%程度に認められている。
この論文では、DCAを経口摂取する治療法で、数年間に及ぶ増殖抑制効果を示した症例を報告している。
ステージ4の大腸がん患者で、通常の抗がん剤治療では生存期間の中央値は9〜12ヶ月と報告されている。
症例報告:
57歳の女性。
2010年の夏に直腸がん(中分化型腺がん)と診断された。
この時点でCT検査で肝臓と肺に多発性転移を認めた。肝臓には最大で3cm大の転移が多数認められた。
直腸はがんで閉塞しかかっていたので人工肛門を造設。
その後、FOLFIRI(5-FU+ロイコボリン+イリノテカン)+ベバシズマブ(アバスチン)のレジメでの抗がん剤治療を受けた。
その結果、原発腫瘍と肝臓や肺の転移が縮小し、腫瘍マーカーのCEAは診断時の260.9ng/mlから3.5ng/mlに減少した。
しかしその後、抗がん剤治療による腫瘍縮小効果は小さくなり、増大を抑えている状況になった。
一方、抗がん剤治療による副作用(口内炎、下痢など)や直腸がんからの出血が増悪した。2012年3月に代替療法を目的に著者のクリニックを来院。
疼痛に対してオピオイド系鎮痛薬を服用していた。
がんの代替医療を検討:
- 高用量のビタミンD3(1日10,000 国際単位)
- 高濃度ビタミンC点滴(50gを週に1回)
- ジクロロ酢酸ナトリウムを週に1回静脈注射(3,000mg, 49mg/kg)
- DCAの副作用を軽減するためにαリポ酸(ラセミ体)500mgをDCAを注射するときに静脈注射
- 経口のR体αリポ酸150mgを1日3回、アセチル-L-カルニチンを1回500mgを1日3回、ビタミンB1製剤のベンフォチアミンを1回80mgを1日2回
DCAとαリポ酸の静脈注射は抗がん剤投与から少なくとも2日間は空けて実施。内服のαリポ酸は抗がん剤点滴の前後1日間は中止。αリポ酸は強力な抗酸化剤であるため、抗がん剤の抗腫瘍作用を弱める可能性があるため。
副作用が認められなかったためDCAは1週間に1回4000mg(66mg/kg)まで増量している。高用量の投与では、注射直後の鎮静状態(sedation)の副作用が認められた。 - メトホルミンを追加:抗がん剤感受性を高めるため。1回500mgを1日1回から開始して1日3回まで増量
2012年9月までに抗がん剤の副作用(倦怠感、吐き気、嘔吐)が強くなり、抗がん剤の効果も無くなってきたため、患者自身の判断で全ての抗がん剤治療を中止した。
2013年3月にDCAは注射から内服に変更(注射は費用が高いため)
経口のDCAは1回500mg(8.2mg/kg)を1日2回、2週服用して1週休みのサイクル。
神経障害の予防の目的でアセチルL-カルニチン、ベンフォチアミン、R体αリポ酸を内服。
3から6ヶ月間隔でCT検査
DCAを1日1500mgに増量したら肝臓酵素の上昇と末梢神経障害の症状が強くなった。
CT検査で腫瘍の増大や新しい腫瘍の出現は認めず、CEAの値も変化なし。鎮痛薬のmethadoneの量が増えることもなかった。
全身状態の指標の一つであるECOG(Eastern Cooperative Oncology Group)のパフォーマンス・ステータス(Performance Status)のレベル1(肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる。例:軽い家事、事務作業)の状態を維持した。
このような腫瘍が縮小も増大もしない病状安定の状態が4年近く続いている。
この患者の病歴をまとめると、通常の抗がん剤治療を18ヶ月受け、さらに抗がん剤治療+DCA治療を6ヶ月受け、その後抗がん剤治療を中止して、経口のDCAとサプリメントの治療を受けて、腫瘍が増大せず安定(stable)の状態が4年近く継続しているという症例です。
米国国立がん研究所(National Cancer Institute)のがん統計では、ステージ4の大腸がんの14.4%で、5年以上の生存は抗がん剤治療を受けている場合が多く、抗がん剤治療を受けずに、がんが4年間増大しないのは極めて稀なので、この症例はDCAの効果の可能性が高いと言えます。
しかも、経口摂取によるDCA治療は長期間でも問題ないことをこの症例は示しています。
【ジクロロ酢酸治療で甲状腺髄様がんの再発が顕著に縮小した症例】
以下のような報告があります。
Medullary thyroid carcinoma relapse reversed with dichloroacetate: A case report(再発した甲状腺髄様がんのジクロロ酢酸による治療:症例報告)Oncol Lett. 2010 Sep; 1(5): 889–891.
【要旨】
患者は51歳の男性で、2001年に甲状腺髄様がんと診断された。アドリアマイシンによる抗がん剤治療が行われたが肺転移が出現し、がんは進行した。
その後、ジメチル‐トリアゼノ‐イミダゾールカルボキサミド(dimethyltriazenoimidazole carboximide)で治療を受け、腫瘍は縮小した。
その後も、様々な抗がん剤が繰り返し使用され、部分奏功の状態で7年間が経過した。
患者が58歳になった2008年10月に腫瘍が増大し、転移が広がった。
2008年の12月1日の血液検査で、甲状腺髄様がんの腫瘍マーカーであるカルシトニン(calcitonin)は38,611 pg/ml(正常は20 pg/ml以下)であった。
全ての抗がん剤が効かなくなったので、がんの代替療法の目的でジクロロ酢酸(1日に体重1kg当たり10mg)による治療を開始した。
2009年4月にはカルシトニンの血中濃度は2,000pg/mlまで低下し、2009年5月に行ったPET検査では、原発および転移の腫瘍の顕著な縮小が示された。
現在、患者は同じ量のジクロロ酢酸の内服を継続しており、2009年11月以降、腫瘍は縮小した状態で腫瘍マーカーも上昇せず、病状安定の状態が続いている。
甲状腺髄様がん(Medullary thyroid carcinoma)は甲状腺のカルシトニン(カルシウム濃度を下げるホルモン)を出す細胞(C細胞)から発生するがんです。日本人では甲状腺がんの1〜2%程度と稀な腫瘍です。
髄様がんはカルシトニンやCEAを分泌するので、血液中のカルシトニンとCEAは腫瘍マーカーとして用いられています。
約1/3は遺伝性(常染色体優性遺伝)です。
転移する前に見つかって手術で切除できれば根治しますが、転移すると予後は不良です。抗がん剤が効きにくいためです。
この論文の症例は、肺転移を伴った甲状腺髄様がんの患者です。
最初のアドリアマイシンは効果がなく、その後ジメチル‐トリアゼノ‐イミダゾールカルボキサミド(DTIC)と5-FUの併用療法、カルボプラチンとダウノルビシンの併用、サンドスタチン、エトポシドとカルボプラチンの併用など、様々なレジメでの抗がん剤治療が行われています。
それでもカルシトニンの血中レベルは13,280pg/mlとか20,074pg/mlといった高値で推移しています。
その後2005年にはカルボプラチン、イレッサ、サンドスタチン、ゾメタを併用してレジメで治療を受け、2005年の秋には骨転移による痛みの軽減目的でサマリウム153が使用されています。(注:サマリウム153はサマリウムと呼ばれる希少な金属元素の放射性同位体で、骨の内部に集積する性質があり、そこで放射線を放出することで、骨のがんや転移性骨腫瘍を死滅させる。)
2006年にはマイトマイシンCとシスプラチンとタルセバとサンドスタチンの組合せで抗がん剤治療が行われています。
しかし、腫瘍マーカーのカルシトニンは上昇を続け、2008年10月には25,843 pg/ml (正常は20 pg/ml以下)、2008年の12月1日は38,611 pg/mlまで上昇しました。
PET検査で肺や縦隔や脊椎などの転移が増えていました。
つまり、使える限りの抗がん剤を使った治療で、何とか7年間は持ったが、腫瘍の増殖は抑えきれず、もう治療薬が尽きたという状態です。
そこで2008年12月からDCA(ジクロロ酢酸)治療が始まりました。DCAは1日に体重1kg当たり10mgを服用し、副作用予防の目的でビタミンB1製剤のチアミン(Thiamin)を1日750mg服用しました。
治療を開始して2ヶ月後の2009年2月には腫瘍マーカーのカルシトニンは8,655pg/mlまで減少し、さらに2ヶ月後には2,000pg/mlまで低下しました。
DCA治療を開始して5ヶ月後の2009年5月のPET検査で腫瘍の数と大きさが顕著に減少しているのが確認されました。
2008年の10月には肺や縦隔の転移や骨転移やリンパ節転移など全ての転移巣が著明に縮小していました。
【ジクロロ酢酸ナトリウムを使った治療はがんの代替医療としてかなり有効】
DCAは1988年以降、小児の乳酸アシドーシスの治療に使われており、安全性は確認されています。
がん細胞では酸素が存在する状況でも、ミトコンドリアでの酸素呼吸が抑制され、解糖系が亢進し、乳酸の産生が亢進しています。この状態を好気性解糖やワールブルグ効果と言います。
がん細胞の乳酸産生を抑える治療は、がん細胞の増殖を抑制できます。その方法として、DCA、2-デオキシグルコース、メトホルミン、ケトン食の組合せが有効です。さらに酸化ストレスを高めるジスルフィラムやオーラノフィンなどの併用も有効です。(511話参照)
非ステロイド性抗炎症剤のスリンダクとジクロロ酢酸ナトリウムを併用すると酸化ストレスを高めて、がん細胞を死滅させるという報告があります。(365話参照)
ジクロロ酢酸ナトリウム(DCA)の使い方は以下のようになります。
1日に体重1kg当たり10から15mgで、1〜2回に分けて服用します。
注意する副作用は末梢神経障害です。
この副作用を軽減するために、ビタミンB1製剤(ベンフォチアミンなど)を併用します。アセチル-L-カルニチンやR体αリポ酸も末梢神経障害の予防に有効です。
1日量が体重1kg当たり10〜15mgで毎日服用か、少し多め(15〜20mg/kg)で2週間服用して1週間休むというサイクルでの服用など幾つかのレジメで使用されています。
DCAは熱で不活性化しやすいので、水に溶かして服用します。胃粘膜に刺激になるので食後に服用します。
ジクロロ酢酸ナトリウムと併用して抗腫瘍効果を高める方法として、ケトン食、2−デオキシ-D-グルコース、メトホルミン、ジスルフィラム、オーラノフィン、スリンダクなどがあります。
がん細胞のミトコンドリアを活性化して活性酸素の産生を高め、酸化ストレスを亢進して、がん細胞の増殖を抑え、アポトーシスを誘導する治療法は試してみる価値があると思います。具体的方法については以下のサイトをご参照下さい。
http://www.ketogenic-diet.org/oxidation-therapy/ketogenic-diet+oxidation-therapy.html
| « 525)医療大麻... | 527)がん組織... » |



