がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
705)精神的ストレスの軽減をターゲットにしたがん治療(その2):低用量ナルトレキソン療法とメラトニン
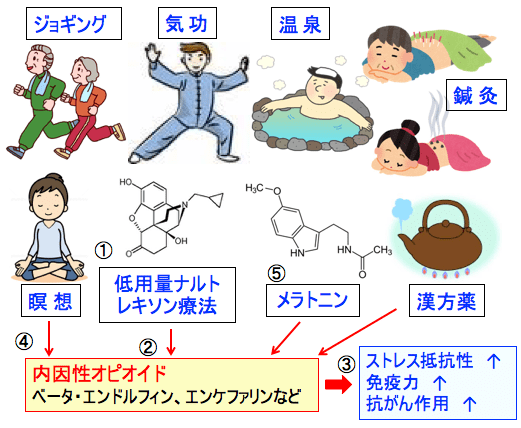
図:低用量ナルトレキソン療法(①)は脳内麻薬と言われる内因性オピオイド(ベータ・エンドルフィン、エンケファリンなど)の産生を高めて(②)、ストレス抵抗性や免疫力を高め、抗がん作用を発揮する(③)。気功や瞑想、イメージ療法、鍼灸、漢方薬、適度な運動、リフレッシュ、入浴(温泉)なども内因性オピオイドの産生を高める効果がある(④)。メラトニンもオピオイド系に作用してストレス抵抗性や免疫力を高める(⑤)。このような内因性オピオイドの産生や働きを活性化する方法を組み合わせれば、ストレスやがん細胞に対する抵抗力や治癒力を高めることができる。
705)精神的ストレスの軽減をターゲットにしたがん治療(その2):低用量ナルトレキソン療法とメラトニン
【がんの診断は強い精神的ストレスを引き起こす】
がんの生存率には3年や5年や10年などのデータが公表されています。
国立がん研究センターによる「がん診療連携拠点病院等院内がん登録生存率集計」によると2010年から2011年に診断されたがん患者の5年相対生存率(対象疾患以外による死亡を補正した5年後の生存率)は、がん全体(全がん)で66.4%です。
全てのステージを含めた臓器別では、前立腺がん98.8%、乳がん92.2%、大腸がん72.6%、胃がん71.4%、肺がん41.4%、肝臓がん40.4%、胆嚢がん29.3%、膵臓がん9.8%などとなっています。
早期のがんほど生存率が高いのは当然で、例えば、胃がんでは5年相対生存率はI期(94.7%)、II期(67.6%)、III期(45.7%)、IV期(8.9%)で、進行するほど生存率が低下します。
膵臓がんは、5年相対生存率はI期(45.5%)、II期(18.4%)、III期(6.4%)、IV期(1.4%)で、極めて予後が悪いがんと言えます。
膵臓がんの2013年に診断された患者の3年相対生存率はI期(56.4%)、II期(33.9%)、III期(12.7%)、IV期(2.7%)で、全ステージで3年相対生存率は18.0%です。
膵臓がんは早期の段階で発見されるのは稀で、多くは進行がん(ステージIIIやIV)の段階で見つかるので、膵臓がんと診断されると現在の治療法では3年後に生き残るのは5人に一人、5年後は10人に一人というのが現状です。肝臓転移や腹膜播種など遠隔転移があるステージ4では、3年生存率は3%以下、5年生存率は2%以下という厳しい状況です。
一方、前立腺がんでは、5年相対生存率はI期(100.0%)、II期(100.0%)、III期(100.0%)、IV期(61.3%)で、I期からIII期であれば5年相対生存率は100%です。
前立腺がんは高齢者が多いので、がん以外の死因を含む5年実測生存率はI期からIII期で85%から90%程度ですが、ステージIVでなければ、前立腺がんで死ぬことはほとんどないということです。
(出典:https://ganjoho.jp/reg_stat/statistics/brochure/hosp_c_reg_surv.html)
前立腺がんの場合、2003~2006年にがんと診断された前立腺がん患者の10年生存率はI期(100.0%)、II期(100.0%)、III期(96.7%)、IV期(43.3%)で、全てのステージを含めた10年相対生存率は97.8%です。
PSA検診などで早期に診断された前立腺がん患者の10年相対生存率はほぼ100%ですが、このような予後の良い前立腺がんでも、前立腺がんという診断で心筋梗塞や自殺が増えることが報告されています。
Immediate risk of suicide and cardiovascular death after a prostate cancer diagnosis: cohort study in the United States.(前立腺がん診断後の自殺と心血管疾患の直接的リスク:アメリカ合衆国におけるコホート研究)J Natl Cancer Inst. 2010 Mar 3;102(5):307-14.
米国のSEER(サーベイランス、疫学および最終結果)プログラムにおける1979年1月1日から2004年12月31日まで前立腺がんの診断を受けた342,497人のコホート研究です。前立腺がんの診断がついた日から12ヶ月間の追跡を行い、一般的な米国男性を対照にして、自殺率と心血管死亡率の相対的なリスクを算出しています。
その結果、前立腺がん患者は最初の1年間での自殺のリスクは高く(標準化死亡率=1.4, 95%信頼区間; 1,2から1.6)、特に最初の3ヶ月間でより高いことが明らかになっています(標準化死亡率=1.9, 95%信頼区間;1.4から2.6)。
心血管疾患による死亡リスクは、診断後最初の1年で軽度上昇(標準化死亡率=1.09、95%信頼区間;1.06-1.12)し、最初の1ヶ月で最大のリスク上昇(標準化死亡率=2.05, 95%信頼区間;1.89 – 2.22)を認めました。
がん診断に関連した自殺や心血管疾患による死亡は、がんの診断を受けて比較的早い時期に起こります。以下の報告は全てのがんを含めたデータです。
Suicide and Cardiovascular Death after a Cancer Diagnosis(がん診断後の自殺と心血管疾患死)N Engl J Med 2012; 366:1310-1318
スウェーデンにおける約600万人を対象にしたコホート研究での結果です。
がんと診断された患者の最初の1週間の間の自殺率は、がんの無いコントロール群に比べて12.6倍(95%信頼区間:8.6 - 17.8)で、最初の1年間の自殺率は3.1倍(95%信頼区間:2.7 - 3,5)でした。
心血管疾患による死亡率は、最初の1週間が5.6倍(95%信頼区間:5.2 - 5.9)、最初の4週間が3.3倍(95%信頼区間:3.1 - 3.4)でした。
時間の経過とともに、自殺率も心血管疾患の死亡率も減るということは、精神的ショックによるストレスの寄与が大きいことが考えられます。
つまり、がんと診断されることは、心筋梗塞の引き金になったり、自殺を増やすほど、精神的ストレスを高めることを示唆しています。
【精神的ストレスはがんの予後を悪くする】
精神的ストレスによる心理的要因ががん発生率を高め、がんの進展や予後(死亡リスク)にも悪影響を及ぼすことを前回(704話)解説しました。
人間はストレスを受けると、交感神経が刺激され、副腎皮質からはステロイドホルモンが分泌されます。
副腎皮質ホルモンは抗ストレス作用がありますが、免疫細胞のリンパ球を死滅し、マクロファージの貪食能も低下させます。副腎皮質ホルモンは免疫抑制剤として自己免疫疾患やアレルギー性疾患の治療に用いられています。
不安や恐怖心などの精神的ストレスがあると、食欲がなくなり、不眠に陥って体調が崩れます。
交感神経の緊張は消化管運動や分泌を抑制するので、このような状態が長く続くと、消化吸収機能の低下の原因となり、栄養障害から免疫力の低下の原因になります。
交感神経の過緊張は、血管を収縮させて組織の血液循環を障害し、新陳代謝や治癒力を低下させます。
(下図)

図:精神的ストレス(①)は脳の視床下部-脳下垂体系を介して、副腎皮質からステロイドホルモンが分泌され(②)、交感神経が刺激されて過緊張状態になる(③)。不安や心配は睡眠を悪くし、概日リズムを乱す(④)。副腎皮質ホルモンは免疫細胞のリンパ球を死滅し、マクロファージの貪食能も低下させ、免疫細胞の機能は低下する(⑤)。交感神経過緊張は血管を収縮させて組織の血液循環を障害し(⑥)、概日リズムの乱れや消化管機能の低下や血液循環障害は、食欲や組織の新陳代謝を低下させ、諸臓器機能を低下する(⑦)。このような様々なメカニズムが総合的に作用して免疫力が低下し(⑧)、がんの発生や再発・転移を促進する(⑨)。
ストレスを溜めやすい性格は、がんの発生率を高め、がんによる死亡リスクを高める可能性が指摘されています。抑うつ感情、不安感、絶望、社会的な孤立感という精神的要因ががんの進行を促進することも指摘されています。
ストレスに関連した精神的要因を軽減して、がんの予後の改善を目指す治療法として、精神的サポートや認知行動療法などの心理療法が有効であることを705話で言及しました。
実際に、精神的サポートを行う心理療法や認知行動療法によるストレスマネジメントによって精神的ストレスを緩和することによってがん患者の生存率を高めることが複数の臨床試験で示されています。
このような心理療法や精神的サポートに加えて、ストレス抵抗性を高める医薬品やサプリメントがあれば、がん患者の精神面でのサポートに役立つ可能性があります。
ストレス抵抗性を高める方法の一つに低用量ナルトレキソン療法があります。
【低用量ナルトレキソン療法は内因性オピオイドの産生を高めてストレス抵抗性を強化する】
ナルトレキソンはモルヒネに似た構造の化合物で、モルヒネなどのオピオイドとオピオイド受容体の結合を阻害する薬です。

麻薬中毒やアルコール中毒など薬物依存症の治療に使用されています。
依存症の治療に使う量の10分の1くらいの低用量のナルトレキソンを投与すると免疫力やストレスに対する抵抗力を高める効果が報告されています。
薬物依存症の治療に使用する量(1日50mg)では、脳内におけるオピオイドとオピオイド受容体の結合を完全に1日中阻害し、薬物依存を治す効果があります。しかし、この量の10分の1(3~5mg)の低用量を投与すると、その阻害作用は数時間しか続きません。
このように、内因性オピオイド(ベータ・エンドルフィンなど)とオピオイド受容体が1日数時間阻害される状況が続くと、体はその阻害されている状況を代償するためにフィードバック機序によって、より多くのベータ・エンドルフィンやエンケファリンなどの内因性オピオイドを産生するようになります。
たとえば、睡眠前に低用量(3~4.5mg)のナルトレキソンを服用すると、朝には体内でベータ・エンドルフィンやエンケファリンの産生が著明に高まると報告されています。

図:オピオイド(オピウム類縁物質、モルヒネ様物質)にはモルヒネなどのアヘンアルカロイド(①)とベータ・エンドルフィンやエンケファリンなどの内因性オピオイド(②)があり、神経細胞やリンパ球などの細胞のオピオイド受容体(③)に結合して、鎮痛作用や多幸感や免疫調節などの作用を発揮する。内因性オピオイドのうち、ベータ・エンドルフィンは鎮痛作用、抗ストレス作用、免疫力増強作用、気分高揚・幸福感の効果を発揮する(④)。メチオニン・エンケファリンはがん細胞の増殖を抑制する作用を持つ(⑤)。ナルトレキソンはオピオイドとオピオイド受容体の結合を阻害する(⑥)。1日50mg以上の高用量を投与するとオピオイド受容体の完全に阻害するので、モルヒネ中毒の治療に用いられる(⑦)。1日3〜5mg程度の低用量を投与すると、内因性オピオイドの産生を増やす結果、免疫調節、がん細胞の増殖抑制、炎症や神経障害の抑制、ストレス抵抗性の亢進などの効果を発揮する(⑧)。これを低用量ナルトレキソン療法という。
【内因性オピオイドとは】
強い痛みやストレスを受けると、生体はその苦痛を和らげるような作用をもつ物質を生成することが知られています。そのような物質の代表がベータ・エンドルフィンやエンケファリンなどの内因性オピオイドです。これらは鎮痛作用や快感をもたらすので脳内麻薬とも言われます。
ベータ・エンドルフィンはモルヒネが作用するμ-オピオイド受容体のリガンドとして作用し、強力な鎮痛作用を発揮します。
女性が出産する際には、この物質が分泌されて痛みをやわらげると言われています。
マラソンなどで長時間走り続けると、最初は苦痛に感じていても次第に快感を得るようになるという「ランナーズハイ」は、ベータ・エンドルフィンの分泌によると言われています。そのため、ジョギングが病みつきになると言われています。
肉体的な痛みや疲労が高まると、脳の下垂体部分からベータ・エンドルフィンが分泌され、肉体的・精神的な苦痛やストレスを抑えるのですが、同時に快感を与えるのです。
モルヒネやオキシコドンなどの麻薬系鎮痛薬を「オピオイド鎮痛薬」と言います。オピオイド(Opioid)とは「オピウム類縁物質」という意味で、オピウム(opium)はアヘン(阿片)の英語名です。
アヘン(阿片)はケシ(芥子)の未熟果から得られる液汁を乾燥させたもので、モルヒネやコデインなどの麻薬を含みます。モルヒネなどのアヘンアルカロイドが結合する細胞の受容体をオピオイド受容体と言います。
オピオイド受容体はモルヒネ受容体とも呼ばれ、モルヒネは脳内のオピオイド受容体に働いて、鎮痛作用などの効果を発揮します。
オピオイド受容体はモルヒネが作用する受容体として1973年に発見されました。そして、オピオイド受容体に作用する内因性の物質(内因性オピオイド)があるはずという予測のもとに研究が行なわれ、エンケファリン(1975年)やベータ・エンドルフィン(1976年)などの内因性オピオイドが多数発見されました。
つまりオピオイドとは、中枢神経や末梢神経に存在する特異的受容体(オピオイド受容体)への結合を介してモルヒネに類似する作用を持つ物質の総称で、植物由来の天然のオピオイド、合成・半合成のオピオイド、体内で産生される内因性オピオイドがあります。
モルヒネなどの外来性のオピオイドはアルカロイドという化合物ですが、内因性オピオイドはアミノ酸が数個から数十個つながったペプチドです。この内因性オピオイドは脳内に多く存在し、モルヒネと同様の作用を示します。鎮痛作用があり、また多幸感をもたらすため脳内麻薬と呼ばれています。
アヘンの歴史は極めて古く、紀元前3000年以上前にメソポタミアではケシの栽培が行われており、古代エジプトでは紀元前1500年前に、すでにアヘンを鎮痛薬として使用していたという記録が残っています。
このようにモルヒネの鎮痛作用や麻薬作用は古くから知られていたのですが、脳内にモルヒネと作用する受容体が存在することが明らかになり、そのモルヒネ受容体(オピオイド受容体)に作用する体内成分がもともと存在し、強い痛みや苦痛やストレスを和らげる体の抵抗力や治癒力となっていたのです。

図:オピオイド(オピウム類縁物質、モルヒネ様物質)には(①)、モルヒネなどのアヘンアルカロイド(②)と内因性オピオイド(③)がある。内因性オピオイドにはベータ・エンドルフィン(④)やメチオニン・エンケファリン(⑤)などがある。ベータ・エンドルフィンは鎮痛作用や抗ストレス作用、免疫増強作用、気分高揚や幸福感を引き起こす。メチオニン・エンケファリンはがん細胞の増殖を抑制する作用がある。これらのオピオイオドは神経細胞やリンパ球などの細胞のオピオイド受容体(⑥)に結合して、鎮痛作用や多幸感(⑦)や免疫調節作用(⑧)を発揮する。
【内因性オピオイドはがんに対する抵抗力を高める】
生体内のオピオイドは作用する受容体の違いによってエンドルフィン類(μ受容体)、エンケファリン類(δ受容体)、ダイノルフィン類(κ受容体)の3つに分類されます。
エンドルフィン(endorphin)は「体内で分泌されるモルヒネ」という意味で、アルファ、ベータ及びガンマの各エンドルフィンがあります。
ベータ・エンドルフィンは31個のアミノ酸からなるペプチドで、強い鎮痛作用があり、抗ストレス作用や忍耐力の増大や、身体的や精神的な苦痛を和らげる効果があります。
ベータ・エンドルフィンは、免疫にも非常に大きく関係しています。
体内に侵入した異物や体内に発生したがん細胞を攻撃するナチュラルキラー細胞やリンパ球にはベータ・-エンドルフィンに対するレセプター(受容体)が存在し、このレセプターにベータ・エンドルフィンが結合することによりこれらの免疫細胞が活性化します。
このように、ベータ・エンドルフィンは、強力な鎮痛作用の他に、抗ストレス作用、忍耐力増強、免疫増強などの効果があり、がんの治療にも役立つことが理解できます。
エンケファリン (enkephalin) は、5つのアミノ酸からなるペプチドで、C末端のアミノ酸がメチオニンのものと、ロイシンのものと2種類が存在します。すなわち、メチオニン-エンケファリン (Met-enkephalin) はTyr-Gly-Gly-Phe-Met 、ロイシン-エンケファリン (Leu-enkephalin) はTyr-Gly-Gly-Phe-Leuの5つのアミノ酸がつながった構造です。 このうち、メチオニン-エンケフェリンは別名「Opioid growth factor(オピオイド増殖因子)」とも呼ばれ、がん細胞の増殖を抑制する作用が報告されています。
このオピオイド増殖因子の受容体が膵臓がんや肝臓がん、卵巣がん、頭頸部扁平上皮がんなど多くのがん細胞に発現しており、オピオイド増殖因子(=メチオニン・エンケフェリン)が結合すると、細胞の増殖がストップすることが報告されています。
膵臓がん細胞を移植した動物実験においてメチオニン-エンケフェリンを投与すると、がんの縮小や延命効果が得られることが報告され、進行した膵臓がん患者を対象にした臨床試験でも腫瘍縮小効果が報告されています。
【内因性オピオイドの産生を高める低用量ナルトレキソン療法】
ベータ・エンドルフィンやメチオニン・エンケファリンのような内因性オピオイドの産生量を高めれば、体の治癒力や抵抗力を高めることができます。さらに、がん細胞の増殖を抑える効果も得られます。
ベータ・エンドルフィンは気持ちがいい、楽しいと感じたときに分泌され、免疫力を強化し、自己治癒力を高める作用があります。
瞑想や気功・太極拳をするとα波が出てリラクゼーションになるといわれますが、このときにもベータ・エンドルフィンの産生が高まることがリラクゼーション効果と関係することが報告されています。
がん治療におけるイメージ療法や気功の有用性が報告されていますが、その作用機序としてベータ・エンドルフィンの関与が指摘されています。
鍼灸が効くメカニズムの一つに、鍼灸の刺激によって体内のベータ・エンドルフィンの分泌が高まることが報告されています。
漢方薬に使用される生薬の研究でも、ベータ・エンドルフィンの分泌との関連を指摘した報告があります。体力増強や抗ストレス作用などのアダプトゲン効果の作用機序の一つに、ベータ・エンドルフィンの関与を指摘した意見もあります。
偽の薬であっても、薬を飲んだという暗示によって治癒効果が現れる現象をプラセボ効果といいます。プラセボ効果は、薬に対する期待感や、治療を受ける安心感、医師に対する信頼感などによって高くなりますが、プラセボ効果が最も良く現れるのが痛みに対する効果だと言われています。
この痛みに対するプラセボ効果も、期待感や安心感によって内因性オピオイドの産生が増えるためという意見もあります。
もともと、内因性オピオイド(脳内麻薬)は強い痛みや苦痛やストレスを和らげるための体の治癒力の一つです。
さらに、最近注目されているのが、低用量ナルトレキソン療法という治療法です。
ナルトレキソンはオピオイドとオピオイド受容体(μおよびδ受容体)の結合を阻害する薬で、麻薬やアルコールなどの依存症の治療に使用されています。
アルコール中毒に対しては、アルコール依存症の原因の一つとなる飲酒の報酬効果をブロックし、飲酒に伴う高揚感などを失わせることで、断酒を続けやすくする効果があるとされています。しかし、ある臨床試験では有効性が認められなかったという報告もあります。
オピオイドとオピオイド受容体の結合を拮抗阻害するナルトレキソンは1984年に米国のFDAに麻薬中毒の治療薬として認可されています。麻薬中毒の治療には1日50から100mgを使用しています。
マウスに神経芽細胞腫を移植した動物実験で、オピオイド受容体を持続的に阻害する高用量のナルトレキソンを投与すると腫瘍の増殖が促進され、オピオイド受容体を1日4~6時間だけ断続的に阻害する低用量のナルトレキソンを投与すると腫瘍の増殖が著明に抑制される現象をペンシルバニア州立大学のイアン・ザゴン(Ian Zagon)博士らがScienceに報告したのが1983年です。
この論文に注目したニューヨークのバーナード・ビハリ(Bernard Bihari)博士は、多くの疾患の治療に低用量ナルトレキソン療法を行い、エイズや様々な悪性腫瘍、自己免疫疾患、神経変性疾患などの疾患に有効であることを発見しています。
その当時、ビハリ博士はアルコール中毒や薬物依存の治療に従事しており、ナルトレキソンを薬物中毒やアルコール中毒の治療に使っていたようです。中毒の治療には1日50mg以上のナルトレキソンを服用しますが、ザゴン博士らの報告にヒントを得て、1日3~5mg程度の低用量のナルトレキソンを使って、様々な病気の治療を行い有効性を報告しています。
今までに、エイズ患者の免疫不全や多発性硬化症、クローン病、線維筋痛症に対する低用量ナルトレキソン療法の有効性を示す臨床試験の結果が報告されています。
薬物依存症の治療に使用する量(1日50mg)では、脳内におけるオピオイドとオピオイド受容体の結合を完全に1日中阻害し、薬物依存を治す効果があります。
しかし、この量の10分の1程度(3~5mg)の低用量を投与すると、その阻害作用は数時間しか続きません。このように、内因性オピオイドとオピオイド受容体が1日数時間阻害される状況が続くと、体はその阻害されている状況を代償するために、より多くのベータ・エンドルフィンやメチオニン・エンケファリンを産生するようになり、細胞のオピオイド受容体も増加すると言われています。
たとえば、睡眠前に低用量(3~4.5mg)のナルトレキソンを服用すると、朝には体内でベータ・エンドルフィンやメチオニン・エンケファリンの産生が著明に高まると報告されています。
体内でのベータ・エンドルフィンの産生増加は、免疫力増強や抗ストレス作用や耐久力増強や鎮痛作用の効果を引き起こすことが想定されています。
さらにメチオニン・エンケファリンは、がん細胞の増殖を抑える効果があります。
マウスを使った実験では、低用量ナルトレキソン療法が、DNA合成と血管新生を抑制し卵巣がん細胞の増殖速度を低下させることや、抗がん剤のシスプラチンの副作用(毒性)を軽減し、抗腫瘍効果を増強することが報告されています。(Exp Biol Med, 36(7): 883-895, 2011)
低用量ナルトレキソン療法によるがん細胞の増殖抑制の作用機序に関しては、脳下垂体や副腎からの内因性オピオイドの産生増加(エンドクリン機序)の他に、断続的なオピオイド受容体の阻害ががん細胞に直接的な増殖抑制効果をもたらすオートクリン機序をザゴン博士は重視しています。
すなわち、培養がん細胞を使った実験でも、持続的にナルトレキソンを作用させるとがん細胞の増殖が促進され、断続的にナルトレキソンを作用させると、がん細胞内でのオピオイド増殖因子(=メチオニン・エンケファリン)とオピオイド増殖因子受容体の産生が増え、オートクリンの機序でがん細胞の増殖が抑制されるという研究結果が報告されています。

図:低用量ナルトレキソン療法は、ベータ・エンドルフィンやメチオニン・エンケファリン(オピオイド増殖因子)などの内因性オピオイドの産生とオピオイド受容体の両方を増やす作用がある。ベータ・エンドルフィンは強い鎮痛作用をもち、ストレスに対する抵抗力を高め免疫力を増強する。さらに低用量ナルトレキソン療法は、がん細胞のメチオニン・エンケファリンとその受容体の量を増やし、オートクリン(自己分泌)の機序でがん細胞の増殖を抑制することが報告されている。
ビハリ博士が低用量ナルトレキソン療法を行ったがん患者の多くは標準治療で効果が無くなった状態でしたが、約60%の患者に効果を認めたと報告しています。論文報告ではありませんが、24%の患者で75%以上の腫瘍縮小、35%の患者で病状安定あるいは腫瘍の縮小傾向を認めたと言っています。
がんの臨床例に関する有効性の検討は、症例報告や予備試験のレベルのものしかなく、信頼度の高い臨床試験の結果はまだ報告されていません。ナルトレキソン自体の特許が取れないため、がん治療薬として開発を行う製薬会社がなく、費用のかかる大規模な臨床試験が行われないという事情があります。
しかし、低用量ナルトレキソン療法は内因性オピオイドの産生増加によって体に備わった免疫力や治癒力を高め、さらにオピオイド増殖因子によってがん細胞の増殖を抑制するというユニークな作用機序と、副作用がほとんど無く安価な治療法であるので、がんの補完代替医療として世界中で利用者が増えています。
【メラトニンはオピオイド系を介してストレス抵抗性を高める】
メラトニンは強力な抗酸化作用とフリーラジカル消去作用を有します。(661話参照)
メラトニンは、睡眠を誘導し、概日リズムを制御する松果体ホルモンとして、1958年に単離されました。
メラトニンの抗酸化作用が指摘されたのは1993年です。メラトニンがヒドロキシル・ラジカルの強力な内因性の消去物質であることが以下の論文で報告されました。
Melatonin : a potent, endogenous hydroxyl radical scavenger(メラトニン:強力な内因性のヒドロキシル・ラジカル消去剤)Endocrine Journal (1993)1:57-60
その後多くの研究で、メラトニンが生物最古の抗酸化物質であること、他の抗酸化物質と異なるユニークな性質を有することが明らかになっています。
メラトニンは細菌や藍藻から、真菌や線虫や昆虫や植物やヒトまでほとんどの生物に存在しています。生物が酸素を利用するようになった25億年前から存在していることが指摘されています。
約25億年前に光合成を行うシアノバクテリアが出現し、地球上の大気に酸素の量が増え、酸素を使ってエネルギーを産生する好気性細菌が出現します。このようにして生物が酸素を利用するようになったとき、発生する活性酸素の害を消去する目的でメラトニンが生成されるようになったと考えられています。つまり、メラトニンは生物最古の抗酸化剤です。
そして、生物の進化の過程で、抗酸化作用以外の様々な機能(概日リズムの制御、免疫調節など)を新たに獲得して生物に利用されています。
メラトニンは太古に発生した単細胞生物から現代の哺乳類や高等植物までの全ての生物において、生物をストレスから守る生体物質と言えます。
メラトニンは様々なストレスによる免疫抑制を阻止する作用があります。この作用はオピオイドとオピオイド受容体の結合を阻止する高用量のナルトレキソンによって阻止されることが報告されています。
つまり、メラトニンはオピオイド系を介して抗ストレス作用を発揮することが示唆されています。
したがって、内因性オピオイドの産生を増やす低用量ナルトレキソン療法とメラトニンの併用は相乗効果が期待できます。
以上のように、ストレス耐性を高め、ストレスによるがんの悪化を抑制する方法として低用量ナルトレキソン療法は、体内におけるオピオイドとその受容体の作用を利用した副作用の少ない(ほとんど無い)方法と言えます。
低用量ナルトレキソン療法とメラトニンの併用は免疫力と抗酸化力を高め、さらにストレス全般に対する抵抗性を高める方法として有効です。さらに、イメージ療法や瞑想、気功、鍼灸、漢方薬、適度な運動、入浴など内因性オピオイドの産生を高めることはがん治療に役立つと思います。
| « 704)精神的ス... | 706)カンナビ... » |



