がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
641)トコトリエノールの抗がん作用(その3):浸潤・転移の抑制
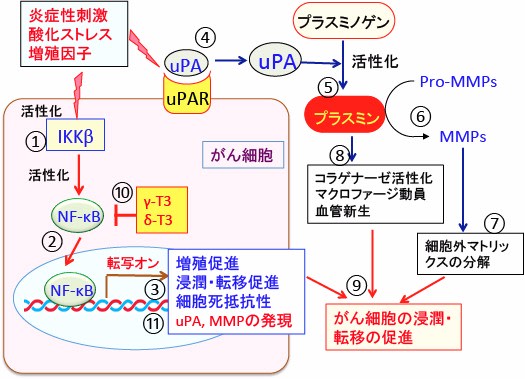
図:炎症や酸化ストレスや増殖因子など様々な刺激で活性化されたIκBキナーゼβ(IKKβ)は(①)転写因子のNF-κBを活性化して(②)、がん細胞の増殖や浸潤・転移や細胞死抵抗性に関連する遺伝子発現を促進する(③)。ウロキナーゼ型プラスミノゲン・アクチベータ(uPA)と結合するウロキナーゼ型プラスミノゲン・アクチベータ受容体(uPAR)ががん細胞の細胞膜に多く存在し(④)、がん細胞表面で活性化されたuPAはプラスミノゲンを切断してプラスミンを産生する(⑤)。プラスミンはマトリックス・メタロプロテアーゼ(MMPs)の前駆体(Pro-MMPs)を活性型のMMPに変換し(⑥)、活性化したマトリックス・メタロプロテアーゼ(MMPs)は細胞外マトリックスを分解する(⑦)。プラスミンはコラゲナーゼを活性化してコラーゲンを分解し、マクロファージを動員し、血管新生を亢進する(⑧)。これらの機序によってがん細胞の浸潤・転移が促進される(⑨)。ガンマ・トコトリエノール(γ-T3)とデルタ・トコトリエノール(δ-T3)はNF-κBの活性化を阻害してがん細胞の浸潤・転移を抑制する(⑩)。NF-κBによって誘導されるタンパク質にはuPAやMMPも含まれるので(⑪)、総合的にがん細胞の浸潤と転移が抑制される。
641)トコトリエノールの抗がん作用(その3):浸潤・転移の抑制
【デルタ-トコトリエノールは血管新生を阻害する】
ビタミンEの一種のトコトリエノール(特に、ガンマ型とデルタ型)が様々な機序で抗腫瘍効果を発揮することが明らかになっています(640話参照)
血管新生阻害作用も報告されています。以下のような報告があります。
delta-Tocotrienol suppresses VEGF induced angiogenesis whereas alpha-tocopherol does not.(デルタ-トコトリエノールはVEGFによる血管新生を抑制するが、アルファ-トコフェロールは抑制しない)J Agric Food Chem. 2009 Sep 23;57(18):8696-704.
【要旨】
最近、あまり知られていない種類のビタミンEであるトコトリエノール(T3)が、強力な血管新生阻害剤としてかなりの注目を集めている。しかし、ビタミンEの研究の大部分はトコフェロールに焦点を当てており、いくつかの研究ではα-トコフェロールが腫瘍血管の新生を妨げる可能性があることを示している。
本研究では、デルタ-トコトリエノールとアルファ-トコフェロールの血管新生阻害能の違いを明らかにすることを目的とした。
デルタ-トコトリエノールが2.5から5マイクロMの濃度で、ヒト臍帯静脈内皮細胞の増殖、遊走および管形成を完全に阻止したのに対して、同用量のアルファ-トコフェロールにはそのような効果は認められなかった。
ヒト臍帯静脈内皮細胞において、デルタ-トコトリエノールは血管内皮増殖因子受容体2(VEGFR-2)シグナル伝達を抑制し、カスパーゼを活性化した。
さらに、マウスのMatrigelプラグ血管新生アッセイによるin vivoの実験系において、デルタ-トコトリエノールは30 マイクログラムでがん細胞誘導性の血管新生を阻害したが、アルファ-トコフェロールは阻害しなかった。
以上の結果から、デルタ-トコトリエノールはアルファ-トコフェロールよりも優れた血管新生阻害活性を有し、両者の間に血管新生に対して異なる作用機序の存在が示唆された。
ビタミンEは8種類の異性体から構成されています。すなわちアルファ (α)、 ベータ (β)、ガンマ (γ)、 デルタ(δ)-tocopherols (トコフェロール)と α、 β、γ、δ-tocotrienols (トコトリエノール:T3)の8種類で、これらは全てビタミンE(vitamin E)になります。
ビタミンEはクロマン(Chromane)という分子式C9H10Oの環式化合物に炭素数16個の側鎖が付くという構造です。クロマンにつくメチル基(CH3)の位置によってα、β、 γ、 δに分けられます。
クロマン構造にそれぞれ炭素数16個からなる側鎖が付いています。トコフェロールは二重結合の無い飽和した側鎖です。フィチル(Phytyl)基という脂肪族側鎖です。
一方、トコトリエノールは3個の二重結合をもつ側鎖で、この構造はファルネシル(Farnesyl)基というイソプレノイドになっています。

図:ビタミンEはトコフェロールとトコトリエノールの2種類があり、クロマン(Chromane)という分子式C9H10Oの環式化合物に炭素数16個の側鎖が付くという構造を持つ。クロマンにつくメチル基(CH3)の位置によってアルファ (α)、 ベータ (β)、ガンマ (γ)、 デルタ(δ)に分けられる。トコフェロールは二重結合の無い飽和した側鎖で、トコトリエノールは3個の二重結合をもつ側鎖で、この構造はイソプレノイドになっている。
イソプレノイド(isoprenoid)というのは、C5単位の「イソプレン」が複数個結合してできた天然有機化合物群です。
ビタミンEの中でも、トコトリエノールは、総コレステロール値とLDL コレステロール値を低下させることが示されています。この作用はトコフェロールにはありません。
トコトリエノールがコレステロール値を低下させるメカニズムとして、トコトリエノールのイソプレノイド部分(ファルネシル基)が、コレステロール生成に必要なHMG-CoA還元酵素の量を減らす作用が明らかになっています。
すなわち、トコトリエノールはイソプレノイド構造を持つ点でトコフェロールと異なる薬効を示すことになります。
【デルタ-トコトリエノールはNF-κBを阻害する】
炎症性疾患やがんの治療のターゲットの一つにNF-κB(エヌエフ・カッパー・ビー、Nuclear Factor-kappa B)という遺伝子の転写を調節するタンパク質複合体があります。
遺伝子の発現(DNAをmRNAに転写すること)を調節するタンパク質を転写因子と言い、この転写因子はDNA上のプロモーターやエンハンサーといった転写を制御する部分に特異的に結合し、DNAの遺伝情報をmRNAに転写する過程を促進、あるいは逆に抑制する働きを持っています。
NF-κBは転写因子の一つですが、炎症反応や免疫応答や細胞増殖に関連する多くの遺伝子の発現を調節しており、NF-κBの活性化は様々な炎症性疾患やがんを増悪させることが明らかになっています。
NF-κBはほとんどの細胞に存在しています。
がん細胞では、NF-κBが活性化すると死ににくくなるので抗がん剤に抵抗性になり、増殖や転移が促進されます。さらに、がん細胞や炎症細胞のNF-κB活性が高まると、内皮細胞増殖因子(VEGF)や単球走化因子-1やインターロイキン-8(IL-8)やシクロオキシゲナーゼ-2(COX-2)など、腫瘍血管の新生に関与する蛋白質の産生が増加します。
炎症細胞やがん細胞に、炎症性サイトカン(IL-1, TNF-αなど)や酸化ストレス(放射線や活性酸素など)が作用すると、細胞内でNF-κBが活性化されます。このNF-κBを活性化するタンパク質がIκBキナーゼ(IKK)です。
NF-κBは細胞質に存在し、IκB(Inhibitor of κB)と呼ばれる制御蛋白質と複合体を形成し、不活性型で細胞質に局在しています。
炎症性刺激や酸化ストレスやプロテインキナーゼCなどによりIκBのセリン基をリン酸化するIκBキナーゼ(IKK)が活性化されてIκBをリン酸化し、さらに蛋白分解の目印となるユビキチンが結合し、プロテアソームで分解されます。
IκB が外れるとIκBでマスクされていた核内移行シグナルが露出して、NF-κBは核に移行できるようになります。NF-κBはDNA上のκBモチーフ (GGGACTTTCC) と呼ばれる配列に結合し、目的遺伝子の転写活性化を行います。(下図)
NF-κBの活性化を阻止することは、炎症性疾患やがんの治療に有効と考えられています。

図:NF-κBは細胞質に存在し、IκBと呼ばれる制御蛋白質と複合体を形成している(①)。炎症性サイトカイン(IL-1やTNF-αなど)や細菌由来のリポ多糖や酸化ストレス(放射線や活性酸素など)はIκBキナーゼ(IKK)を活性化してIκBをリン酸化する(②)。リン酸化されたIκBはさらにユビキチンが結合してプロテアソームで分解される(③)。IκBが外れるとNF-κB分子内の核内移行シグナルが露出してNF-κBは核に移行し、目的遺伝子の転写を行う(④)。NF-κBで活性化される遺伝子は炎症やがんの進展と関連するものが多い(⑤)。その結果、がん細胞の増殖は亢進し、アポトーシスが起こりにくくなって抗がん剤耐性となり、腫瘍血管の新生が促進される(⑥)。
デルタ・トコトリエノールががん細胞のNF-κBの活性を抑制して抗がん剤の効き目を高めることが報告されています。以下のような報告があります。
Vitamin E δ-Tocotrienol Augments the Anti-tumor Activity of Gemcitabine and Suppresses Constitutive NF-κB Activation in Pancreatic Cancer(ビタミンEδ-トコトリエノールは膵臓がんにおけるゲムシタビンの抗腫瘍活性を増強し、恒常的NF-κB活性化を抑制する)Mol Cancer Ther. 2011 Dec; 10(12): 2363–2372.
【要旨】
核因子κB(NF-κB)転写因子は、膵臓がんにおける細胞生存および化学療法抵抗性の重要な調節因子として機能している。最近の研究は、ビタミンEの不飽和型であるトコトリエノールは、膵臓がんを含む多くのがん細胞の増殖と生存を阻害する抗がん化合物の有望なクラスであることを示唆している。この研究では、トコトリエノールがNF-κB活性とヒト膵臓がん細胞の生存をin vitroとin vivoで抑制することを示す。
重要な点は、我々は、4つの天然トコトリエノール化合物(α、β、δおよびγ-トコトリエノール)の生物活性がインビトロおよびインビボでNF-κB活性を抑制する作用に直接関連することを見出した。
膵臓がんに対して最も生物活性のあるトコトリエノールはδ-トコトリエノールであり、δ-トコトリエノールはインビトロおよびインビボでの実験系で、膵臓がん細胞の増殖および生存を阻害するゲムシタビンの抗腫瘍活性を有意に増強した。
さらに、膵臓がん細胞および腫瘍におけるδ-トコトリエノールによるゲムシタビン活性の増強は、NF-κB活性の有意な抑制およびNF-κB転写標的[Bcl-XL, X-linked inhibitor of apoptosis (XIAP), and survivin]の発現と関連することを見出した。
我々の研究は、膵臓がんにおける天然ビタミンE化合物の活性の最初の包括的な前臨床評価を示している。これらの結果を考慮して、膵臓腫瘍細胞の生存と中間バイオマーカーとしてのNF-κBシグナル伝達成分を利用して、膵臓がん患者におけるδ-トコトリエノールの第I相試験を実施中である。この実験結果はまた、膵臓がんにおけるゲムシタビン活性を増強するためのδ-トコトリエノールの将来の臨床試験も支持する。
NF-κBの活性が亢進しているがん細胞は細胞死が起こりにくくなっていて、抗がん剤治療に抵抗性を示します。NF-κNは細胞の生存を促進するタンパク質(Bcl-2, Bcl-xL, cFLIP, IAP-1, IAP-2, XIAP, Bfl-1/A1, TRAF1, survivin)の発現を亢進します。さらに細胞の増殖 (c-Myc , cyclin D1), 炎症 (COX-2, 種々の炎症性サイトカイン), 浸潤 ( MMP-9, ICAM-1, ELAM-1, VCAM-1), 血管新生(VEGF)を促進するタンパク質の発現を亢進します。
従って、膵臓がんのゲムシタビンによる抗がん剤治療だけでなく、がん細胞のNF-κBの活性を抑制することは、多くのがん種において多くの抗がん剤の感受性を高める効果が期待できます。
トコトリエノールががん細胞で恒常的に活性化しているNF-κBの活性を抑制することは膵臓がん以外にも、乳がん、前立腺がん、肺がん、多発性骨髄腫、大腸がんなど多くのがん細胞株で報告されています。
γ-トコトリエノール とδ-トコトリエノールはIκBキナーゼ(IKK)を阻害してIκBの分解を阻止し、NF-κBの活性化を阻止するというメカニズムが報告されています。
抗がん剤治療中にデルタ・トコトリエノールを1日200から800mg程度を摂取すると、抗がん剤治療の効き目を高めることが期待できます。
【デルタ-トコトリエノールは細胞外マトリックスの分解を阻害する】
NF-κBは細胞外マトリックスの分解に関わるプラスミノゲン・アクチベータやマトリックス・メタロプロテアーゼの遺伝子発現を亢進します。デルタ・トコトリエノールは、NF-κBを抑制し、プラスミノゲン・アクチベータやマトリックス・メタロプロテアーゼの遺伝子発現を低下させることによって、がん細胞の浸潤や転移を抑制することが報告されています。以下のような報告があります。
Delta-tocotrienol inhibits non-small-cell lung cancer cell invasion via the inhibition of NF-κB, uPA activator, and MMP-9.(デルタ - トコトリエノールは、NF-κB、uPA活性化剤、およびMMP-9の阻害を介して、非小細胞肺がん細胞の浸潤を阻害する。)Onco Targets Ther. 2018 Jul 24;11:4301-4314. doi: 10.2147/OTT.S160163. eCollection 2018.
【要旨】
研究の背景:ビタミンEの異性体であるデルタ-トコトリエノール(δT)は、非小細胞肺がんを含むさまざまな種類のがんにおいて抗がん作用を示す。しかし、非小細胞肺がん細胞の浸潤を阻害するδTの効果およびその根底にある作用メカニズムは十分には研究されていない。
マトリックス・メタロプロテイナーゼ9(MMP-9)による細胞遊走および浸潤は、がん細胞の発生における重要なメカニズムである。多くのがん細胞においてMMP-9の発現が亢進しており、マトリックス・メタロプロテイナーゼの阻害が非小細胞肺がん細胞における浸潤および転移を抑制できることが示されている。したがって、マトリックス・メタロプロテイナーゼの抑制は非小細胞肺がんにおける細胞浸潤と転移プロセスを抑制するための有望な戦略でとなる。
目的:本研究の目的は、非小細胞肺がん細胞におけるδTの転移抑制作用の根本的なメカニズムとしてMMP-9阻害の可能性を検討することである。
方法:細胞増殖、遊走、浸潤、接着、および凝集能力に対するデルタ-トコトリエノール(δT)の効果を異なる細胞を用いて検討した。 ゲル・ザイモグラフィー(gel zymography)を用いてδTによるMMP-9酵素活性を検討した。リアルタイムPCRおよびウエスタンブロット分析を用いて、Notch-1およびウロキナーゼ型プラスミノーゲンアクチベーター(uPA)を介したMMP-9経路に関与するいくつかの細胞タンパク質、調節遺伝子、およびmiRNAを調べた。
結果:がん細胞の細胞増殖、細胞移動、浸潤、凝集、および接着をδTは濃度依存的に阻害し、MMP-9活性を低下させた。リアルタイムPCRおよびウエスタンブロット分析データは、δTがmiR-451発現を増加させ、Notch-1を介して核因子-κB(NF-κB)の発現を抑制し、その結果MMP-9およびuPAタンパク質の発現を抑制することを明らかにした。
結論:δTは、Notch-1およびNF-κB経路の抑制ならびにmiR-451の発現亢進を介したMMP-9/uPAの抑制により腫瘍浸潤および転移を抑制した。これらの結果は、デルタ-トコトリエノールが非小細胞肺がん細胞の転移に対して抑制効果を有する可能性を示唆している。
NF-κBによって転写が亢進される遺伝子に、細胞外マトリックスの分解に関わるウロキナーゼ型プラスミノーゲンアクチベータ(uPA)やマトリックス・メタロプロテアーゼ(MMPs)があり、NF-κBの活性阻害はがん細胞の浸潤や転移を抑制できます。デルタ・トコトリエノールはこのようなメカニズムでがん細胞の浸潤と転移を抑制するという報告です。
この内容の理解を助けるために、プラスミノゲン・アクチベータとマトリックス・メタロプロテアーゼについて解説しておきます。
【がん細胞は結合組織を分解して転移する】
がん(癌)は、体内の一部の細胞が遺伝子の変異などによって無制限に増殖するようになり、周囲の正常組織を破壊し、さらに他の臓器に転移し、最終的には人間を死にいたらしめる病気です。がんは早期に見つかれば根治が可能ですが、進行すると確実に治す治療法が無い病気です。
がんができた元の場所を原発巣といいます。がん細胞は原発巣から血液やリンパ液の流れに乗って別の場所にもがん細胞の塊を形成しながら全身に広がる性質を持っており、これを転移といいます。転移によって他の場所にできたがん細胞の集まりを転移巣といいます。
がん細胞は周囲組織に浸潤し、リンパ管に入ってリンパ節に転移したり、血管に入って遠隔の臓器や組織に転移します。また、腹部のがんであれば腹膜に播種し、胸部のがんは胸膜に播種する場合もあります。
がん死のほとんどは、がんが転移して全身に広がることによって起こります。つまり、がん細胞の周囲組織への浸潤や遠隔臓器への転移を防げれば、がん死を防ぐことができます。
がん細胞の転移は偶然に起こる現象ではありません。がん細胞が転移を成立させるためには何段階ものプロセスを経る必要があり、それぞれのステップで数多くの因子が関与しています。
例えば、がん細胞の運動を活発にし、がん細胞の移動を制限している結合組織などの細胞外マトリックスを分解する酵素を産生し、血管壁の内皮細胞の間から血管内に侵入し、血液に運ばれて他の臓器や組織に定着し、原発の部位とは異なる微小環境の中で細胞を増やすという過程が必要で、このどれが阻止されても転移は成立しません。(下図)
つまり、がん細胞の増殖活性を抑制するのと同時に、結合組織などの細胞外マトリックスを分解する酵素の活性を阻害すると、がん細胞の浸潤・転移を抑制し、がん死を防げることになります。

図:がん細胞は接着因子の異常あるいは消失により原発巣から離れ(①)、結合組織を分解し(②)、血管内へ侵入して(③)、血流に乗って他の組織や臓器に運ばれる(④)。さらに血管外にはい出して(⑤)、新たに接着因子を合成して離れた組織に定着して転移巣をつくる(⑥)。 原発巣のがん細胞が全身の組織や臓器に転移巣を作るためには、図の①から⑥に示すような多くのステップを経なければならない。
【プラスミンはフィブリンや細胞外マトリックスのタンパク質を分解する】
血液は血管内で固まることはなくスムーズに流れていますが、いったん血管が破れると、血液が体外に流れ出てしまわないように止血機構が働きます。この止血機構で活躍するのが血液細胞である血小板と血漿蛋白質のフィブリノゲンをはじめとする凝固因子です。
血管が破れると、まず血小板が塊になって血管壁に付着します(一次止血)。凝集した血小板からセロトニンが放出され、血管の収縮を助けて血流が低下します。
同時に、血漿中にある凝固因子やカルシウムが作用して血漿中のプロトロンビンをトロンビンに変換します。このトロンビンが可溶性(水に溶ける)のフィブリノゲンを不溶性(水に溶けない)のフィブリンに変換します。フィブリンは細長い線維状の分子で、集まって網目構造をつくり、そこに赤血球が絡まるようにして凝血塊ができます(二次止血)。破れた血管壁が再生されるまで、この凝血塊が傷を塞いでくれます。血液が固まるまでの時間は通常2~6分です(下図)。

図:血管が破れて出血すると、血液中の血小板が出血部位に集まり、血小板血栓が形成される(一次止血)。血液中の凝固因子が活性化されて網目状のフィブリンができる。フィブリン網が血小板血栓と一緒になって血栓として傷口を塞ぐ(二次止血)。
フィブリン血栓ができると、このフィブリン血栓を適切な大きさまで溶かして血管修復を完了させるシステムが血管内には存在します。これはフィブリン溶解系(繊維素溶解系、略して線溶系)と呼ばれています。フィブリン血栓が大きくなって血管を閉塞するのを防ぐメカニズムです。
このフィブリンを分解する酵素がプラスミンです。プラスミンは前駆体のプラスミノゲンとして血液中に存在し、組織型プラスミノゲン・アクチベータ(tPA)によってArg561とVal562の間で切断されてプラスミンとなり、フィブリン血栓を溶解します(下図)。

図:血管内皮細胞から産生される組織型プラスミノゲンアクチベータ(tPA)によってプラスミノゲンがArg561–Val562の限定分解によりセリン・プロテーゼのプラスミンとなる。プラスミンは血栓の主成分のフィブリンを加水分解して血栓を溶解する。
プラスミンは血栓の溶解だけでなく、コラーゲンやフィブロネクチンなどの細胞外マトリックス・タンパク質を分解して組織のリモデリングにも寄与します。
がん細胞の表面で産生されたプラスミンは結合組織の分解によって浸潤や転移を促進します。
血管内の血栓溶解(フィブリン分解)は血管内線溶と呼びます。「線溶」というのは「線維素溶解」のことで、線維素はフィブリンの事です。つまり、線溶というのはフィブリンを溶解する事です。
また細胞表面で生成したプラスミンは直接あるいは他のプロテアーゼの活性化を介して、細胞外マトリックスを含む多くの細胞外タンパク質の分解を行い、細胞の移動・浸潤、炎症、組織のリモデリングなどに寄与します。この反応を組織線溶と呼びます。
【がん細胞ではウロキナーゼ型プラスミノゲンアクチベータがプラスミンを活性化する】
プラスミノゲンをプラスミンに活性化するプラスミノゲン・アクチベータ(plasminogen activator:PA)には組織型PAとウロキナーゼ型PAがあります。
がん細胞の場合は、ウロキナーゼ型PA(uPA)がプラスミンを活性化しています。
ウロキナーゼ型プラスミノゲン・アクチベータ(urokinase-type plasminogen activator uPA)は411アミノ酸残基からなる分子量約55kDaの一本鎖糖タンパク質です。uPAはプラスミノゲンのArg561-Val562を限定分解し、プラスミンへと変換・活性化させるセリンプロテアーゼです。
がん細胞や炎症性細胞を含む多くの細胞にはuPAに対する特異的な受容体(uPAR)が存在します。uPARは細胞膜脂質二重層の外側に分布しており、uPAに結合することにより細胞表面にuPAを接着し、細胞周囲でのuPA/プラスミン/マトリックスメタロプロテイナーゼ系の活性化、およびそれに続く細胞外マトリックス(ECM)の分解を促進し、細胞の遊走に寄与します。
uPARにより細胞表面に局在化して活性化されたuPA/プラスミン系は、細胞の遊走や浸潤に関与します。がん細胞の周囲の細胞外マトリクス・タンパク質を分解して、がん細胞の周囲組織への浸潤、リンパ管や血管内への侵入による転移、血管新生を促進します。(下図)

図:ウロキナーゼ型プラスミノゲンアクチベータ(uPA)と結合するウロキナーゼ型プラスミノゲンアクチベータ受容体(uPAR)ががん細胞の細胞膜に多く存在する(①)。がん細胞表面のuPAはプラスミノゲンを切断してプラスミンを産生する(②)。プラスミンはマトリックス・メタロプロテアーゼ(MMPs)の前駆体(Pro-MMPs)を活性型のMMPに変換し(③)、活性化したマトリックス・メタロプロテアーゼ(MMPs)は細胞外マトリックスを分解する(④)。プラスミンはコラゲナーゼを活性化してコラーゲンを分解し、マクロファージを動員し、血管新生を亢進する(⑤)。これらの総合作用によってがん細胞の浸潤・転移が促進される(⑥)。
NF-κBを阻害する方法としてオーラノフィン、サリドマイド、ジインドリルメタンがあります(563話参照)。これらとデルタ・トコトリエノールを併用して、徹底的にNF-κBの活性を阻害する治療は試してみる価値はあると思います。
| « 640)トコトリ... | 642)がんは「... » |



