がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
492)ケトン体治療(その2):脂肪酸と血液脳関門
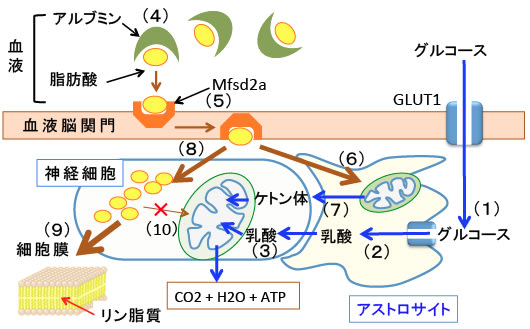
図:血液中のグルコース(ブドウ糖)は血管内皮細胞とアストロサイトのグルコーストランスポーター1(GLUT1)を通って血液脳関門を通過してアストロサイトに取り込まれ(1)、解糖系で乳酸まで分解され(2)、その乳酸はモノカルボン酸トランスポーターを通って神経細胞に渡され、神経細胞でピルビン酸に変換され神経細胞のミトコンドリアで代謝されてエネルギー(ATP)産生に使われる(3)。血液中では脂肪酸はアルブミンと結合して循環している(4)。脂肪酸は特殊なトランスポーター(Mfsd2a)などを使って血液脳関門を通過できる(5)。血液脳関門を通過した脂肪酸はアストロサイトではミトコンドリアでβ酸化されてエネルギー源として利用される(6)。飢餓時などグルコースが枯渇する条件ではアストロサイトは脂肪酸を分解してケトン体を産生する(7)。このアストロサイトが産生したケトン体は神経細胞に渡されてミトコンドリアで代謝されてエネルギー源になる。血液脳関門を通過した脂肪酸は神経細胞にも取り込まれる(8)。しかし、取込まれた脂肪酸の多くは細胞膜のリン脂質に取り込まれるなど、主に細胞構成成分の合成に利用される(9)。神経細胞はβ酸化に関与する酵素活性が低く、脂肪酸をβ分解してATPを産生することができない(10)。つまり、脂肪酸は血液脳関門を通過でき、神経細胞内にも取り込まれるが、エネルギー源としては使われない。神経細胞が脂肪酸をエネルギー源にしたくない理由が存在するため、進化の過程で神経細胞のミトコンドリアではβ酸化に関与する酵素が低下している。
492)ケトン体治療(その2):脂肪酸と血液脳関門
【人類は脳が発達したために進化の過程でケトン体産生能を高めた】
人類の祖先の類猿人から初期人類にかけての数百万年間は主に森林に生息して木の葉や果実などの植物性食糧が主体であったため、栄養素としては糖質が主体でした。
約250万年前から氷河期に入って森林が縮小すると、人類は森を離れ、狩猟採集によって食糧を得るようになり、動物性の食事が主体になって糖質摂取量は減っていきました。
約1万年前に最後の氷河期が終わり、農耕や牧畜が行われるようになり、人類は再び糖質の多い食事に戻りましたが、それまでの約250万年の間に人類は、低糖質食に適応するように代謝系が遺伝的に変化したと思われます。(376話参照)
その一つが「インスリン抵抗性の獲得」です。
インスリンは骨格筋と脂肪組織におけるグルコース(ブドウ糖)の取込みを促進し、肝臓での糖新生を抑制することによって血糖を低下させます。
糖質の少ない食事では、脳や胎児へのグルコースの供給を減らさないために、骨格筋や脂肪組織へのグルコースの取込みを低下させることや、タンパク質や脂肪から肝臓でグルコースを作る糖新生の能力を高めることことが必要です。人類が氷河期に生き残るために、インスリンの働きを低下させるように進化したのです。
インスリンは食事から吸収されたブドウ糖を血中から早く消失させる作用がありますが、食事からの糖質摂取量が少ない状況では、血中からブドウ糖が早く消失すると脳の働きや胎児の発育に支障をきたします。少ない血糖を脳や胎児に多く確保するために、インスリンの標的組織である筋肉や脂肪組織や肝臓でのインスリンの働きを弱める体質、すなわちインスリン抵抗性の体質を持つ方が生存に有利になります。
インスリンの働きが低下することを「インスリン抵抗性」と言います。つまり、インスリン抵抗性の形質を獲得することによって低糖質の食事に適応していったのです。このインスリン抵抗性が、近代になって糖質摂取が増えてから人類に様々な病気(糖尿病やメタボリック症候群など)を起こす原因となっています。(376話参照)
このようなインスリン抵抗性の獲得は人類以外の動物はあまり関係ないようです。脳の重量が小さい動物は、脳が使用するエネルギーも少ないからです。
チンパンジーの脳容積は400cc程度で、現代人の成人男性の脳容積の平均は約1350ccです。チンパンジーと同程度の脳容積しかなかった初期人類から、高度の知能をもった現生人類に進化する過程で脳容積は3倍以上に増えました。動物性の栄養素が増えたことが、人類の脳を大きく成長させ、知能の発達に大きく寄与したと言えます。
人類が肉食になり、脳が発達したことによって、知能が高まり、文明を発達させることができました。
一方、脳が発達したことによって脳のエネルギー消費が増え、低酸素や低血糖によってダメージを受けやすくなるという問題が出現しました。これを解決する進化的圧力によって、人類ではケトン体の利用を増やすように進化することになったのです。
人間の場合、脳が使用するエネルギーは体全体のエネルギー量の20%前後です。
神経細胞はエネルギー源としてグルコースを使います。脳は脂肪酸をエネルギー源として使用できないようになっています。脂肪酸をエネルギー源にすると低酸素や酸化傷害のリスクが高くなるからです(詳細は後述)。
健常な成人の脳では、脳組織100g当たり1分間に6〜7mgのグルコースが消費されています。これは1日に120〜130gに相当します。(成人の脳重量は1300〜1400g、1日は1440分なので、6mg x 14 x 1440 =約120g)
1日のカロリーを2000キロカロリーとして60%を糖質から摂取すると1200キロカロリーでこれは約300グラムの糖質になります。
つまり、通常では、摂取したグルコースの40〜50%を脳が消費していることになります。
したがって、飢餓などで食事からグルコース摂取が無くなると、脳のエネルギー源が不足します。
体内では肝臓と腎臓でグルコースが産生されます。これを糖新生といい、乳酸やグリセロールやアミノ酸などからグルコースを作ります。
長期間の絶食時には、肝臓で60%、腎臓で40%の比率で糖新生が行われます。ただし、糖新生で産生されるグルコースの量は1日に80グラム程度です。
1日の糖新生の量は、乳酸やピルビン酸から35-40g、脂肪由来のグリセロールから20g、たんぱく質由来のアミノ酸(主にアラニン)から15-20g、ケトン体から10−11gと報告されています。(Annu. Rev. Nutr. 2006. 26:1-22)
つまり、糖新生で産生されるグルコースだけでは、脳が必要とする1日120〜130gのグルコースは供給できないのです。
神経細胞はいろんな理由で脂肪酸をエネルギー源として十分に利用できません。進化の過程で脂肪酸を利用しない代謝系になっています。
そこで、肝臓でケトン体が産生されることになります。ケトン体は血液脳関門を構成し神経細胞にエネルギー源(乳酸など)を供給しているアストロサイトでも産生されます。
1日に100から150グラム程度のケトン体が産生できるので、グルコースに代わる脳のエネルギー源となります。1週間以上の長期の絶食時には脳のエネルギー源の60%以上がケトン体によって供給されます。(491話参照)
飢餓や絶食のときには、肝臓とアストロサイト以外にも、腎臓と小腸粘膜上皮細胞でもケトン体の産生が行われます。
アストロサイトはグルコースからグリコーゲンを合成してグリコーゲンを貯蔵することもできます。(482話参照)
グリコーゲンはグルコースが長く結合して構造で、必要に応じてグルコースに分解されてエネルギー源に使用されます。肝臓や筋肉にもグリコーゲンが貯蔵されています。
アストロサイトは神経細胞のエネルギー産生をサポートする働きを担っています。神経細胞がATP産生で酸素消費が増えて低酸素になったり、活性酸素の産生が増えて酸化ストレスが上昇しないように、グルコースは乳酸まで分解して神経細胞に与えています。そのため、神経細胞は解糖系の酵素の発現が低下しています。
脂肪酸のβ酸化の酵素の発現も低下しています。飢餓時に神経細胞は脂肪酸をエネルギー源にするのではなく、肝臓や腎臓やアストロサイトが脂肪酸を分解して作ってくれたケトン体を使うことで、低酸素や酸化障害のリスクを高めないでエネルギーを産生しています。
つまり、体は神経細胞を様々なダメージから様々な機序で保護しています。ケトン体の産生もその機序の一つです。
【神経細胞は脂肪酸を取込むがエネルギー源として利用しない】
血管と神経細胞は直接接していません。血管はアストロサイトによって包まれるようになっており、血管内皮細胞とアストロサイトが「血液脳関門」を形成しています。
血液脳関門はアストロサイトが神経細胞を守るための仕組みで、神経細胞への危険な分子の接触を妨げる「関所」の働きをしているのです。(482話参照)
「脂肪酸は血液脳関門を通過できないので脂肪酸をエネルギー源にできない」と一般に言われています。ケトン体関連の論文では、大御所のGeorge Cahillの最近の総説でも「脂肪酸は血液脳関門を通過できない」と記述されています。
しかし、「脂肪酸は血液脳関門を通過できない」という記述は間違いのようです。
正確に言うと、「脂肪酸は血液脳関門を通れるが、神経細胞は燃料(エネルギー源)として脂肪酸を利用できなくなっている」のです。
脳を低酸素や酸化傷害から守るため、進化の過程で脂肪酸を燃料(エネルギー源)として利用しないように進化したのです。
脂肪酸には、そのまま細胞に取込まれて、細胞膜などを構成するリン脂質や化学伝達物質(プロスタグランジンや内因性カンナビノイドなど)の材料になる役割と、燃料(エネルギー源)になる役割の2つがあります。
脳組織の50%以上は脂肪で構成されており、リノール酸(ω6)やアラキドン酸(ω6)やαリノレン酸(ω3)のような必須脂肪酸は合成できないので、当然のことながら食事からの脂肪酸が神経細胞に取込まれます。また、DHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)も体内での合成が少ないので、神経細胞の細胞膜を構成するリン脂質や化学伝達物質を合成するために、これらの脂肪酸を特殊な結合たんぱく質やトランスポーターを使って積極的に取込んでいます。
つまり、脂肪酸が血液脳関門を通過するメカニズムは存在し、神経細胞は構造と機能の維持のために、食事からの脂肪酸を積極的に取込んでいます。
しかし、神経細胞は脂肪酸をエネルギー源として使用しません。以下のような論文があります。
Why does brain metabolism not favor burning of fatty acids to provide energy? - Reflections on disadvantages of the use of free fatty acids as fuel for brain.(なぜ脳は、エネルギー源として脂肪酸の燃焼を好まないのか? - 脳のための燃料としての遊離脂肪酸の使用の欠点の考察) J Cereb Blood Flow Metab. 2013 Oct; 33(10): 1493–1499.
【要旨】
脳において水素分子が豊富な脂肪酸がエネルギー源としてほとんど利用されていないのは不思議である。長く信じられている「脂肪酸は血液脳関門の通過が遅い」というのが理由なのかもしれない。
しかしながら、この事実は実験結果によって確認されなければならない。そうでなければ、非エステル化された脂肪酸の蓄積とその代謝産物がミトコンドリアの機能を障害して、アポトーシス誘導の引き金になる可能性がある。
この論文においては、3つの問題点に焦点を合わせる。
(1)脂肪酸のβ酸化によるATP産生はグルコースよりも酸素消費が多いので、神経細胞がより低酸素になるリスクを高める。
(2)脂肪酸のβ酸化は活性酸素(スーパーオキシド)の産生を増やし、神経細胞の抗酸化システムは脆弱なので、神経細胞は強い酸化ストレスを受ける。
(3)脂肪酸の分解によるATP産生の速度はグルコースを燃料とする場合よりも悪い。したがって、神経活動を持続的かつ活発に行うのに必要なATPの産生には脂肪酸の酸化は適しない。
以上の観点から、神経細胞が脂肪酸を燃料として使用するには問題が多いため、それが神経細胞のミトコンドリア内での脂肪酸のβ酸化に関与する酵素の発現を低下させるような進化的圧力となり、脳内ではグルコースがエネルギー源として好まれるようになり、脂肪酸のβ酸化は行われなくなったと推測される。
炭素数16個のパルミチン酸を二酸化炭素と水までに完全に分解すると、1分子のパルミチン酸あたり106個のATPが産生されます。一方、グルコース1分子を完全に分解すると32個(30〜38個といわれているが、最近は32個が多い)のATPが産生されます。
ミトコンドリアは水素を燃焼させてATPを作るので、水素分子が多い脂肪酸の方がグルコースよりもエネルギー産生量が多いのに、なぜ神経細胞は脂肪酸を燃料にしないのかという疑問があります。
心臓や腎臓などエネルギー消費の多い他の臓器では、脂肪酸が主なエネルギー源として利用されています。心臓や腎臓ではエネルギーの60から80%が脂肪を酸化して産生しています。
神経細胞のシナプス伝達に神経細胞のエネルギーの80%が使用されています。脳の神経活動に大量のエネルギーが必要とされています。
脳で産生されるATPの90%はミトコンドリアでの酸化的リン酸化で産生されていますが、神経細胞ではエネルギー源として脂肪酸はほとんど使用されません。
神経細胞は解糖系酵素が低下しており、そのため、アストロサイトがグルコースを解糖系で乳酸にして、その乳酸を神経細胞に供給するという経路が存在します。
脳組織全体のエネルギーの約20%は脂肪酸を燃焼して産生していますが、脂肪酸を燃焼するのはアストロサイトです。神経細胞(ニューロン)はほとんど脂肪酸を燃焼しません。
最近の研究によると「脂肪酸が血液脳関門を通過できない」という記述は間違いのようです。DHAやEPAにアイソトープで標識した実験などでは、DHAやEPAが血液脳関門を容易に通過して神経細胞に取込まれていることが示されています。しかし、エネルギー源としては利用できない状況になっています。
同じ量のATPを産生するときに、グルコースの燃焼(解糖+TCA回路+酸化的リン酸化)よりも脂肪酸のβ酸化による燃焼の方が酸素消費は多く、活性酸素の産生も多くなります。酸素消費量は脂肪酸酸化の場合はグルコース酸化の場合より15%程度多くなります。
その結果、脂肪酸を燃料にすると、神経細胞は酸素不足になりやすく、さらに酸化傷害を受けやすくなるので、グルコースを主な燃料にするように進化したという考えです。
実際に、神経細胞のミトコンドリアでは脂肪酸を分解するβ酸化に関与する酵素の発現が少なくなっているので、脂肪酸を燃料にできにくくなっています。それは、脂肪酸をエネルギー源に使わない方が生存に有利になるので、進化の過程で神経細胞が脂肪酸を使わないように進化的圧力が作用としたと考えられます。
ケトン体(アセト酢酸とβヒドロキシ酪酸)はATP産生における酸素消費がグルコースより少ないことが知られています。したがって、神経細胞に脂肪酸を燃焼させるより、肝臓やアストロサイトで脂肪酸を分解してケトン体にして神経細胞に供給すると、神経へのダメージが軽減できます。
ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters)の MCT1と2を使って、細胞質とミトコンドリアに入ることができます。
このように、神経細胞がダメージを受けるリスクを下げるという進化的圧力が、神経細胞では脂肪酸は燃料として使わずに、グルコースとケトン体が燃料になったという考えは、進化論的には十分に納得できる説明です。

図:脂肪酸は血液中ではアルブミンと結合して循環している。脂肪酸は特殊なトランスポーターなどを使って血液脳関門を通過できる。取込まれた脂肪酸の多くは細胞膜のリン脂質など細胞構成成分の合成に使用される。神経細胞のミトコンドリアでは脂肪酸のβ酸化に関与する酵素の発現が低下しており、脂肪酸を燃料(エネルギー源)として利用できなくなっている。その理由は、脂肪酸の酸化はグルコースの酸化よりも酸素消費が多く、活性酸素の産生が多く、ATP産生に時間がかかるため、進化の過程で脂肪酸を燃料に利用しないようになったためと考えられている。
【ケトン体は脳を守る働きがある】
ケトン体の産生は、飢餓を生き延びるために進化の過程で獲得した代謝系です。
しかも、発達して大きくなった脳を守るために、特に人類で発達した代謝系と言えます。
人類は二足歩行を開始し、両手を使い、脳が発達し脳の体積は大きくなります。
二足歩行は骨盤を狭くし、脳が大きくなると、出産のときに産道を通過するのに時間がかかります。
その結果、動物の中で人類が最も出産時に脳の低酸素や低血糖で脳障害を起こしやすくなっています。
人間の胎児は他の動物に比べて太っている(体脂肪が多い)のは、出産時や出産後の脳へのケトン体の供給を増やして脳がエネルギー不足にならないように適応するためだという意見があります。
動物の中で絶食時にケトン体の生成が最も増えるのが人間です。
熊は冬眠している間は絶食状態で体脂肪が燃焼していますが、4〜5ヶ月絶食している間もケトン体は0.5mM以上に増えないと報告されています。
猿も人間ほどケトン体は上昇しません。イルカはどんな状況でもケトン体は増えません。
人間は体が使うエネルギーの20%くらいを脳が使っています。他の動物は5%以下です。
絶食したときに、脳が小さい動物はケトン体を作らなくでも肝臓や腎臓の糖新生だけで脳のエネルギーを十分に賄えるからです。
しかし、脳が大きく進化した人間の場合は、糖新生だけでは脳のエネルギーを満たせない状態になったので、ケトン体を懸命に作るように進化したと考えられています。
脂肪酸を燃焼すると神経細胞がダメージを受けやすくなるので、肝臓や腎臓やアストロサイトで脂肪酸を分解させてできたケトン体を神経細胞に運ぶという代謝系を作り出したと言えます。
小児や新生児はケトン体産生能が高いことが知られています。
成人が絶食してβヒドロキシ酪酸の血中濃度が3mMになるのに2〜3日間かかります。
一方、新生児や乳幼児は4〜8時間の絶食で2〜3mMに達します。
6歳の子供では24時間の絶食で4mMに達すると報告されています。(下図)
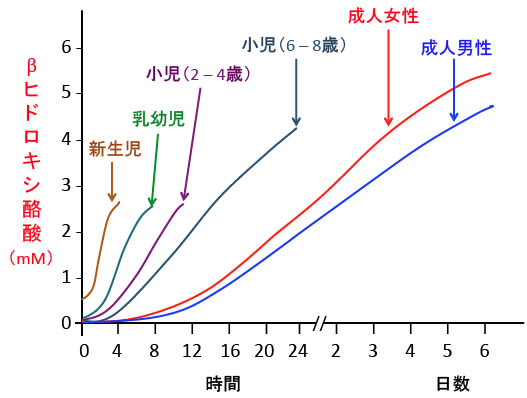
図:絶食後のβヒドロキシ酪酸の血中濃度(mM)。新生児や乳幼児や小児は数時間でケトン体の濃度は顕著に上昇する。体全体に対して脳が消費するエネルギー比率が高いほどケトン体は産生されやすい。(出典:Annu. Rev. Nutr. 2006, 26: 1-22)
これは、新生児や乳幼児や小児は成人に比べて、体に対する脳の重量比が大きく、エネルギー消費率も高いので、絶食によってグルコースが減少すると脳のダメージを受けやすいので、ケトン体を合成する能力が高くなっているためと思われます。
妊婦もケトン体産生量が高いことが知られています。妊婦は胎児が存在する分のグルコース消費が高いので、ケトン体の産生も高める必要があるからです。
絶食で体内に増えるケトン体が有毒であるのであれば、狩猟採取で食糧を得ていた氷河時代の人類が生き延びることはできなかったはずです。ケトン体はエネルギー消費量が大きくなった脳を飢餓時に守るために作られるようになったのです。
神経組織はグルコースよりケトン体を好んで使います。
医者の中にも「ケトン体が知能を低下させる」と考えている人はまだいますが、これは間違いであり、無知としか言いようがありません。
最近は、アルツハイマー病など神経変性疾患で、中鎖脂肪酸(MCTオイル)を積極的に摂取したり、ケトン体のサプリメントを補充する治療が注目されています。
例えば、βヒドロキシ酪酸のカルシウム/ナトリウム塩を製品化したものや、βヒドロキシ酪酸のナトリウム/カリウム塩を製品化したものなどがあります。
カルシウム/ナトリウム塩やナトリウム/カリウム塩はナトリウムなどの摂取量が増えるのでβヒドロキシ酪酸の摂取量は10〜30グラムが限界です。しかし、尿がアルカリになるので、βヒドロキシ酪酸の尿中排泄量が増えて酸性になる尿を中和してくれるメリットはあります。
これを摂取すると、ケトン食を実行しなくても血中のβヒドロキシ酪酸濃度を高めることができます。
MCTオイルを使ったケトン食にケトン・サプリメントを併用すると、さらにβヒドロキシ酪酸濃度を高めることができます。(詳細は次回)
このケトン・サプリメントはクリニックでも販売しています。(詳しくはこちらへ)

図:ケトン・サプリメントのKetoCaNaを20g(βヒドロキシ酪酸として約12g)摂取 すると、βヒドロキシ酪酸の血中濃度は、1~2時間後をピークに1mM(mmol/L)前後に上昇する。
| « 491)ケトン体... | 493)ケトン体... » |



