がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
862)アルテスネイトの抗がん作用(その2):ヘムとの相乗効果

図:がん細胞はトランスフェリン受容体(①)の発現が多く、細胞内に鉄を多く取り込んでいる(②)。ヘム(2価の鉄原子とポルフィリンから成る錯体)の合成も亢進している(③)。抗マラリア薬のアルテスネイト(④)は分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応して、活性酸素を発生する(⑤)。鉄イオンやヘムを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、フェロトーシスやアポトーシスの機序で細胞死を誘導する(⑥)。5-アミノレブリン酸はヘムの合成を促進する(⑦)。ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用によってヘムの合成を亢進する(⑧)。ジクロロ酢酸ナトリウムとジスルフィラムは活性酸素の産生を増やして、細胞死を促進する(⑨)。
862)アルテスネイトの抗がん作用(その2):ヘムとの相乗効果
【アルテスネイトは活性酸素を利用してがん細胞を死滅する】
体内で発生する活性酸素は、体の構成成分を酸化することによって、老化を促進し、動脈硬化性疾患やがんなど多くの疾患の原因となっています。また、慢性関節リュウマチや潰瘍性大腸炎などの自己免疫疾患や慢性炎症性疾患では、組織の炎症によって産生される活性酸素が疾患の進行や増悪を引き起こしています。したがって、一般的に活性酸素は体に有害と言えます。
一方、がん治療においては、がん細胞を死滅する手段として活性酸素を利用する方法が研究されています。すなわち、がん細胞内に活性酸素を増やし、細胞膜の脂質の酸化を促進してがん細胞を死滅する治療法です。
そもそも放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。
このような治療に対して、がん細胞は抗酸化酵素を誘導したりグルタチオンの産生量を増やして、細胞の酸化傷害に対する抵抗性を高めます。これが、薬剤耐性の一つのメカニズムになっているので、抗酸化酵素の誘導やグルタチオンの産生を阻害すると、これらの治療に対する効果を高め、さらに抵抗性獲得を阻害することができます。
放射線治療や抗がん剤治療以外で、がん細胞に活性酸素の発生量を増やす方法として、アルテスネイトやジクロロ酢酸ナトリウムなどがあります。
アルテスネイトについては前回(861話)解説しました。
アルテスネイト(Artesunate)は中国で古くからマラリアなどの感染症の治療に使われていた青蒿(セイコウ:Artemisia annua)というキク科の薬草から分離されたアルテミシニンの誘導体で、現在ではマラリアの治療薬として使用されています。
アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っています。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。(下図)

図:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
がん遺伝子のc-Mycや低酸素状態によって発現が誘導される低酸素誘導性因子1α(HIF−1α)という転写因子はトランスフェリン受容体の発現を高めています。鉄は細胞増殖に必要なため、がん細胞はトランスフェリン受容体を多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に障害を与えることができるのです。
【ジクロロ酢酸とメトホルミンはアセチルCoAを増やす】
コエンザイムA(CoA)は補酵素Aとも呼ばれ、生物にとって極めて重要な補酵素で、様々な化合物を結合することによって糖質や脂質やアミノ酸などの代謝反応に関わります。
補酵素Aはパントテン酸とアデノシン二リン酸、および 2-メルカプトエチルアミンから構成されており、末端にあるチオール基に様々な化合物のアシル基がチオエステル結合することによってクエン酸回路やβ酸化などの代謝反応に関わります。例えばアセチル基が結合したものがアセチルCoAです。(下図)

図:コエンザイムA(Coenzyme A; CoA)は補酵素Aとも言う。CoAにアセチル基が結合したものがアセチルCoAになる。
グルコース代謝の場合は、グルコース(ブドウ糖)が解糖系で作られたピルビン酸がミトコンドリア内に取り込まれてピルビン酸脱水素酵素複合体の作用で二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換され、アセチルCoAはクエン酸に変換されてTCA回路と電子伝達系によってさらにATPの産生が行われます。
脂肪酸はミトコンドリアにおけるβ酸化によってアセチルCoAを産生し、同様にTCA回路と電子伝達系によってさらにATPの産生が行われます。

図:グルコースは解糖系でピルビン酸に変換され(①)、ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素によって二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換される(②)。脂肪酸はβ酸化によってアセチルCoAを産生する(③)。アセチルCoAとオキサロ酢酸からクエン酸が生成される反応がTCA回路の最初のステップになる(④)。TCA(Tricarboxylic acid)というのは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、TCA回路はクエン酸回路とも言う。
脂肪酸合成が必要なときは、TCA回路で産生されたクエン酸の一部が細胞質に移行して、ATPクエン酸リアーゼによってアセチルCoAに変換され、脂肪酸合成に使われます。アセチルCoAは細胞膜を通過できないので、ミトコンドリアでできたクエン酸が細胞質に移行してアセチルCoAの合成に使われます。(下図)

図:TCA回路で産生されたクエン酸の一部は細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され、さらにマロニルCoAから脂肪酸が合成される。がん細胞は細胞の数を増やすために脂肪合成が亢進しており、これら脂肪酸合成に関与する酵素の活性が亢進している。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。さらに、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素を阻害することも報告されています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、細胞内のATP量を増やすために異化を亢進し、同化を抑制します。
「異化」と言うのは高分子の物質を分解してエネルギー(ATP)を産生することで、「同化」はより低分子の化合物から高分子の生体成分を作り出すことです。つまり、メトホルミンはAMPKを活性化してタンパク質やグリコーゲンや糖質や脂肪酸やコレステロールの合成を阻害します。その結果、がん細胞の増殖を抑制します。
AMPKは脂肪酸合成を促進するアセチルCoAカルボキシラーゼと脂肪酸合成酵素の活性を阻害します。
AMPKを活性化して脂肪酸の合成を阻害すると、細胞質のクエン酸とアセチルCoAが増えます。クエン酸はがん細胞の解糖系を阻害する効果によって抗腫瘍効果を発揮します。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進します。
メトホルミンとジクロロ酢酸は細胞内のアセチルCoAを増やします。アセチルCoAが増えると、核内タンパク質のヒストンや多くのタンパク質のアセチル化を引き起こして、がん細胞の増殖を抑える効果があります。

図: ジクロロ酢酸はピルビン酸脱水素酵素の活性を亢進してミトコンドリア内のアセチルCoAを増やす(①)。ミトコンドリアのTCA回路で生成されたクエン酸は、ミトコンドリアから細胞質に移行し(②)、ATPクエン酸リアーゼによってアセチルCoAに変換され(③)、アセチルCoAカルボキシラーゼによってマロニルCoAに変換され(④)、脂肪酸合成酵素によって脂肪酸が合成される(⑤)。メトホルミンはミトコンドリアの呼吸酵素を阻害する機序(⑥)でATP産生を阻害してAMP/ATP比を上昇させ(⑦)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(⑧)。活性化したAMPKはアセチルCoAカルボキシラーゼ(⑨)と脂肪酸合成酵素を阻害する(⑩)。その結果、がん細胞の増殖を抑制する。
ミトコンドリアにおける酸化的リン酸化が活性化して活性酸素の産生が高まるとがん細胞内で酸化ストレスが増大します。ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、酸化的リン酸化による活性酸素の産生が増え、酸化ストレスの増大によってがん細胞が死滅することが報告されています。ピルビン酸脱水素酵素を活性化する方法としてジクロロ酢酸ナトリウムがあります。
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから(25年以上前から)使用されています。がん治療の場合は、体重1kg当たり10~15mgを水に溶かして服用します。
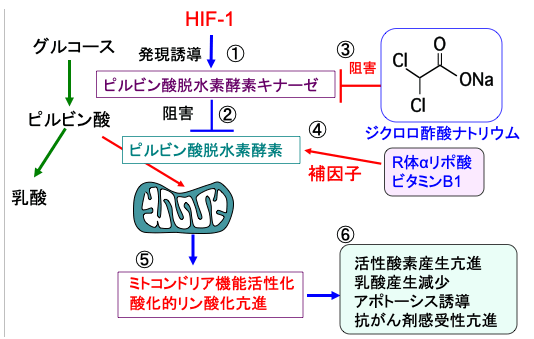
図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
【ヒストン脱アセチル化酵素阻害剤はアルテスネイトの抗腫瘍効果を高める】
アルテスネイトは鉄を多く含むがん細胞に選択的にダメージを与えます。鉄は細胞増殖に必要なので、がん細胞は鉄を細胞内に取り込むトランスフェリン受容体の発現を増やし、鉄の取り込みが亢進しています。
アルテスネイトを服用する数時間前に鉄剤を服用するとアルテスネイトの抗腫瘍効果を高めることができます。このとき、アルテスネイトと鉄剤が胃腸の中で接触して反応するのを防ぐため、両者の服用時刻を4時間以上あけることが重要です。
アルテスネイトとヒストン脱アセチル化酵素阻害剤の相乗効果が報告されています。以下のような報告があります。
Synergistic antitumor activity of artesunate and HDAC inhibitors through elevating heme synthesis via synergistic upregulation of ALAS1 expression(ALAS1発現の相乗的亢進による ヘム合成の上昇によるアルテスネイトとHDAC阻害剤の相乗的な抗腫瘍活性)Acta Pharm Sin B. 2019 Sep;9(5):937-951.
【要旨の抜粋】
アルテスネイトなどのアルテミシニン誘導体は、ヘム依存性の抗腫瘍活性を示すことが報告されている。一方、ヒストン脱アセチル化酵素阻害剤は、赤血球細胞におけるヘム合成を促進できることが知られている。それにもかかわらず、赤血球以外の細胞におけるヘム恒常性に対するヒストン脱アセチル化酵素阻害剤の影響は不明のままである。
我々は、ヒストン脱アセチル化酵素阻害剤とアルテスネートの組み合わせが、ヘム合成の調節を通じて相乗的な抗腫瘍活性を有する可能性があると予想した。
in vitro(試験管内)で研究では、アルテスネイトとヒストン脱アセチル化酵素阻害剤の組み合わせが相乗的に細胞死誘導を増強することが明らかになった。さらに、この併用は、異種移植モデルにおいて、明らかな毒性を示すことなく、アルテスネイトまたはヒストン脱アセチル化酵素阻害剤単独療法よりも効果的な抗腫瘍活性を示した。
重要なことに、メカニズム研究により、ヒストン脱アセチル化酵素阻害剤がアルテスネイトと協調して 5-アミノレブリン酸合成酵素1 (ALAS1) の発現とその後のヘム生成を増加させ、アルテスネイトの細胞毒性の増強につながることが明らかになった。
特に、5-アミノレブリン酸合成酵素1 (ALAS1)の遺伝子欠損は、がん細胞に対するアルテスネイトとヒストン脱アセチル化酵素阻害剤の相乗効果を大幅に低下した。これは、アルテスネイトの細胞毒性の発現における5-アミノレブリン酸合成酵素1の発現亢進が重要な役割を果たすことを意味する。
まとめると、我々の研究は、アルテスネイトとヒストン脱アセチル化酵素阻害剤の相乗的な抗腫瘍作用のメカニズムを明らかにした。この発見は、アルテスネイトと他のヘム合成調節因子に基づく組み合わせによるヘム合成経路の調節が固形腫瘍に対する有望な治療法であることを示している。
アルテスネイトの抗がん作用は鉄剤の投与によって増強できます。さらに、がん細胞にヘム合成を促進する方法も有効で、その方法としてヒストン脱アセチル化酵素阻害剤の併用が有効ということです。
ヒストン脱アセチル化酵素阻害剤として、ケトン食で産生が増えるβヒドロキシ酪酸が有効です。つまり、ケトン食はアルテスネイトの抗腫瘍効果を高めることが予想できます。以下にヒストン脱アセチル化酵素阻害作用の抗がん作用について解説します。
【遺伝子(DNA)はヒストンに巻き付いている】
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。
細胞核内では、DNAはヒストンという球状のタンパク質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。
遺伝子がmRNAに転写されるためには、転写因子やRNAポリメラーゼなどの他のタンパク質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。

図:細胞核内でDNAとタンパク質(ヒストンなど)の複合体をクロマチンという。クロマチンが凝集している部分はDNAが強く折り畳まれており遺伝子転写が抑制されている。一方、クロマチンが緩んでいる部分は、遺伝子の転写が活発になっている。
【ヒストンアセチル化は遺伝子発現を亢進する】
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。

図:ヒストン・アセチル基転移酵素によってヒストン・タンパク質のリシン(リジンとも言う)のアミノ基(-NH2)にアセチル(CH3CO)基が結合するとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになる。その結果、遺伝子の転写が起こりやすくなる。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。アセチル基はグルコースや脂肪酸の分解によって産生されるアセチルCoAが使われます(下図)。

図:ヒストンアセチル基転移酵素はヒストンをアセチル化することによってクロマチン構造を緩めて遺伝子転写を活性化する。一方、ヒストン脱アセチル化酵素はヒストンのアセチル化を減らすことによってクロマチン(DNAとヒストンの複合体)を凝集して遺伝子転写を抑制する。アセチル基はグルコースや脂肪酸が分解して産生されるアセチルCoAから供給される。
このように、ヒストンのアセチル化などによって遺伝子発現を調節する現象を「エピジェネティクス(epigenetics)」と言います。
がん発症の原因は,がん遺伝子やがん抑制遺伝子の変異,すなわち塩基配列上の変化が蓄積し,細胞増殖,接着,細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティスの機序による遺伝子発現異常も発がんに大きく寄与していることが近年明らかになってきました。
このようながん細胞における遺伝子発現の変化の中で、遺伝子発現の活性を調節するヒストンアセチル化は重要な役割を果たすと考えられています。
【ヒストン以外のタンパク質の働きもアセチル化で制御される】
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には、p53, nuclear factor-κB (NF-κB), p65, CBP, p300, STAT3, tubulin, PC4, GATA factors, nuclear receptors, c-Myc, hypoxia-inducible factor (HIF)-1α, FoxO1, heat-shock protein (Hsp)-90, HMG, E2F, MyoD, Bcr–Abl, the FLT3 kinase, c-Raf kinaseなど多数が知られており、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
アセチル化されるタンパク質はヒストンだけでないので、最近は、ヒストンアセチル基転移酵素はリシンアセチル基転移酵素(lysine acetyltransferases) 、ヒストン脱アセチル化酵素はリシン脱アセチル化酵素(lysine deacetylases)と呼ばれるようになっています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。
すなわち、ヒストン脱アセチル化酵素の阻害剤ががん治療薬として注目され、実際に既に使用されている薬もあります。
ヒストン脱アセチル化酵素阻害薬としてボリノスタットという薬があります。皮膚などに生じる悪性リンパ腫の皮膚T細胞性リンパ腫に使用されています。ただし、保険適用外で自費で購入すると1日分が3万円近くかかるのと、副作用も強いので、他のがん治療に使うのは現実的ではありません。
【がん細胞はヒストン脱アセチル化酵素の活性が亢進している】
ヒストンや非ヒストンタンパク質のアセチル化はヒストン・アセチル基転移酵素とヒストン脱アセチル化酵素のバランスによって動的に制御されています。
細胞のがん化の過程で、ヒストンや非ヒストンタンパク質の脱アセチル化が進むことが明らかになっています。そして、がん細胞ではヒストン・アセチル基転移酵素の発現や活性が低下し、逆にヒストン脱アセチル化酵素の発現と活性が亢進していることが明らかになっています。(下図)

図:ヒストンや非ヒストンタンパク質のアセチル化の状況はヒストン・アセチル基転移酵素(HAT)とヒストン・脱アセチル化酵素(HDAC)のバランスで決まる。がん細胞ではヒストン・アセチル基転移酵素(HAT)の発現や活性が低下し、ヒストン・脱アセチル化酵素(HDAC)の発現や活性が亢進して、タンパク質の脱アセチル化が亢進している。
ヒストン脱アセチル化酵素の活性亢進は様々なヒストンアセチル化によって遺伝子発現に影響し、さらに非ヒストン・タンパク質の働きに影響し、これらの作用によって、がん細胞の脱分化、細胞増殖、浸潤・転移、細胞接着低下、アポトーシス抵抗性、血管新生を亢進し、がんの発生や悪性進展を促進する方向で作用しています。したがって、ヒストン脱アセチル化酵素を阻害することはがん治療の有力な方法になります。

図:ヒストン脱アセチル化酵素(Histone Deacetylase:HDAC)によるヒストン・アセチル化はがん細胞の発生過程と悪性進展過程の両方に関わる遺伝子の発現に影響する。がん細胞の発生過程においては、ヒストン脱アセチル化酵素(HDAC)は、無制限の細胞増殖や細胞分化の阻害(脱分化)やアポトーシス阻害に関わる遺伝子発現を亢進する。がん細胞の悪性進展においては、HDACは細胞接着の欠如や浸潤・転移や血管新生に関わる遺伝子の発現を亢進する。 (参考:J Histochem Cytochem 62:11–33, 2014のFig.5)
ヒストン脱アセチル化酵素の阻害を目標にした代替療法として、β-ヒドロキシ酪酸(ケトン食で体内で産生される内因性のヒストン脱アセチル化酵素阻害剤)、ジインドリルメタンなどがあります。アセチル基を供給するアセチルCoAを増やす方法として、ピルビン酸からアセチルCoAを変換するピルビン酸脱水素酵素を活性化するジクロロ酢酸ナトリウム、脂肪酸合成やメバロン酸経路を阻害してアセチルCoAの消費を抑えるメトホルミン、アセチル基の核内への運搬を担うアセチル-L-カルニチンなどがあります(下図)。

図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(①)。ケトン食で産生されるβ-ヒドロキシ酪酸、アブラナ科植物に含まれるジインドリルメタンはヒストン脱アセチル化酵素を阻害してヒストン・アセチル化を亢進する(②)。アセチルCoAはグルコースや脂肪酸の分解で産生される。ジクロロ酢酸ナトリウムとメトホルミンは細胞内のアセチルCoAの濃度を高め、アセチル-L-カルニチンはアセチル基を供給する(③)。アセチルCoAのアセチル基はヒストンアセチル基転移酵素によってヒストンのアセチル化に使用される(④)。ヒストン・アセチル化によってクロマチンが緩むと遺伝子転写活性が亢進する(⑤)。その結果、がん抑制遺伝子の発現亢進などによってがん細胞の増殖抑制、アポトーシス誘導、浸潤・転移の抑制が起こる(⑥)。
【ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する】
βヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。
グルコースのもとになる糖質の摂取をできるだけ減らし、がん細胞の増殖抑制効果があるω3系不飽和脂肪酸(αリノレン酸、エイコサペンタエン酸、ドコサヘキサエン酸)やオリーブオイルやケトン体を出しやすくする中鎖脂肪酸トリグリセリド(MCTオイル)のような脂肪を多く摂取するケトン食という食事療法が進行がんの治療に有効であることが報告されています。
ケトン食は、がん細胞にエネルギー源のグルコースの供給を減らし、がん細胞の増殖を刺激するインスリンの分泌を抑制する効果など、複数の作用機序でがん細胞の増殖を抑制します。
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害し、ヒストンのアセチル化を促進し、遺伝子発現を調節する作用があります。
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor.(内因性ヒストン脱アセチル化酵素阻害剤のβヒドロキシ酪酸による酸化ストレスの抑制) Science. 2013 Jan 11;339(6116):211-4
この論文において、筆者らは、ケトン体の一種のβヒドロキシ酪酸がクラスIヒストン脱アセチル化酵素を特異的に阻害することを明らかにしました。βヒドロキシ酪酸をマウスへ投与するとヒストンのアセチル化のレベルが上昇したのにくわえ、βヒドロキシ酪酸が蓄積する飢餓状態あるいはカロリーを制限したマウスの組織においてもヒストンのアセチル化のレベルは上昇していました。そして、ヒストン脱アセチル化酵素の阻害が遺伝子の転写状態の変化をもたらすことを示しています(下図)。
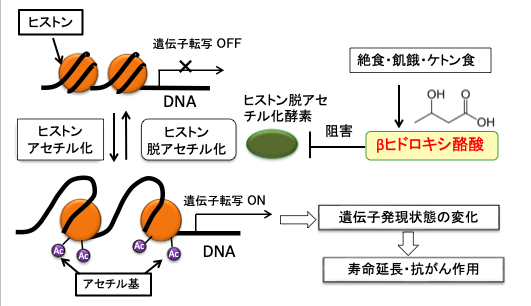
図:絶食やケトン食で体内で増加するケトン体の一種のβヒドロキシ酪酸は、ヒストン脱アセチル化酵素を阻害することによってヒストンのアセチル化を促進して、遺伝子発現状態に変化を及ぼす。その遺伝子発現の変化は寿命延長や抗がん作用と関連している。
ヒストン脱アセチル化酵素が阻害されてヒストンのアセチル化が増えると、いくつかの遺伝子の発現がオン(on)になり、細胞の機能に変化が起こります。
ヒストン脱アセチル化酵素の阻害剤として短鎖脂肪酸の酪酸が有名です。酪酸は、食物繊維を腸内細菌が嫌気性発酵させてできます。脂肪酸の分解過程で生合成されるほか、バターやチーズや皮脂にも含まれています。銀杏や足の悪臭の原因にもなっています。培養したがん細胞に酪酸を添加すると、増殖抑制や分化誘導が起こり、その作用機序は酪酸によるヒストン脱アセチル化酵素の阻害作用によるものです。
さて、絶食や飢餓状態やケトン食で産生されるケトン体のβヒドロキシ酪酸は酪酸のHがOHに変わっただけで化学構造が似ています。(下図)

βヒドロキシ酪酸は長期的な飢餓状態では6〜8mMにも達するので、飢餓状態などで産生されるβヒドロキシ酪酸がヒストンのアセチル化を介して遺伝子発現に作用して、細胞機能に影響するのではないかという仮説のもとに、βヒドロキシ酪酸にヒストン脱アセチル化酵素阻害作用があるかどうか検証する目的で本研究が行われています。
そして、研究の結果、培養細胞やマウスの動物実験でβヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害することが示され、さらに、飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6〜1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認されています。
ヒストン脱アセチル化酵素の阻害が、寿命の延長やがん細胞の分化誘導や増殖抑制に効果があることも多くの研究で明らかになっています。つまり、絶食やケトン食による健康作用や寿命延長作用や抗がん作用の一部は、βヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害作用が関与している可能性を示唆しています。
【酸化的リン酸化を活性化するとアルテスネイトの抗がん作用が増強する】
アルテスネイトは、非常に低濃度で体内のマラリア原虫を死滅します。マラリア原虫は赤血球内に感染します。マラリア原虫が感染した赤血球中では、マラリア原虫によって赤血球中のヘモグロビンが分解してフリーの鉄が蓄積し、その鉄とアルテスネイトが反応してフリーラジカルが発生してマラリア原虫を死滅させると考えられています。つまり、赤血球中のマラリア原虫の周りにはフリーの鉄やヘムが多く存在するので、アルテスネイトの効果が出やすいのです。

図:マラリア原虫は赤血球に感染する(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し(②)、これは鉄イオンやヘムと反応して、活性酸素を発生する(③)。マラリア原虫が感染した赤血球ではヘモグロビンが分解したフリーの鉄イオンが存在し、この鉄イオンを介して赤血球内で多量に発生した活性酸素は、マラリア原虫を死滅する。がん細胞はフリーの鉄を多く持つので(④)、がん細胞の細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、フェロトーシスやアポトーシスの機序で細胞死を誘導する(⑤)。正常細胞は鉄が少ないので、アルテスネイトによるダメージを受けない(⑥)。
がん細胞内の鉄やヘムの濃度は、マラリア原虫が感染した赤血球ほど高くはありません。したがって、マラリアの治療に比べて、がん細胞に対するアルテスネイトの効果はあまり強くありません。
しかし、アルテスネイトの抗腫瘍効果を高める方法が幾つか報告されていますので、それらを組み合せれば、強い抗がん作用が期待できます。以下のような報告があります。
The Role of Heme and the Mitochondrion in the Chemical and Molecular Mechanisms of Mammalian Cell Death Induced by the Artemisinin Antimalarials(アルテミシニン抗マラリア薬による哺乳類細胞死の化学的および分子的メカニズムにおけるヘムおよびミトコンドリアの役割)J Biol Chem. 2011 Jan 14; 286(2): 987–996.
この研究ではヒトがん細胞株のHeLa細胞と、HeLa細胞のミトコンドリアDNAを欠損させた細胞(HeLa ρ0)の2種類のがん細胞株を用いてアルテスネイトの抗腫瘍活性を比較しています。
ミトコンドリアは固有のDNA(ミトコンドリアDNA)を持ち、このミトコンドリアDNAには呼吸酵素複合体IからVを構成する85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
従って、ミトコンドリアDNAを欠失させるとミトコンドリアでの酸化的リン酸化によるATP産生が起こらなくなります。
ミトコンドリアDNAが欠損しても、酸化的リン酸化以外のミトコンドリアの機能は維持できます。がん細胞はミトコンドリアでの酸素を使ったATP産生を行わなくても、解糖系でATPを賄うことができるので、酸化的リン酸化が障害されても生存はできます。
アルテスネイト存在下で48時間培養した場合の50%細胞致死量はHeLa細胞が6 ± 3 μMで、ミトコンドリアDNAを欠損したHeLa ρ0細胞では34 ± 5 μMでした。
つまり、ミトコンドリアでの酸化的リン酸化が低下しているとアルテスネイトの殺細胞作用が減弱するという結果です。
また、アルテスネイトの殺細胞作用は、細胞のヘムの合成を亢進すると増強し、ヘムの合成を阻害すると減弱することを示しています。つまり、アルテスネイトの殺細胞作用の活性化にはヘムの存在が重要であることを示しています。
ヒストン脱アセチル化酵素阻害剤でヘムの合成を亢進するとアルテスネイトの抗腫瘍活性が亢進することに関しては前述の論文で紹介しました。
ヘムの合成を促進する方法としてアミノレブリン酸があります。以下のような報告があります。
Mechanistic Investigation of the Specific Anticancer Property of Artemisinin and Its Combination with Aminolevulinic Acid for Enhanced Anticolorectal Cancer Activity.(アルテミシニンの特異的抗がん特性とアミノレブリン酸との併用による抗結腸がん活性の増強に関するメカニズムの検討。)ACS Cent Sci. 2017 Jul 26;3(7):743-750.
アルテミシニンの殺細胞作用が正常細胞に比べてがん細胞に強く発現するのは、がん細胞ではヘムの合成が亢進していることを指摘しています。
そこで、ヘム合成の前駆物質の5-アミノレブリン酸(aminolevulinic acid)を添加してがん細胞のヘム合成を亢進するとアルテミシンの抗腫瘍活性が亢進することを示しています。
マウスの移植腫瘍を用いた実験でも、アルテミシン単独よりもアルテミシン+アミノレブリン酸の併用の方が高くなることを示しています。つまり、アルテミシンとアミノレブリン酸の併用によるがん治療の可能性を示唆しています。
5-アミノレブリン酸(5-aminolevulinic acid、5-ALA)は、ポルフィリン合成経路の最初の生成物です。動物においてはグリシンおよびスクシニルCoAからアミノレブリン酸合成酵素の作用で合成されます。
5-アミノレブリン酸は最終的にプロトポルフィリンIXとなり、鉄イオンを配位することで、血液中のヘモグロビンや薬物代謝酵素であるP450を構成するヘムとなります。
5-ALAはエイジングケア、食後高血糖対策、脂質減少などの目的でサプリメントとして市販されています。
5-アミノレブリン酸(5-Aminolevulinic Acid、ALA)はミトコンドリア内でδ-アミノレブリン酸合成酵素によって合成され、さらにヘム合成経路を経てヘム分子が生成されます。
医学の分野では、ALAが光感受性物質と結合して光線力学的療法(photodynamic therapy、PDT)に使用されることがあります。PDTはがん治療や皮膚疾患の治療に利用される非侵襲的な治療法であり、ALAはこの治療のための光感受性物質として作用します。患者にALAを投与し、がん細胞や病変組織に蓄積させた後、特定の波長の光を照射することで、光によって活性化されたALAが細胞を破壊する効果を発揮します。つまり、5-アミノレブリン酸(ALA)を投与するとがん細胞に集積します。5-アミノレブリン酸(ALA)を投与してアルテスネイトを投与するとがん細胞を死滅する効果が増強します。
以下のような報告があります。
Artesunate Enhances the Cytotoxicity of 5-Aminolevulinic Acid-Based Sonodynamic Therapy against Mouse Mammary Tumor Cells In Vitro(アルテスネートは、マウス乳腫瘍細胞に対する 5-アミノレブリン酸ベースの音響力学療法の細胞毒性を in vitro で強化する)Molecules. 2017 Mar 27;22(4):533.
音響力学療法 (SDT) は、超音波 (US) と音響増感剤の相乗効果によって腫瘍細胞を殺します。5-アミノレブリン酸 (5-ALA) は、がん治療のための音響増感剤として使用されています。しかし、研究では、5-ALA ベースの 音響力学療法が悪性腫瘍に対する有効性が限定的であることが示されています。
この研究では、アルテスネイト (ART) が in vitro でマウス乳腫瘍 (EMT-6) 細胞に対する 5-ALA ベースの SDT(音響力学療法) の細胞毒性を増強できるかどうかを調べました。
ART、ART + US、ART + 5-ALA、および ART + 5-ALA + US グループでは、細胞生存率は ART 濃度と相関し、ART 濃度の増加につれて低下しました。
形態学的には、ART + 5-ALA + US グループで多くのアポトーシス細胞と壊死細胞が観察されました。ART + 5-ALA + US 群の活性酸素種陽性細胞の割合も 5-ALA 群よりも有意に高く (p = 0.0228)、ART + 5-ALA + US によって誘導される細胞死が観察されました。抗酸化物質であるN-アセチルシステインによって抑制されました。これらの結果は、ART (アルテスネイト)ががん治療における 5-ALA ベースの SDT(音響力学療法) の有効性を高める大きな可能性を秘めていることを示しています。
以下のような報告があります。
A whole-genome scan for Artemisinin cytotoxicity reveals a novel therapy for human brain tumors(アルテミシニンの細胞毒性の全ゲノムスキャンにより、ヒト脳腫瘍の新規治療法が明らかになった)EMBO Mol Med. 2023 Mar 8;15(3):e16959.
【要旨】
天然化合物アルテミシニンは、世界中で最も広く使用されている抗マラリア薬である。その細胞毒性に基づいて、がん治療にも使用されている。アルテミシニンとその誘導体は、真核細胞のタンパク質に損傷を与えるエンドペルオキシドである。しかし、それらの明確な作用機序と宿主細胞の標的は、ほとんど解明されていないままである。
酵母および半数体幹細胞のスクリーニングを使用して、アルテミシニンの細胞毒性には単一の細胞経路、すなわちポルフィリン(ヘム)生合成が必要であることを実証した。ポルフィリン産生の遺伝的または薬理学的調節は、真核細胞におけるその細胞毒性を変化させるのに十分であった。
脳神経膠芽腫オルガノイドや患者由来の腫瘍スフェロイドなど、ヒト脳腫瘍の複数のモデルシステムを使用して、臨床的に承認されているポルフィリンエンハンサーであり外科用蛍光マーカーとして使用されている 5-アミノレブリン酸(5-ALA) を使用して、がん細胞をジヒドロアルテミシニンに対して感作させることができる。
アルテミシニンと 5-ALA の併用治療は、生体内での移植腫瘍を含む、試験したすべてのモデル系において脳腫瘍細胞を顕著かつ特異的に死滅させた。これらのデータは、アルテミシニンの細胞毒性の重要な分子経路と、薬剤耐性ヒト神経膠芽腫を含むさまざまな脳腫瘍を治療するための感作戦略を明らかにした。
【ジスルフィラムは還元型グルタチオンを枯渇する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖タンパク質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。 (下図)

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
以上から、アルテミシニン誘導体(アルテスネイト、アルテメーター)にβヒドロキシ酪酸(ケトン食やケトンサプリメント)、鉄剤、5-アミノレブリン酸の併用はがん細胞に選択的に細胞死(フェロトーシス、アポトーシス)を誘導できます。
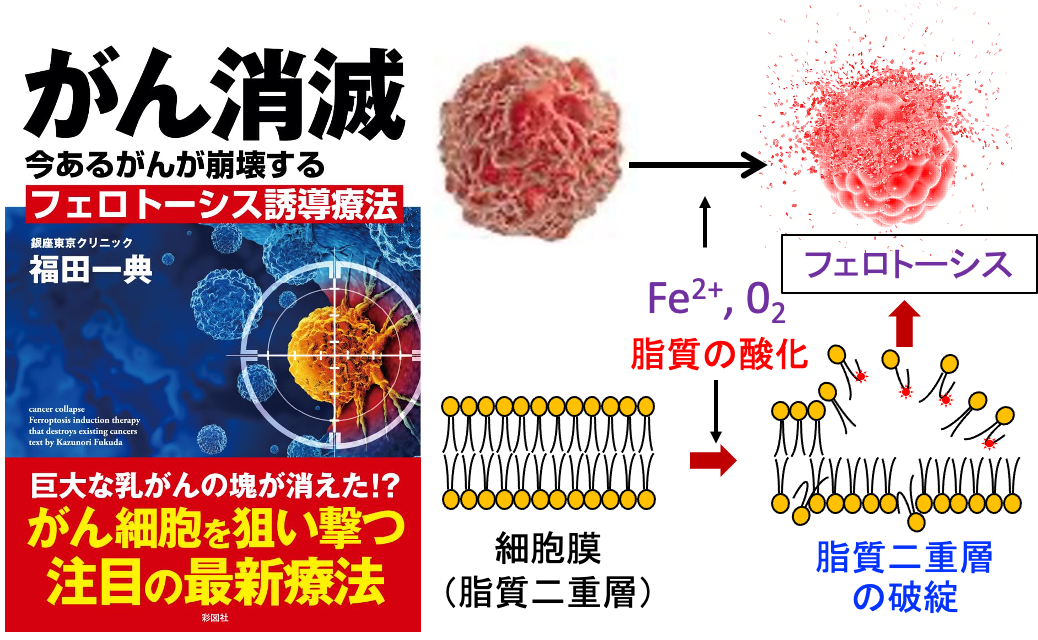
さらに、がん細胞に酸化ストレスを高めるジクロロ酢酸ナトリウム、ジスルフィラムの併用はさらに抗腫瘍効果を増強します。(トップの図)
これらの組み合わせで進行がんが縮小した例を経験しています。副作用もほとんど出ません。費用も安価です。試してみる価値はありそうです。
(ジスルフィラム以外はインターネットで入手できます。しかし、インターネットで購入してがん治療に使用する場合は、自己責任での使用になります。がんに効く量を使うと、副作用が出る場合もあります。)
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 861)アルテス... | 863) 5-アミノ... » |