がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
364)低酸素誘導因子-1(HIF-1)をターゲットにしたがん治療
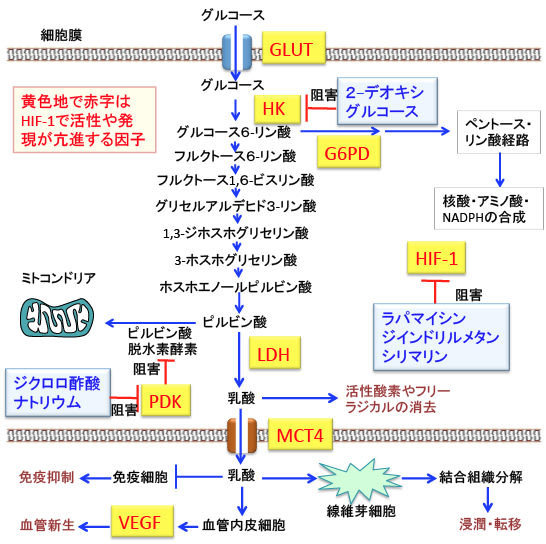
図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の黄色地で赤字で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
ラパマイシン、ジインドリルメタン、シリマリンがHIF-1の活性を阻害する作用が報告されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害してミトコンドリアでの代謝を活性化しHIF-1の活性を阻害する。2-デオキシグルコースはヘキソキナーゼを阻害して解糖系を抑制する。これらを組み合わせるとHIF-1の活性阻害と解糖系抑制とミトコンドリアの活性化による相乗効果による抗腫瘍効果が期待できる。
364)低酸素誘導因子-1(HIF-1)をターゲットにしたがん治療
【「抗がん剤治療を受けてはいけない」という意見は正しいのか?】
がんが進行すると標準治療では抗がん剤治療が主体になります。
しかし、固形がんや肉腫の多くに対しては現行の抗がん剤治療は効果が限定的なことと、正常細胞への毒性による副作用という欠点があるため、必ずしもメリットがあるわけではありません。
「抗がん剤治療は受けてはいけない」という趣旨の書籍がベストセラーになっている背景には、このような抗がん剤治療の限界と欠点があります。
しかし、副作用があっても、抗がん剤治療に勝る治療法がなければ、抗がん剤治療に頼らざるを得ないというのが、がん治療の現状でありジレンマです。
免疫療法や漢方治療やサプリメントを使った治療など様々な代替医療が行われていますが、現行の抗がん剤治療に置き換われるほどの有効性は得られていません。
標準治療というのは、現時点で最も有効性が高いと考えられている治療法です。
免疫療法や漢方治療やサプリメントなどを使った代替医療と言われている治療法も現行の抗がん剤治療よりも有効性が高いというエビデンス(証拠)がでれば標準治療になり得ますが、まだそうなっていないのは、抗がん剤治療の方が総合的に勝っているからです。
そこで、進行した固形がんや肉腫のに対する治療は、副作用というデメリットはあっても、抗がん剤に頼るしかありません。
効く抗がん剤が無い場合や、抗がん剤治療を受ける体力や抵抗力が無い場合には、「抗がん剤治療を受けてはいけない」という意見は正しいのですが、副作用を耐えられる体力がありがんの縮小効果が期待できるときは「抗がん剤治療を受けてはいけない」という意見は間違っているかもしれません。
抗がん剤治療の問題は、がん細胞の攻撃だけが目標になっていることです。
漫然とがん細胞を抗がん剤で攻撃するだけでは限界が見えています。
抗がん剤の効き目を高める(がん細胞の抗がん剤感受性を高める)方法を併用すれば、がんを消滅する確率を高めることができます。そのような方法を積極的に利用すれば、進行がんでも根治できる可能性があります。
抗がん剤が効きにくいという理由の一つが、がん幹細胞の存在です。がん幹細胞は様々なメカニズムで抗がん剤や放射線治療に対して抵抗性を持っているので、これらの治療に生き残り、再発や転移の原因になっています。
したがって、抗がん剤や放射線に対するがん幹細胞の感受性を高める方法の開発が重視されています。がん幹細胞を死滅させることができれば、進行がんでも根治できます。(がん幹細胞については前回の363話を参照)
【「正常細胞で活性が低く、がん細胞で活性が高い因子」をターゲットにすればがん選択性の高いがん治療ができる】
がん細胞に選択性の高い治療法の開発は副作用の少ないがん治療につながります。
抗がん剤治療の最も重要な問題点の「副作用」が発生するのは、それらの抗がん剤のがん細胞への選択性が低いからです。
「がん細胞への選択性が高い薬」というのは、がん細胞だけに作用し、正常細胞には作用しない薬のことです。
がん細胞に対する選択性が低い理由は、それらの抗がん剤が「がん細胞だけでなく、正常細胞の増殖や生存にも必要な経路」をターゲットにしているからです。
細胞分裂の過程を阻害すれががん細胞を死滅できますが、増殖している正常細胞(例えば、造血細胞や腸粘膜上皮細胞)も死滅することになります。
造血細胞や腸粘膜上皮細胞にダメージが及べば、貧血や白血球減少や消化管症状(食欲低下、吐き気、下痢など)などの副作用が発生します。
そこで、「正常細胞の増殖や生存には必要なく、がん細胞(特にがん幹細胞)の増殖や生存に必要なもの」、つまり、増殖している正常細胞では発現量や活性が低く(=正常細胞の増殖と生存には必要ない)、増殖しているがん細胞では発現量や活性が高い(=がん細胞の増殖や生存には必要な)シグナル伝達経路やタンパク質をターゲットにすれば、がん細胞に対する選択性や特異性の高い抗がん剤になります。
そのような因子やタンパク質やシグナル伝達経路をターゲットにすれば、副作用が少なく、有効性の高い治療法になります。
そのようながん治療のターゲットの候補の一つに低酸素誘導因子-1(Hypoxia-inducible Factor-1:HIF-1)という転写因子があります。転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。HIF-1のターゲット遺伝子は100種類以上知られており、エネルギー代謝、血管新生、細胞増殖、アポトーシスなど細胞の機能と深く関連している遺伝子の発現を制御しています。
HIF-1は細胞が低酸素状態におかれると活性化してきます。したがって、酸素が十分に利用できる状況で細胞分裂している正常細胞では必要がない転写因子です。
一方、多くのがん細胞では、低酸素状態であってもなくてもHIF-1の活性が亢進しています。
がん組織では急速な増殖で一部のがん細胞が低酸素になるので、その適応としてHIF-1の活性が高くなるのですが、実際は、低酸素でなくてもがん細胞ではHIF-1の発現量や活性が亢進しています。
がん細胞では、遺伝子変異などによって増殖のシグナル伝達系が恒常的に亢進しており、その結果としてHIF-1の活性が恒常的に亢進しているからです。
がん細胞の代謝の特徴である「解糖系の亢進とミトコンドリアでの酸化的リン酸化の抑制」という、いわゆるワールブルグ効果(Warburg effect)を根本で制御しているのがHIF-1と言っても過言ではなく、ワールブルグ効果をターゲットにしたがん治療を行うときには、HIF-1の活性を阻害することは重要です。
たとえば、2-デオキシ-D-グルコースなどで解糖系を阻害し、ジクロロ酢酸ナトリウムでミトコンドリアでのTCA回路と酸化的リン酸化を亢進すればワールブルグ効果をある程度は阻止できますが、さらにHIF-1の活性を阻害すれば、さらに効果は高まるということです。
【HIF-1は低酸素になると活性化される】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。(HIFのαサブユニットにはHIF-1α, -2α and -3α、βサブユニットにはHIF-1β, -2β and -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用)
すなわち、HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリルヒドロキシラーゼ(prolyl hydroxylase)により水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリルヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリルヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど、 多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
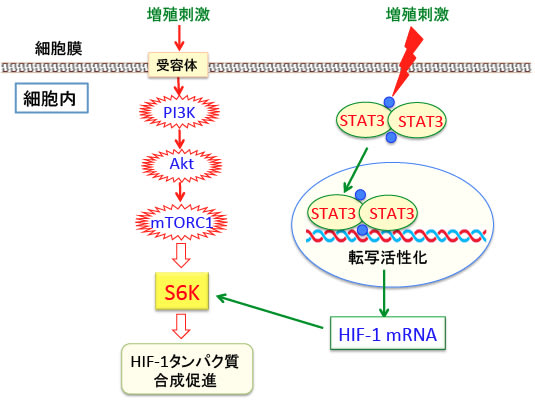
HIF-1はピルビンン酸脱水素酵素キナーゼ(下図のPDK:ピルビン酸脱水素酵素を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。

【要旨】
| « 363)mTORとヘ... | 365)非ステロ... » |





