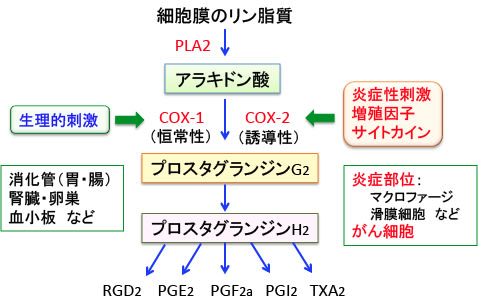
図:プロスタグランジンはアラキドン酸からシクロオキシゲナーゼ(COX)の働きにより合成される生理活性物質で、炎症の代表的なメディエーターとなる。細胞外から種々の刺激に反応して生体膜のリン脂質がホスホリパーゼA2 (PLA2)により、まず不飽和脂肪酸のアラキドン酸に変換される。この遊離したアラキドン酸を基質として、脂肪酸酸化酵素であるCOXの作用により、PGG2, PGH2へと変換され、さらに各種細胞に存在する特異的な合成酵素により生理的に重要な4種類のプロスタグランジン (PGD2, PGE2, PGF2a, PGI2)とトロンボキサン(thromboxane; TX)A2が合成される。COXにはCOX-1とCOX-2の2種類のアイソザイムが知られている。COX-1は生理的な役割を担い、COX-2は炎症や発がんに関連している。
多くのがん細胞でCOX-2の発現量や活性が亢進していることが知られており、そしてCOX-2阻害剤はがん予防効果や抗がん作用があることが報告されています。COX-2の選択的阻害剤の代表がcelecoxib(日本ではセレコックス、米国ではセレブレックスという商品名)で、celecoxibは抗がん剤治療との併用などでがんの治療への応用も検討されています。
Celecoxibのがん予防効果や抗腫瘍活性はCOX-2阻害作用との関連が重要ですが、COX-2阻害作用とは関連しない抗がん作用も知られています。つまり、非ステロイド性抗炎症剤の抗がん作用にはCOX依存性と非依存性のメカニズムが存在することが明らかになっています。
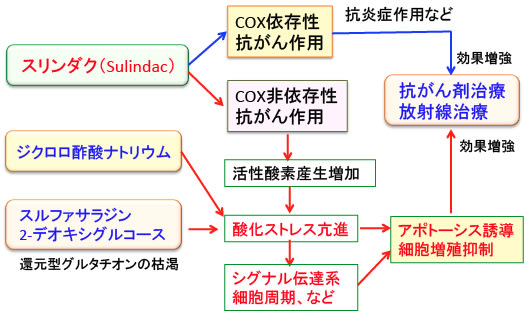
さて、非ステロイド性抗炎症剤の一つのスリンダク(sulindac)はCOX-1とCOX-2の両方を阻害する非選択的なCOX阻害剤です。COX阻害剤としての抗がん作用がありますが、スリンダクのCOX非依存的なメカニズムでの抗がん作用が注目されています。
それは、スリンダクががん細胞特異的に酸化ストレスを高めて、抗がん剤の効き目を高める作用があるからです。
図:スリンダクはプロドラッグ(それ自体は薬効がなく、体内で代謝されて薬効のある物質に変化する薬)で、肝臓で代謝されてSulindac sulfideとSulindac sulfoneになる。COX阻害作用があるのはSulindac sulfideであるが、SulindacとSulindac sulfideとSulindac sulfoneにはCOX非依存性の抗がん作用があることが知られている。その抗がん作用のメカニズムの一つにがん細胞の酸化ストレスを高める作用が注目されている。
【スリンダクはがん細胞の酸化ストレスを増強する】
以下のような論文があります。それの要旨を日本語訳しておきます。
Sulindac Enhances the Killing of Cancer Cells Exposed to Oxidative Stress(スリンダクは酸化ストレスによるがん細胞の死滅を促進する)
PLoS ONE. 2009; 4(6): e5804.
フロリダ・アトランティック大学(Florida Atlantic University)の研究グループからの報告。
【要旨】
研究の背景:スリンダクはFDA(米国食品医薬品局)が認可した抗炎症剤で、シクロオキシゲナーゼ-1と2(COX-1とCOX-2)を阻害することによってプロスタグランジンの産生を抑制することによって抗炎症作用を発揮する。スリンダクは抗炎症作用の他に、腺腫性大腸ポリープや大腸がんの発生を予防するがんの化学予防剤としても10年以上前から注目されている。
主な結果:ヒトの大腸がんと肺がんの培養細胞をスリンダクで前処理すると、tert-butyl hydroperoxideや過酸化水素のような酸化剤による殺細胞作用が増強される。
この効果はシクロオキシゲナーゼ阻害作用とは関連しない。この実験で使用した条件下で、スリンダクはがん細胞内における活性酸素種の産生を著明に高め、ミトコンドリア膜ポテンシャルを喪失させて、アポトーシスによる細胞死を誘導した。しかしながら、スリンダクの殺細胞作用は正常な肺細胞や大腸細胞には認められなかった。
この研究の重要性:これらの結果は正常細胞とがん細胞とでは酸化ストレスに対する対応が異なり、スリンダクはこの違いを促進することができる。したがって、酸化剤とスリンダクの併用はがん治療法として価値がある。
正常細胞とがん細胞には、酸化ストレスに対する対応が異なり、スリンダクはこの違いをさらに広げるように作用するので、正常細胞には毒性を示さず、がん細胞に酸化ストレスを高めてアポトーシスを誘導できるという報告です。
放射線治療や多くの抗がん剤ががん細胞に酸化ストレスを高めるので、このような治療にスリンダクを併用すると抗腫瘍効果を高めることができるという報告です。
がん細胞に酸化ストレスを高める方法としてジクロロ酢酸ナトリウムがあります。ジクロロ酢酸ナトリウムとスリンダクの併用が抗がん作用を示すという報告があります。
Combination of Sulindac and Dichloroacetate Kills Cancer Cells via Oxidative Damage
(スリンダクとジクロロ酢酸の組合せは酸化傷害によってがん細胞を死滅させる)PLoS One. 2012; 7(7): e39949.
【要旨】
スリンダク(Sulindac)はFDA(米国食品医薬品局)が認可している抗炎症剤で抗がん作用も報告されている。
スリンダクはがん細胞において活性酸素種の産生を増やしてミトコンドリア機能の異常を引き起こす機序によって、酸化剤に暴露されたがん細胞を選択的に死滅させる効果を増強することを、最近の我々の研究によって示した。
このようながん細胞に対するスリンダクと酸化ストレスの作用は、約50年前にワールブルグによって記述され現在はワールブルグ効果として知られているがん細胞における酸化的リン酸化の異常と関連している。
ミトコンドリアでの酸化的リン酸化の状態を変えるような化合物と組み合わせると、スリンダクのがん細胞に対する選択的な殺細胞作用が増強できるのではないかという仮説を立てた。
この仮説を検証するために、ピルビン酸の代謝を乳酸から酸化的リン酸化へシフトさせるジクロロ酢酸を用いた。
ジクロロ酢酸はミトコンドリアでの好気的な代謝を促進することによって、がん細胞に酸化ストレスを高めるので、スリンダクと同時に投与すると、がん細胞を死滅させる効果が増強すると予想される。
この研究において、スリンダクとジクロロ酢酸の組合せは、A549細胞とSCC25細胞の2種類の培養がん細胞に対する殺細胞作用を増強した。
予想したように、殺細胞作用のメカニズムは活性酸素種の産生とミトコンドリアの異常とJNKシグナル伝達系とアポトーシスによる細胞死が関与していた。
我々の結果は、スリンダクとジクロロ酢酸の組合せは有効ながん治療の候補となることを示唆している。
スリンダクは日本でも販売されている(1982年から)非ステロイド性抗炎症剤で、消炎・鎮痛剤として関節リウマチ、変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎などの治療に使用されています。
スリンダクには抗がん作用が報告されていますが、その抗腫瘍効果はシクロオキシゲナーゼ阻害作用だけでなく、酸化ストレスを高める作用が報告されています。
ジクロロ酢酸ナトリウムはミトコンドリアを活性化させて酸化ストレスを高めることによってがん細胞を死滅させる治療法です。スリンダクはがん細胞の酸化ストレスを高めるので、ジクロロ酢酸とスリンダクの併用は相乗効果によって抗腫瘍効果を高めることができるという報告です。
以下のような論文もあります。
Anticancer Res. 2009 Jan;29(1):435-41.
Inhibitory effects of 5-fluorouracil and oxaliplatin on human colorectal cancer cell survival are synergistically enhanced by sulindac sulfide.(ヒト結腸直腸がんの生存に対する5-フルオロウラシルとオキサリプラチンの阻害作用はsulindac sulfideによって相乗的に増強される)Anticancer Res. 29(1):435-441, 2009
この論文では複数の大腸がん細胞株を用いた培養細胞の実験系で、抗がん剤の5-FUとオキサリプラチンの抗腫瘍効果をスリンダクが増強するという結果を報告しています。正常細胞に対する毒性は増強しないので、がん細胞に選択的に抗がん作用を増強する可能性を報告しています。
Sulindac enhances the proteasome inhibitor bortezomib-mediated oxidative stress and anticancer activity.(スリンダクはプロテアソーム阻害剤のボルテゾミブによる酸化ストレスと抗がん活性を増強する)Clin Cancer Res. 11(14):5248-56.2005年
大腸がん細胞株を用いた実験系(培養細胞とマウスの移植腫瘍の実験系)で、プロタソーム阻害剤のボルテゾミブ (商品名:ベルケード)の抗腫瘍効果をスリンダクが増強することを報告しています。
ボルテゾミブはがん細胞の活性酸素の発生を増やして酸化ストレスを高めてがん細胞のアポトーシスを誘導する作用があり、スリンダクは活性酸素の発生量を増やすことによってボルテゾミブの抗がん作用を増強するというメカニズムを提唱しています。
その理由は、この相乗効果がフリーラジカルを消去するα-トコフェロール(ビタミンEやN-アセチルシステイン)によって阻害されるからです。
【がん細胞に酸化ストレスを高める治療】
NSAIDsはがん細胞にアポトーシスを誘導する作用が多くの実験で示されています。
そのメカニズムとして、シグナル伝達系や細胞周期を調節しているタンパク質への作用(例えば、NF-κB活性の阻害やMAPキナーゼの活性化など)や、ミトコンドリアに対する作用など様々な機序が想定されています。
最近の研究で、これらの様々なメカニズムの基礎にがん細胞の酸化ストレスを高める機序が指摘されています。
しかし、このような報告には相反する意見もあります。つまり、NSAIDsが抗酸化的に作用して細胞を酸化ストレスから保護するという報告もあります。
しかし、NSAIDsがミトコンドリアにおける活性酸素の産生を高めるという報告は多くあります。
例えば、アスピリンの代謝産物のサリチル酸塩(salicylate)は、そのO-ヒドロキシル基(o-hydroxyl group)がミトコンドリアの電子伝達系の複合体I(Complex I)のFe-Sクラスターと作用して電子伝達系を阻害し、活性酸素の発生を増やして酸化ストレスを高め、ミトコンドリアの膜の透過性を高め、チトクロームCの放出を引き起こしてアポトーシスを誘導することが報告されています。
今回紹介したスリンダクに関しても、がん細胞に選択的に酸化ストレスを高める作用が報告され、抗がん剤やジクロロ酢酸など酸化ストレスを高める治療法との相乗効果が指摘されています。
がん細胞に酸化ストレスを高めてアポトーシスを誘導する治療法がいろいろと検討されています。この方法に関しては
352話や
357話などで紹介しています。
スルファサラジンや2-デオキシグルコースなどグルタチオンの枯渇する方法(
346話)と併用すると抗腫瘍効果が高まる可能性もあります。
ジェームズ・ワトソンもがん細胞に酸化ストレスを高める治療の重要性を主張しています(
357話参照)。
抗がん剤治療やジクロロ酢酸ナトリウムを使った治療にスリンダクの併用はがんの代替医療として試してみる価値はあると思います。