がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
506)代謝をターゲットにしたがん治療(その1):ミトコンドリアを活性化するとがん細胞の増殖・転移が抑制される

図:(上)非増殖細胞(正常細胞)では、グルコースは解糖系でピルビン酸に変換されたあと、ほとんどのピルビン酸はミトコンドリアに入り、TCA回路と酸化的リン酸化(OXPHOS)でATP産生に使われる(1)。酸化的リン酸化の過程で活性酸素が発生する(2)。細胞には活性酸素を消去する抗酸化システムが備わっている(3)。ATPが過剰に産生されると、フィードバック機序で解糖系の活性を抑制する(4)。
(下)がん細胞では、グルコースの取込みと解糖系での代謝が亢進し、グルコースの多くは細胞増殖のための物質合成に使われる(5)。ピルビン酸は乳酸生成に向けられ、ミトコンドリアへの移行は制限されている(6)。グルタミンはTCA回路に入り物質合成に利用される(7)。ミトコンドリアでの活性酸素の産生亢進による酸化ストレスは、がん細胞の増殖や転移を抑制する(8)。がん細胞では酸化ストレスを軽減するために抗酸化システムが亢進している(9)。がん細胞における抗酸化システムの亢進および抗酸化性サプリメントの摂取はがん細胞の増殖・転移を促進することになる。
506)代謝をターゲットにしたがん治療(その1):ミトコンドリアを活性化するとがん細胞の増殖・転移が抑制される
【がん細胞は生存するために抗酸化システムを亢進している】
放射線や多くの抗がん剤は活性酸素を産生してがん細胞にダメージを与えて死滅させます。一方、がん細胞は細胞内の抗酸化システムを増強して活性酸素による酸化傷害からダメージを軽減しようとします。
酸化傷害を防ぐメカニズムとして、活性酸素を消去するグルタチオンやチオレドキシン、抗酸化酵素の発現を誘導する転写因子(Nrf2など)の活性化などがあります。
活性酸素は細胞内のタンパク質や核酸(DNAやRNA)に非可逆的なダメージを与える作用があり、その結果、細胞死(アポトーシス)が誘導されます。
それに対して、細胞内では抗酸化酵素(スーパーオキシド・ディスムターゼ、カタラーゼなど)や抗酸化物質(グルタチオンやチオレドキシンなど)によって活性酸素を消去して、酸化傷害によるダメージを軽減しようとする防御機構が存在します。
がん細胞はこの抗酸化システムを利用して、放射線や抗がん剤による細胞死に抵抗しています(下図)。

図:放射線や多くの抗がん剤は活性酸素を産生してがん細胞にダメージ(酸化傷害)を与え、アポトーシスを誘導して死滅させる。がん細胞(特にがん幹細胞)は、活性酸素を消去するグルタチオンやチオレドキシンの細胞内量を高めたり、抗酸化酵素の発現を誘導する転写因子のNrf2の活性を高めたりして、活性酸素によるダメージやアポトーシス誘導に抵抗性を示す。したがって、がん細胞の抗酸化力を減弱させる治療法は放射線治療や抗がん剤治療の効き目を高めることになる。
【ミトコンドリアでの酸化的代謝が転移を抑制する】
抗酸化剤ががん細胞の増殖と転移を促進することとそのメカニズムを前回(505話)解説しました。
がん細胞のエネルギー産生は解糖系に依存していますが、ミトコンドリアでの酸化的リン酸化が亢進すると活性酸素の産生量が増え、酸化ストレスが高まると細胞死を起こすことになります(下図)。

図:がん細胞は酸素を使わない解糖系でグルコースを代謝してエネルギーを産生し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されている。がん細胞でミトコンドリアでの酸化的リン酸化によるエネルギー産生を増やすと、活性酸素の産生が増え、細胞は酸化傷害によるダメージを受けて死滅する。
がん細胞内では活性酸素の産生量が増えており、抗酸化システムを活性化して酸化傷害を防いでいます。
がん細胞は酸化ストレスを軽減するために余分のエネルギーを使うことになるので、酸化ストレスは増殖や転移を抑制する方向で作用しています。
つまり、酸化ストレスはがん細胞が増殖・転移していく上で邪魔な存在であり、がん細胞は酸化ストレスを高めないように代謝が変更されています。それが、がん細胞でミトコンドリアでの酸素を使ったATP産生(=酸化的リン酸化)が抑制されている理由になっています。
したがって、抗酸化剤をサプリメントとして摂取すると、がん細胞の酸化ストレスを軽減して助けることになるのです。
逆に、がん細胞のミトコンドリアでの酸化的代謝を亢進すると、増殖や転移を抑制できるというのが最近の考えです。以下のような論文があります。
The Warburg effect in tumor progression: Mitochondrial oxidative metabolism as an anti-metastasis mechanism(腫瘍の進展におけるワールブルグ効果:転移阻害のメカニズムとしてのミトコンドリアの酸化的代謝)Cancer Lett. 2015 Jan 28; 356(2): 156–164.
【要旨】
正常細胞に比べてがん細胞はグルコースの取込みが顕著で増加し、解糖系での代謝が亢進し解糖系の最終産物のピルビン酸が増えている。しかし、がん細胞においては、ピルビン酸はミトコンドリアでのTCA回路での代謝に取り込まれず、酸化的リン酸化も低下している。
その結果、グルコースの解糖によって産生されたピルビン酸は乳酸の生成に振り分けられ、ミトコンドリアでの酸化的代謝は起こりにくくなっている。
がん細胞におけるこのような代謝の特徴はワールブルグ効果(Warburg effect)として知られている。
解糖系の亢進によるグルコースの中間代謝産物の増加は、細胞増殖のための物質合成の材料を供給していることは良く知られている。しかし、腫瘍の進展において、このワールブルグ効果がどのような役割を果たしているのかは明らかでない。
そこで、特にがん細胞の転移との関連から、がん細胞において酸化的代謝が抑制されている理由を考察した。
細胞が転移する過程で、細胞外マトリックス(訳者注:細胞周囲の接着分子や結合組織など)が変化したり消失したりする。
正常細胞では、細胞外マトリックスとの接着が無くなると活性酸素種の産生が増え、アノイキス(anoikis)と呼ばれる特殊な細胞死が引き起こされる。
(訳者注;細胞は細胞外基質と接着して増殖し、浮遊状態では増殖できずに細胞死が誘導される。このような足場を失ったことで誘導される細胞死をアノイキスという)
アノイキスは細胞が転移を起こすときの障壁となっているが、がん細胞はアノイキスに対して抵抗性を高めており、そのために高度に転移を起こしやすくなっている。
酸化的代謝では必然的に活性酸素種が産生されるので、がん細胞におけるグルコースの酸化的代謝の亢進は酸化ストレスを高め、アノイキスへの細胞の感受性を高めることになる。
したがって、ピルビン酸のミトコンドリアでの酸化的代謝を制限することによって、ワールブルグ効果はがん細胞内でのミトコンドリア呼吸による過剰な活性酸素種の産生を防ぎ、アノイキスに対する抵抗性を高め、転移を起こす際の細胞生存を増やすことができる。
この結果と一致して、転移を促進する転写因子のHIFとSnailは酸化的代謝を抑制し、がん抑制遺伝子のp53と転移抑制因子のKISS1はミトコンドリアでの酸化的代謝を亢進する。
総合的には、これらの知見は、ミトコンドリアでの酸化的代謝は転移を抑制する重要な因子であり、腫瘍の転移の予防のために、代謝を制御する治療の妥当性を示唆している。
1923年からドイツのオットー・ワールブルグ博士のグループが、「がん組織では、ミトコンドリアでの酸化的リン酸化が低下し、酸素がある状態でも解糖系でのエネルギー産生が主体である」という現象について一連の論文を発表しています。このワールブルグ効果は、様々なメカニズムで、がん細胞の増殖や生存に有利に働いています。(詳しくは175話、302話、485話参照)
がん細胞でもミトコンドリアでの酸化的リン酸化は正常細胞と同じレベルくらいには起こっています。しかし、がん細胞に取り込まれたグルコースの多くは解糖系で代謝され、物質合成に必要な中間代謝産物を多く作り出しています。
ミトコンドリアの呼吸鎖での酸素を使ったATP産生は必然的に活性酸素の産生を増やします。酸化ストレスは増殖や転移を抑制するので、がん細胞は増殖や転移を促進するために、ミトコンドリアでの呼吸を抑えていると考えられています。
HIF(低酸素誘導因子)とSnailはミトコンドリアでの酸化的代謝を抑制するのでがん細胞の増殖や転移を促進し、p53とKISS1はミトコンドリアでの酸化的代謝を亢進するのでがん細胞の増殖と転移を抑制するというメカニズムです。
正常細胞とがん化した細胞を区別する最も重要な形質と考えられるのが足場非依存性増殖(anchorage-independent growth) です。
正常細胞が増殖する際には「足場」を必要とします。
足場というのは、「細胞外マトリックス」や「細胞間マトリックス」など細胞と細胞の間を埋める物質で、接着剤的役割を務めます。コラーゲン、プロテオグリカン、フィブロネクチンやラミニンといった糖タンパク質などが主な成分です。
正常細胞はこのような足場がないと増殖できません。正常細胞は足場を除かれると、細胞周期のG1期に停止し自然死(アポトーシス)に至ります。この細胞死がアノイキス(anoikis)です。
しかし、がん細胞は足場がなくても生存し増殖できます。
実験では軟寒天コロニー形成アッセイ法(soft agar colony formation assay)を用います。
正常細胞は細胞がシャーレに接着していないと増殖できないのに対して、がん化した細胞は軟寒天中などの細胞接着のない浮遊状態でも増殖することができます。
細胞が細胞外マトリックスからの接着を失うと細胞死(アノイキス)を起こしますが、その時に酸化ストレスの亢進が重要なメカニズムになっています。
がん細胞ではミトコンドリアでの酸化的代謝を抑制して酸化ストレスを高めないようにしていることで、細胞死(アノイキス)に抵抗性を持つので、転移を引き起こしているというのがこの論文の骨子です。
ジクロロ酢酸などでがん細胞のミトコンドリアでの酸化的リン酸化を亢進すると、転移が阻止できるかもしれないと考察しています。
【ミトコンドリアでの酸化的代謝を亢進すれば増殖も転移も抑制できる】
がん細胞のエネルギー代謝の特徴である「解糖系の亢進と酸化的リン酸化の抑制」というワールブルグ効果の理由の一つは、「がん細胞が酸化ストレスを高めない」ためです。
がん細胞でもミトコンドリアでのTCA回路での代謝と酸化的リン酸化によるATP産生は起こっています。TCA回路が回らないと脂肪酸合成(TCA回路でできたクエン酸から合成)やアミノ酸合成など物質代謝に支障が起こります。物質合成が阻害されると細胞は増えることができません。
グルコースの解糖でできたピルビン酸は乳酸に振り分けられてTCAでの代謝が制限されていますが、グルタミンがTCA回路に入って物質合成を亢進させています。TCA回路が回らないと細胞分裂するための物質合成ができません。ATP産生も解糖系だけでは足りないので、酸化的リン酸化も酸化ストレスが危険レベルに達しない程度に行われています。
細胞増殖活性が亢進したがん細胞においては、エネルギー(ATP)の産生と、核酸や脂肪酸やたんぱく質など細胞の分裂・増殖に必要な物質の合成が必然的に高まります。
がん細胞にとってグルコースとグルタミンは二大栄養素です。細胞分裂して数を増やすために、生体内マクロ分子の合成とエネルギー(ATP)産生のために、特にグルコースとグルタミンの取込みと利用が亢進しているのです。

図:がん細胞にとってグルコースとグルタミンは二大栄養素である。増殖している細胞(右図)では、増殖していない細胞(非増殖細胞)に比べて、細胞が分裂して数を増やすために、たんぱく質、核酸、脂質などの生体内マクロ分子の合成とエネルギー(ATP)産生のために、グルコースとグルタミンの取込みと利用が亢進している。グルコースとグルタミンの取込みと利用を阻止できれば、がん細胞の増殖を抑え、細胞死を誘導できる。
がん細胞が分裂して細胞の数を増やすためには、グルコースの中間代謝産物を使って細胞構成成分を合成する必要があります。そのため、グルコースの取込みと解糖系やペントース・リン酸経路の代謝が亢進しています(下図)。

図:赤の矢印と文字はがん細胞で活性化あるいは増えていることを示している。がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある(1)。そこでがん細胞ではミトコンドリアでのATP産生を抑制して酸化ストレスの増大を防いでいる。そのため、酸素を使わない非効率的なエネルギー産生系である解糖系が亢進していて乳酸の産生が増えている(2)。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる(3)。アミノ酸のグルタミンはTCA回路に入って物質合成に使われる(4)。がん細胞ではミトコンドリアでの代謝を抑えているので、ミトコンドリアで代謝される脂肪酸やケトン体をエネルギー源として利用できにくい状態にある(5)。(参考:Redox Biology 2: 963-970, 2014年)
がん細胞でも正常細胞と同じくらいにミトコンドリアでの酸素呼吸は行われていますが、がん細胞はミトコンドリア内に様々な異常があるため、ミトコンドリアでの酸素を使ったエネルギー産生の過程では活性酸素が発生しやすい状態にあります。
したがって、ミトコンドリアでの酸素を使ったATP産生(酸化的リン酸化)を亢進すれば、がん細胞は酸化ストレスが亢進して、増殖や転移が抑制される結果になります。
がん細胞のグルコースの取込みや解糖系を阻害し、ミトコンドリアでの酸化的リン酸化を亢進すると、活性酸素の産生量が増え、酸化ストレスが高まると細胞死を起こすことになります(下図)。
そのような状況にがん細胞を追い込む方法として、ケトン食、2-デオキシ-D-グルコース、ジクロロ酢酸、メトホルミン、レスベラトロール、ジスルフィラム、オーラノフィン、アルテスネイト、半枝蓮などがあります。これらを組み合わせることにより、がん細胞のエネルギー産生と物質合成を阻害し、酸化ストレスを高め、増殖を阻止し、細胞死(アポトーシス)を誘導できます(下図)。

図:がん細胞の解糖系やペントース・リン酸回路を阻害するケトン食と2-デオキシグルコース(2-DG)、ミトコンドリアでの代謝を促進するジクロロ酢酸、呼吸鎖を阻害して活性酸素(ROS)の産生を高めるメトホルミンやレスベラトロール、細胞質でフリーラジカルを産生するアルテスネイトや半枝蓮、グルタチオンやチオレドキシンによる抗酸化システムを阻害するオーラノフィンやジスルフィラムを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
【ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります(図)。

ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
がん細胞では低酸素誘導因子-1(HIF-1)の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生(酸化的リン酸化)が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(下図)。
前述のように、がん細胞では活性酸素の発生を減らして死ににくくするために、ミトコンドリアでの酸化的リン酸化を抑制しています。ジクロロ酢酸ナトリウムでがん細胞のミトコンドリアでの代謝を促進して活性酸素の産生を増やすと抗がん剤で死にやすくなります。ジクロロ酢酸ナトリウム単独でもがん細胞が死滅することが培養細胞や動物実験で示されています。
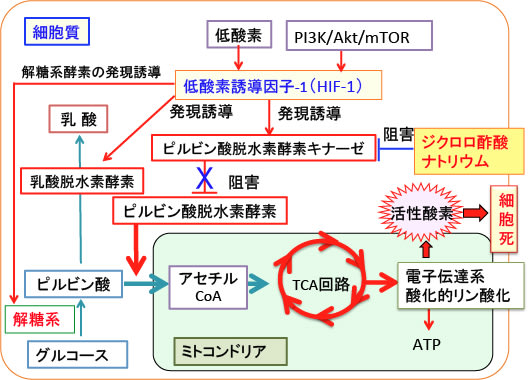
図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。HIF-1は乳酸脱水素酵素の発現を亢進して解糖系代謝を亢進する作用もある。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高め、ピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増えてがん細胞が死滅する。ジクロロ酢酸ナトリウムでミトコンドリアが活性化されるとHIF-1の活性が抑制される機序も報告されている。
ミトコンドリアでの活性酸素の産生量を増やしたくらいでがん細胞が本当に死滅するのかという疑問が出るかもしれませんが、ミトコンドリアは細胞の重量の10%以上を占めるくらい大量に存在するので、ミトコンドリアで一斉に酸化的リン酸化が亢進すれば細胞を死滅させることができると考えられています。
培養がん細胞や動物移植腫瘍を用いた実験でジクロロ酢酸ナトリウムの抗腫瘍作用は証明されています。臨床試験でも有効性が報告されており、がんの代替医療では利用する患者さんが増えています。
人間の場合、1日体重1kg当たり10〜15mgを水に溶解して服用します。TCA回路が亢進するとビタミンB1を消耗するのでビタミンB1の補充が副作用予防に必要です。
【ジクロロ酢酸ナトリウムはHIF-1の活性を抑制する】
ジクロロ酢酸ナトリウムは低酸素誘導因子-1(HIF-1)で誘導されるピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換)の活性を高め、ミトコンドリアでのエネルギー産生を亢進して酸化ストレスを高める作用でがん治療に使用されています。
ピルビン酸のミトコンドリアへの流入が増えると乳酸の産生が減少します。NAD(ニコチンアミドジヌクレオチド)はレドックス反応における電子伝達体として機能します。NADは酸化型(NAD+)と還元型(NADH+H+)の2種類の形で存在し、NAD+は解糖系の反応に必要で、解糖系で還元型になったNADH+H+を酸化型(NAD+)に戻すために乳酸(乳酸発酵)を生成する反応が必要になります。ピルビン酸から乳酸への反応が減少するとNAD+が減って、解糖系の代謝が抑制されます。(詳しくは302話参照)
さらに、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素キナーゼを阻害してミトコンドリアを活性化すると、がん細胞のHIF-1αシグナル系と血管新生が阻害されることが報告されています。(Oncogene 32(13): 1638-50, 2013年)
低酸素誘導因子-1α(HIF-1α)はプロリル・ヒドロキシラーゼによって水酸化され、分解が促進されます(364話参照)。
プロリル・ヒドロキシラーゼによるHIF-1αの水酸化には酸素(O2)とTCA回路で産生されるα-ケトグルタル酸が必要です。したがって、ジクロロ酢酸ナトリウムでピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへ変換)を活性化してミトコンドリアでのTCA回路を活性化することはプロリル・ヒドロキシラーゼの活性を高めてHIF-1αの分解を促進するので、その結果HIF-1の活性は低下するというメカニズムです。
ラットに非小細胞性肺がんと乳がん細胞を移植した動物実験モデルにおいて、ジクロロ酢酸ナトリウムを投与すると、腫瘍血管の新生と腫瘍内の血流が阻害されることが報告されています。
つまり、ジクロロ酢酸ナトリウムでミトコンドリアにおけるグルコース代謝を活性化する治療法はHIF-1の活性抑制を介した抗腫瘍効果も期待できるという結論です。
【ジクロロ酢酸とメトホルミンを併用すると抗腫瘍効果が高まる】
以下のような論文があります。
Sensitization of metformin-cytotoxicity by dichloroacetate via reprogramming glucose metabolism in cancer cells.(がん細胞におけるグルコース代謝の再プログラム化を介するジクロロ酢酸によるメトホルミンの細胞毒性の増強)Cancer Lett. 346(2): 300-308, 2014
【要旨】
がん細胞に対するメトホルミンの細胞毒性を高める目的で、ピルビン酸脱水素酵素キナーゼの阻害剤であるジクロロ酢酸の作用を検討した。
メトホルミンの細胞毒性は主にグルコース利用性と、ペントース・リン酸経路で産生される還元力(NADPH)に依存していた。
一方、ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害しミトコンドリアでの呼吸(酸化的リン酸化)を亢進してグルコース代謝を再プログラム化(=正常化)することによってメトホルミンの細胞毒性を増強した。
グルコースとグルタチオンの濃度が高い条件下でも、ジクロロ酢酸とメトホルミンの併用投与は、がん細胞を死滅させた。
ジクロロ酢酸はがん細胞のグルコース代謝を好気的解糖主体の代謝からミトコンドリアでの酸化的リン酸化主体の代謝に再プログラム化することによって、メトホルミンの細胞毒性の感受性を高めることが明らかになった。
グルコース代謝の再プログラミング(reprogramming)というのは、がん細胞の特徴であるワールブルグ効果(酸素があっても解糖系でのグルコース代謝が亢進し、ミトコンドリアでの代謝が低下している)を正常化(初期化)するということです。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めることによってミトコンドリアでの呼吸(酸素を使ったATP産生)が活性化され、解糖系でのATP産生は抑制されることになります。
一方、メトホルミンはミトコンドリアの呼吸酵素複合体1の働きを阻害するので、ATP産生は阻害され、活性酸素の発生が増加します。
がん細胞ではもともとミトコンドリアでの酸素を使った代謝が低下しているので、メトホルミン単独では細胞を死滅させる作用が弱いのですが、ジクロロ酢酸でミトコンドリアにおける酸素利用を高めれば、がん細胞は酸化傷害によって死滅するというストーリーです。
Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells.(メトホルミンを投与した乳がん細胞において、ジクロロ酢酸は酸化傷害によるアポトーシスを亢進し、乳酸の産生を抑制する)Breast Cancer Res Treat. 147(3):539-50. 2014年
【要旨】
乳がん細胞における代謝の特徴を明らかにすることは、乳がんの治療法の開発に役立つ。
メトホルミンは乳がんの治療に有用な薬剤であることが明らかになっている。このメトホルミンはミトコンドリアの呼吸酵素複合体Iの働きを阻害して活性酸素の産生を増やし、酸化傷害によって細胞死を誘導する。
呼吸酵素複合体Iの阻害は乳酸産生を増やすことになるが、がん細胞においては解糖系の亢進によって乳酸産生がもともと亢進した状態にあり、乳酸産生が高いほど予後が悪いことが知られている。
メトホルミンはがん治療に効果が期待できるが、乳酸産生を抑制する方法を組み合わせると、メトホルミンの抗がん作用を効率的に高めることができる。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼの活性を阻害することによってミトコンドリアでの代謝を促進する作用によって、乳酸アシドーシスの治療薬として使用されている。
この研究の目的は、メトホルミンとジクロロ酢酸を併用すると、乳がん細胞を死滅させる効果が相乗的に高まるかどうかと、そのメカニズムを検討することである。
乳がん細胞株を用い、メトホルミンとジクロロ酢酸を投与し、細胞死の程度や代謝の変化を解析した。細胞死と活性酸素産生はフローサイトメトリーやウェスタンブロット法や細胞数測定法などの方法で解析した。細胞の形態学的変化は位相差顕微鏡や共焦点顕微鏡で解析した。細胞の代謝の変化は、Seahorse XF24アナライザー、乳酸測定、pH測定で検討した。
実験の結果、ジクロロ酢酸とメトホルミンを同時に添加すると、乳がん細胞のアポトーシスは相乗的に増加することが明らかになった。
メトホルミンによって誘導される酸化傷害はジクロロ酢酸によって促進され、ジクロロ酢酸によるピルビン酸脱水素酵素キナーゼ活性の阻害はメトホルミンによって引き起こされる乳酸産生亢進を抑制した。
以上のことから、ジクロロ酢酸とメトホルミンを同時投与すると、酸化傷害を介するカスパーゼ依存性のアポトーシスの誘導を相乗的に亢進し、さらにメトホルミンによる乳酸産生を抑制することが明らかになった。
メトホルミンとジクロロ酢酸の併用は、乳がんの治療効果を高めることが期待できる革新的な治療法となる可能性がある。
メトホルミンとジクロロ酢酸の相乗効果のメカニズムは以下のようにまとめられます。

図:がん細胞ではミトコンドリアでの呼吸鎖での活性酸素の産生率が高いので、メトホルミンで呼吸酵素複合体Iが阻害されると、ATPの産生障害と活性酸素の産生増加が起こる。そうなると解糖系が亢進してATP産生を増やそうとするが、ジクロロ酢酸を用いてピルビン酸脱水素酵素を活性化してミトコンドリアでの代謝を活性化すると、乳酸産生は減少し、ミトコンドリアでの活性酸素の産生量はさらに増える。ミトコンドリアでの代謝が亢進するとペントース・リン酸経路での代謝が抑制されてNADPH産生による抗酸化力も低下し、酸化ストレスが亢進してがん細胞は死滅する。脂肪酸やケトン体を増やすとさらにミトコンドリアからの活性酸素の産生量は増加する。(赤で示した矢印や文字は発現や活性を亢進していることを示す)
ジクロロ酢酸とメトホルミンと2-デオキシ-D-グルコースが相乗的に抗腫瘍作用を示すことは417話で解説しています。
メトホルミンによってミトコンドリアでのATP産生が低下すると、がん細胞は解糖系でのエネルギー産生を増やす可能性が指摘されています。
したがって、がん細胞の解糖系を阻害する2−デオキシ-D-グルコースやケトン食の併用はメトホルミンの抗腫瘍効果を高めます。
メトホルミンの抗腫瘍効果はグルコースの利用を阻止すると増強することが明らかになっています。以下のような論文があります。
Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo.(培養細胞および生体内におけるがん細胞に対するメトホルミンの細胞毒性が低グルコースによって増強されるメカニズム)PLoS One. 2014 Sep 25;9(9):e108444.
【要旨】
がん細胞に対するメトホルミンの毒性は細胞の種類によって感受性が異なる。その一つの理由は、細胞を培養するときの培養液に高濃度のグルコースが添加されているためであり、グルコースの濃度が低い条件では、多くのがん細胞に対してメトホルミンの細胞毒性は増強されることが最近の研究で明らかになっている。
0から5mMの低グルコース濃度の条件では、メトホルミンは乳がん細胞株のMCF7とMDAMB231とSKBR3、卵巣がん細胞株のOVCAR3とPA-1に対して細胞毒性を示した。
高濃度のグルコースを含有する通常の培養液での検討では、MDAMB231とSKBR3細胞はメトホルミンの細胞毒性に抵抗性を示すことを以前の研究で示している。
培養液のグルコース濃度を10mM以上にすると、全ての培養細胞株はメトホルミンの細胞毒性に対して抵抗性になった。
培養液の糖の濃度が低グルコース(2.5mM)あるいは高フルクトース(25mM)あるいは高ガラクトース(25mM)の条件では、メトホルミンの添加によってATP産生は顕著に減少した。しかし高グルコース(25mM)の培養液ではATP産生の減少は認めなかった。
メトホルミンによってミトコンドリアでのATP産生が減少するとAMP依存性プロテインキナーゼ(AMPK)が活性化されて解糖系が促進されることによってエネルギー産生低下を代償しようとするメカニズムが作動する。このような代償作用は、培養液の糖を25mMグルコースから2.5mMグルコースや25mMフルクトースや25mMガラクトースに変更することによって減弱させることができる。
この実験結果は、がん細胞のグルコース利用を阻害すると、メトホルミン投与によって刺激される解糖系亢進を抑制して、メトホルミン誘導性のアポトーシスを増強できることを示唆している。
さらに、低グルコースの条件では、メトホルミンはAKTのリン酸化とmTOR(哺乳類ラパマイシン標的タンパク質)の様々なターゲット分子のリン酸化を減らすが、活性化型のリン酸化AMPKの量は減らさなかった。
このように、mTORシグナル伝達系の阻害はAMPK活性化には依存しないことが示唆された。
4T1乳がん細胞をマウスに移植するin vivoの動物実験系を使った研究で、低糖質のケトン食を与えて血中グルコースのレベルを低下させると、メトホルミンによる腫瘍増殖の抑制効果は増強された。
以上の結果は、グルコースの利用を抑制する条件下ではメトホルミンのATP産生抑制と生存シグナル伝達系の阻害効果が増強することを示している。
25mMというのは450mg/dLです。正常な血糖のレベルは4~6mM(72–108 mg/dL)です。高血糖という条件だけで、がん細胞の増殖経路は活性化されます。
メトホルミンの抗腫瘍効果はジクロロ酢酸と2-デオキシグルコースの併用によって増強できます。この3種類の組合せは、多くのがん患者さんで実践していますが、副作用はほとんど出ません。
細胞質の解糖系とミトコンドリアの呼吸鎖を阻害しながら、ピルビン酸脱水素酵素を活性化して無理矢理ミトコンドリアの代謝を活性化すれば、がん細胞は活性酸素の増加とエネルギー(ATP)の産生阻害という2つのメカニズムで死滅することになります。
ケトン食を併用すると、さらに抗がん作用が増強します。
メトホルミンとジクロロ酢酸と2-デオキシ-D-グルコースとケトン食の相乗効果のメカニズムは以下のようにまとめられます。

図:がん細胞はミトコンドリアの様々な異常によって活性酸素が出やすい状況になっている。そのため、ミトコンドリアでの代謝を抑え、酸素を使わない解糖系での代謝が亢進している。がん細胞の解糖系が亢進しているのは、酸化ストレスを高めたくないことが一つの理由になっている。したがって、細胞質の解糖系とミトコンドリアの呼吸鎖を阻害しながら、ピルビン酸脱水素酵素を活性化してミトコンドリアの代謝を活性化すれば、がん細胞は活性酸素の増加とエネルギー(ATP)の産生阻害という2つのメカニズムで死滅することになる。2−DG(2-デオキシグルコース)は解糖系を阻害し、メトホルミンは呼吸鎖を阻害してATP産生を阻害すると同時に活性酸素の産生を増やす。ジクロロ酢酸ナトリウムでピルビン酸脱水素酵素の活性を亢進してミトコンドリアでの代謝を亢進すると、活性酸素の産生が増えるが、2-DGでグルコース-6-P(グルコース-6-リン酸)の産生を抑制するとペントース・リン酸経路におけるNADPHの産生が低下するので還元力が減少し、酸化ストレスは増大してがん細胞は死滅する。糖質摂取を減らし脂肪の摂取を増やすケトン食はグルコースの取込みと解糖系を阻害し、ミトコンドリアでの代謝を亢進する。これら4つの組合せはがん細胞に選択性の高い治療法になる。
ジクロロ酢酸はミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
メトホルミンはその副作用に「乳酸アシドーシス」があります。高齢者や腎機能障害者や心血管・肺機能障害、手術前後、肝機能障害などの患者、脱水、過度のアルコール摂取などで起こることがあります。
ジクロロ酢酸は乳酸アシドーシスの治療にも使われているので、メトホルミンとジクロロ酢酸の併用は副作用予防の観点からもメリットがあります。
| « 505)抗酸化剤... | 507) 代謝をタ... » |



