がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
895)がん細胞のフェロトーシス誘導(その2):還元型グルタチオンの枯渇

図:グルタチオン(①)は細胞内の酸化ストレスを軽減する。がん細胞内の還元型グルタチオン(②)の量が多いと、抗がん剤や放射線治療に抵抗性になる。酸化型グルタチオン(GSSG)はペントースリン酸経路で産生されるNADPH(③)によって還元される。グルタチオンはグルタミン酸とシステインとグリシンからATPを使って合成される(④)。スルファサラジン(⑤)はシスチン・トランスポーターを阻害することによってグルタチオンの合成を阻害する。2-デオキシ-D-グルコース(2-DG)(⑥)やケトン食(⑦)は解糖系によるATP産生やペントース・リン酸経路でのNADPH産生を低下させることによって還元型グルタチオンの量を減らす。さらに、がん細胞内の酸化ストレスを高めるジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴、ジスルフィラムなどを併用するとグルタチオンが枯渇して、がん細胞を死滅させることができる(⑧)。
895)がん細胞のフェロトーシス誘導(その2):還元型グルタチオンの枯渇
【酸素と鉄が細胞膜を傷害する】
フェロトーシスによる細胞死は、細胞膜の過酸化脂質の蓄積によって起こります。
細胞はグルタチオンやグルタチオン・ペルオキシダーゼなどの抗酸化システムを使って脂質の酸化を防いでいます。細胞膜の脂質の酸化を防ぐメカニズムについて説明します。
生物とは生命活動を行うことができる生き物です。「外界と膜で仕切られた細胞からできている」、「DNAを持って自分の複製を作ることができる」、「外界から栄養分を取り入れてエネルギーを産生し、物質を分解したり合成する代謝を行う」といった特徴を持っています。さらに、「進化することができる」という特徴を加える意見もあります。
地球上の初期の生物は酸素のない状態で進化しました。地球が誕生したのは約46億年前で、その地球に最初の生命(=生物)が出現するのは8億年後の今から約38億年前です。最初の生物は、はっきりした核を持たない(核膜をもった核が無い)原核生物です。これらの生物は海の中を漂う有機物を利用し、酸素を使わずに生息していました。
約25億年前に光合成を行う藍藻(シアノバクテリア)が登場します。それまで地球上には酸素は存在しませんでしたが、そこに太陽光エネルギーを使って無機物である二酸化炭素と水からグルコース(ブドウ糖)などの有機物を作り出し、酸素を放出するという光合成を行う真正細菌のシアノバクテリアが出現しました。
この酸素放出型光合成を行う生物の出現によって、それまで無酸素状態だった地球大気に大量の酸素分子が放出され、最終的に現在の大気は21%の酸素濃度に達しています。
初期の生物の細胞膜は単純な飽和脂肪酸で構成されていたと思われますが、やがて不飽和脂肪酸が細胞膜に利用されるようになります。細胞膜の不飽和脂肪酸は膜流動性を高めることを可能にし、生物が進化するために必要だったためです。温度が低い状態で細胞膜の流動性を維持するためには不飽和脂肪酸が必要です。
しかし、不飽和脂肪酸を有する細胞膜で構成される生物にとって大気中の大量の酸素の出現は、極めて困難な出来事でした。なぜなら、不飽和脂肪酸は酸素の存在下で脂質過酸化を受けやすいからです。そしてこの過酸化反応は2価金属、特に2価の鉄イオン(Fe2+)によって劇的に加速されます。
そこで、生物は酸素と鉄イオンによる細胞膜の酸化傷害を阻止するために、グルタチオンとグルタチオン・ペルオキシダーゼによる抗酸化システムを発達させました。
【還元型グルタチオンが活性酸素やフリーラジカルを消去する】
グルタチオン(Glutathione)というのは、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したペプチドです。γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成します。引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。グルタチオンの合成にはATPが必要です。
つまり、グルタミン酸やシステインやグリシンが不足したり、ATPが十分に産生できなかったり、γ-グルタミルシステイン合成酵素やグルタチオン合成酵素の活性が阻害されれば、グルタチオンの濃度は低下して、酸化ストレスに対する抵抗力が低下することになります。(図)。

図:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)がATPを使って結合して合成される。
グルタチオンは細胞内に0.5〜10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
還元型のグルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。
細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオン還元酵素で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。このNADPHはペントースリン酸経路で産生されます。(図)

図:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。NADPHはペントースリン酸経路から供給される。
がん細胞のグルコース取り込みや解糖系やペントースリン酸経路を阻害するケトン食や2−デオキシ-D-グルコースやジクロロ酢酸はNHDPHの供給を減らすことによって、グルタチオンの合成を低下させ、酸化ストレスに対する抵抗性を減弱させることができます。ATP産生低下はグルタチオン合成をさらに低下させます。また、NADPHの産生低下は脂肪酸合成を抑制して細胞増殖を低下します。
【グルタチオンペルオキシダーゼ4が過酸化水素や過酸化脂質を消去する】
グルタチオンペルオキシダーゼ(glutathione peroxidase: GPx)は活性中心にセレンを有する酵素で、グルタチオン(GSH)の存在下で 過酸化水素(H2O2)を水(H2O)に還元するほか、過酸化脂質(LOOH)を還元する機能を有し、 スーパーオキサイドジスムターゼ、カタラーゼとともに生体内において重要な抗酸化作用を担っていると考えられています。(図)

図:グルタチオンペルオキシダーゼは、過酸化水素(H2O2)を還元型グルタチオン(GSH)の存在下で水(H2O)に代謝させ、酸化型グルタチオン(GSSG)を生成する。酸化型グルタチオンはペントースリン酸経路から供給されるNADPHを使ってグルタチオン還元酵素によって還元型グルタチオンに還元される。過酸化脂質(LOOH)の還元もグルタチオンペルオキシダーゼが担う。
グルタチオンペルオキシダーゼにはいくつかのサブタイプが存在しますが、細胞内の脂質過酸化物を還元する役割で重要なのがグルタチオンペルオキシダーゼ4(GPx4)です。
GPx4は特に脂質過酸化物を還元することに特化しており、鉄依存性細胞死(フェロトーシス)の調節においても中心的な役割を果たしています。GPx4の活性が低下するとフェロトーシスが発生しやすくなります。このため、GPx4は神経変性疾患、がん、およびその他の健康問題の研究において重要なターゲットとなっています。
細胞膜の過酸化脂質を還元できるのはグルタチオンペルオキシダーゼ4(GPx4)だけです。したがって、グルタチオン、グルタチオンペルオキシダーゼ4、グルタチオン還元酵素、NADPH(ペントース・リン酸回路から供給)、ビタミンB2(グルタチオン・ペルオキシダーゼの補酵素)のどれかが不足しても過酸化脂質が増えます。
【がん細胞に対するグルタチオンの2面性】
がん細胞の発生を予防したり増殖を抑える方法が、時と場合によって逆効果になる(がんを悪化させたり増殖を促進する)場合があります。このような作用や効果を現す用語として「2面性」とか「諸刃の剣」などが使われます。
例えば、がん細胞を壊死させる作用がある腫瘍壊死因子-α(Tumor Necrosis Factor-α, TNF-α)は、マクロファージによって産生され、固形がんに対して出血性の壊死を生じさせるサイトカインとして発見されたため、マクロファージを活性化する物質の抗腫瘍効果のメカニズム研究では、TNF-αの産生増加が抗がん作用との関連で言及されます。
しかし、TNF-αは炎症を増悪し、がん細胞に酸化ストレスを高めて悪性化を促進するので、むしろがんを悪化させる作用が問題となっており、がんの予防や治療の分野ではTNF-αの産生を抑制することが治療のターゲットになっています。
抗酸化物質も同様の2面性を持っています。活性酸素やフリーラジカルによるDNAのダメージが遺伝子変異を起こしてがん発生の引き金になるので、活性酸素やフリーラジカルを消去する抗酸化物質はがん細胞の発生を予防する効果を発揮します。野菜や果物ががんの予防に役立つのは、それらの食品にはフラボノイドやカテキンなど抗酸化作用の強い成分を多く含むからだと考えられています。したがって、抗酸化作用の強い食品成分を材料にしたサプリメントががん予防の目的で利用されています。
しかし一方、放射線治療や抗がん剤治療では、活性酸素やフリーラジカルの発生ががん細胞を死滅させるメカニズムになっています。したがって、放射線治療や抗がん剤治療を行っているときに抗酸化物質を多く摂取することは、抗がん作用を弱める可能性があります。抗酸化作用のある物質は、がん細胞を酸化ストレスから保護することになるのです。したがって、放射線治療や抗がん剤治療を行っているときは、がん細胞の酸化ストレスを高める方法が有用だと考えられています。
この「がん細胞の酸化ストレスを高める方法」のターゲットの一つがグルタチオンです。グルタチオンは細胞内に高濃度に存在する抗酸化物質で、活性酸素やフリーラジカルから細胞を守る役割を担っています。
したがって、発がん予防の観点からは、グルタチオンの合成を増やして濃度を高めることは、抗酸化力を高めて遺伝子のダメージや変異を防ぐ効果が期待できます。一方、抗がん剤や放射線治療を行っているときは、グルタチオンの濃度が高いとがん細胞が死ににくくなります。
がん細胞の抗がん剤耐性や放射線耐性の原因の一つとして、がん細胞ではグルタチオンの産生が増えているためという意見があります。がん細胞は抗がん剤や放射線治療を受けると、それらによる細胞傷害に抵抗する手段としてグルタチオンの合成を増やしているのです。
したがって、がん細胞のグルタチオンの産生を妨げると、抗がん剤や放射線治療の効果が高まることになります。グルタチオンの産生阻害はフェロトーシスを促進する目的でも有用です。
【スルファサラジンはグルタチオンの量を減少させる】
シスチン・トランスポーター(xCT)はシスチン/グルタミン酸交換輸送体とも呼ばれ、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種で、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。
シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに変換してグルタチオンを合成する材料になるというわけです。このトランスポーターの発現が亢進すると、細胞内グルタチオンレベルが上昇し、これによって活性酸素などの酸化ストレスに対する防御能が高まると考えられます。
スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。
シスチン・トランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下して酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。(図)

図:シスチン・トランスポーター(xCT) は、細胞内のグルタミン酸を放出し、細胞外のシスチンを取り込む(①)。シスチンはシステイン2分子がS-S結合したアミノ酸で、細胞内でシステインに変換される(②)。システインはグルタミン酸とグリシンと結合してグルタチオンが合成される(③)。グルタチオンは酸化傷害を軽減する作用によって抗がん剤や放射線治療に抵抗性を与える(④)。xCTの働きを阻害するスルファサラジン(⑤)は、細胞内のシステインを減らしてグルタチオンの濃度を低下させ、がん細胞の酸化ストレス抵抗性を減弱して細胞死を亢進する(⑥)。
がん細胞のシスチントランスポーターを十分に阻害できれば、それだけでフェロトーシスを誘導できます。しかし、スルファサラジンの消化管からの吸収率は10%以下と言われ、スルファサラジン単独療法での抗腫瘍効果には限界があります。
しかし、スルファサラジンとジスルフィラムを併用すると、スルファサラジンまたはジスルフィラム単独と比較して、有意に高い細胞傷害効果が得られることが報告されています。
肺腫瘍のマウスモデルでは、スルファサラジン+ジスルフィラムは、腫瘍の数とサイズ、肺腫瘍の発生率と個数の減少において、個々の薬剤よりも高い有効性を示しました。これは、ジスルフィラムによる活性酸素の産生亢進と、スルファサラジンによる抗酸化システム阻害の相乗効果と考えられています。
スルファサラジンとメトホルミンと併用すると、フェロトーシス誘発において相乗的に作用し、乳がん細胞の増殖を阻害する実験結果が報告されています。これは、シスチン・トランスポーターのタンパク質のUFMylationプロセスを阻害することによりタンパク質安定性を低下させる機序が推測されています。
UFMylationはユビキチン様修飾因子UFM1 (Ubiquitin-fold modifier 1) が関連するタンパク質翻訳後修飾の一種です。メトホルミンはシスチン・トランスポーター(xCT)タンパク質のUFMylationプロセスを阻害するメカニズムでxCTの働きを阻害するという報告です。
これらの報告は、スルファサラジンとジスルフィラムとメトホルミンの併用はフェロトーシスの誘導を相乗的に促進する可能性を示唆しています。
【2-デオキシ-D-グルコースはペントースリン酸経路を阻害する】
解糖中間体は多くの生合成系へと流れていきますが、その一つがペントースリン酸経路です。ペントースリン酸経路とは、解糖系の中間体のグルコース6リン酸から分岐し、同じく解糖系の中間体のグリセルアルデヒド3リン酸に戻る経路(回路)です。
解糖系と同様に細胞質に存在する代謝経路で、補酵素の一つであるNADPHを産生し、核酸の原料となるリボース5リン酸などの5単糖 (ペントース) を産生します。NADPHは還元剤です。脂肪酸やステロイドの合成、抗酸化物質のグルタチオンやチオレドキシンの還元剤として使用されます。
解糖系はATPを産生しますが、ペントースリン酸経路はATP産生には関与せず、核酸の原料や還元剤(NADPH)の産生を行っています。細胞が増殖するにはエネルギー(ATP)だけでなく、核酸や脂肪酸などの物質合成や、酸化ストレスを軽減する還元剤の需要も増えます。
したがって、がん細胞では解糖系とペントースリン酸経路が亢進しています。
2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼとホスホグルコースイソメラーゼを阻害するので、グルコースの解糖系と同時にペントースリン酸経路を阻害してNADPHと5単糖 (ペントース)の産生を阻害します(図)。
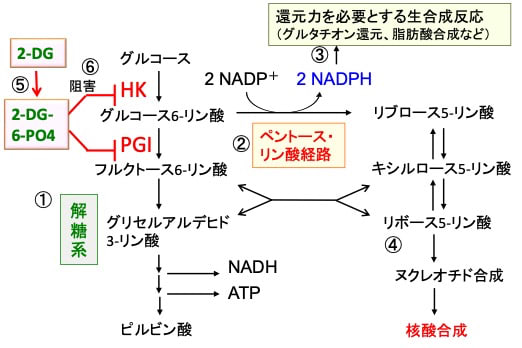
図:解糖系はグルコースがピルビン酸に分解される過程でATPが産生される(①)。グルコース6リン酸から派生するペントースリン酸経路(②)では、還元剤のNADPHが産生され(③)、核酸合成の材料になるリボース5リン酸が産生される(④)。がん細胞ではグルコースの取込みが増え、解糖系とペントースリン酸経路が亢進して、細胞分裂のためのエネルギー(ATP)産生と物質合成が亢進している。2-デオキシ-D-グルコース(2-DG)は2-DG-6リン酸(2-DG-6-PO4)に変換され(⑤)、2-DG-6-PO4はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害する(⑥)。その結果、2-DGはグルコースの解糖系とペントースリン酸経路での代謝を阻害する。
【高濃度のビタミンCは酸化剤として作用する】
高濃度ビタミンC点滴は、1回に25〜100グラムという大量のビタミンCを1〜3時間かけて点滴する治療法です。がん細胞に取込まれたビタミンCが過酸化水素(H2O2)を生成することでDNAやミトコンドリアに酸化傷害によるダメージを与えて抗がん作用を発揮します。
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増えているので、大量のビタミンCががん細胞に取込まれます。
血中の濃度がmMレベルに上昇する高濃度のビタミンCは、抗酸化性ビタミンとしての働きではなく、酸化剤として作用します。この薬理学的濃度のビタミンCは過酸化水素を生成し、フェントン反応によってヒドロキシルラジカルのような活性酸素種を生成してDNAを損傷するためです。
フェントン反応とは、過酸化水素(H₂O₂)と2価の鉄イオン(Fe2+)が反応して、非常に強力な酸化剤であるヒドロキシルラジカル(•OH)を生成する化学反応のことです。
高濃度のビタミンCによってがん細胞内で発生した過酸化水素とヒドロキシルラジカルがDNAにダメージを与えると、損傷したDNAを修復するポリADPリボース合成酵素(PARP)が活性化されます。PARPはADPリボース単量体をNAD+から切り出して、自身および他のタンパク質に付加します。これにより、損傷部位に修復タンパク質を集め、DNA修復プロセスを促進します。
PARPの活性化によってNAD+が枯渇すると、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用でATPが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。

図:ビタミンC(アスコルビン酸)はグルコーストランスポーターを使って細胞内に取込まれる(①)。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える(②)。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少し(③)、解糖系が阻害される(④)。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる(⑤)。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する(⑥)。
高濃度のビタミンC投与は正常細胞にはダメージを与えず、がん細胞が選択的にダメージを受けます。その理由の一つは、がん細胞はビタミンCを取り込むグルコーストランスポーターの発現量が正常細胞より多いためです。
その他に、高濃度ビタミンCががん細胞内のグルタチオンを枯渇して酸化ストレスを増強する機序が報告されています。
ビタミンCはナトリウム依存性ビタミンCトランスポーター(sodium-dependent vitamin C transporter;SVCT)かグルコース輸送体(GLUT)を介して細胞膜を通過します。
SVCTはビタミンCをそのまま通過させますが、GLUT(主にGLUT1とGLUT3)はビタミンCの酸化型のデヒドロアスコルビン酸を通過させます。デヒドロアスコルビン酸は細胞内でグルタチオンやチオレドキシンやNADPHを使ってビタミンCに還元されます。したがって、デヒドロアスコルビン酸を多く取り込んだがん細胞は酸化ストレスが亢進することになります。(図)

図:アスコルビン酸(ビタミンC)はナトリウム依存性ビタミンCトランスポーター(sodium-dependent vitamin C transporter;SVCT)を通って細胞内に入り、酸化型のデヒドロアスコルビン酸はグルコース輸送体(glucose transporter;GLUT)を通って細胞膜を通過する。細胞内でデヒドロアスコルビン酸はグルタチオン依存性のデヒドロアスコルビン酸還元酵素で還元されてアスコルビン酸に変換される。この過程でグルタチオンを消耗するので酸化ストレスが亢進する。
高濃度ビタミンC点滴によるがん細胞における酸化ストレスの亢進は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性を阻害することが報告されています。高濃度ビタミンC点滴で細胞内に発生した活性酸素は、GAPDHの活性部位のシステイン(C152)を酸化して不活性化するというメカニズムが提唱されています。(図)

図:高濃度ビタミンC点滴で細胞内に発生した活性酸素は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性部位の152番目のシステイン(C152)を酸化して不活性化する。
以上から、高濃度ビタミンC点滴はがん細胞内の活性酸素の発生を高め、グルタチオンなどの抗酸化物質を消耗させ、グリセルアルデヒド3リン酸脱水素酵素を酸化して不活性化して解糖系を阻害します。さらに、DNAの酸化傷害が起こるとポリADPリボース合成酵素(PARP)が活性化されNAD+が枯渇し、解糖系もTCA回路も進まなくなります。
正常細胞はグルコース輸送体(GLUT)の発現が少ないのでビタミンCの取込みが少なく、過酸化水素を消去するカタラーゼの活性が高いので、高濃度ビタミンC点滴による細胞傷害は起こりにくいと考えられています。
高濃度ビタミンC点滴はがん細胞内の酸化ストレスを高めるメカニズムでがん細胞を死滅させる治療法です。高濃度ビタミンC点滴で治療中に抗酸化性のサプリメントを摂取している人がいますが、これは高濃度ビタミンC点滴の抗腫瘍効果を弱めます。
【ジスルフィラムは還元型グルタチオンを枯渇する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。
プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
【脂質過酸化の促進の観点からのまとめ】
シスチン・トランスポーター/グルタチオン/グルタチオンペルオキシダーゼ4(GPx4)による抗酸化システムの阻害はがん細胞の細胞膜の脂質の過酸化を促進します。2-デオキシ-D-グルコースやメトホルミンでペントースリン酸経路を阻害すると還元剤のNADPHの産生を阻害できます。スルファサラジンはシスチン・トランスポーターを阻害します。酸化ストレスを高めるジスルフィラムの抗腫瘍効果はスルファサラジンとの併用によって増強できます。
ドコサヘキサエン酸とプニカ酸(ザクロ種子油)は脂質過酸化を促進し、アルテスネイト、ジクロロ酢酸ナトリウム、高濃度ビタミンC点滴はがん細胞内の活性酸素とフリーラジカルの産生を増やし、酸化ストレスを高めます。ドキシサイクリンとアジスロマイシンはミトコンドリアの呼吸酵素鎖のタンパク質合成を阻害しATP産生を阻害します。これらを組み合わせるとがん細胞に選択的にフェロトーシスによる細胞死を誘導できます。(図)

図:シスチン・トランスポーターは細胞外のシスチンを細胞内に輸送する(①)。シスチンはシステインに変換されてグルタチオンの合成が増える(②)。グルタチンペルオキシダーゼ4(GPx4)はグルタチオンを使って細胞膜の脂質の酸化を防ぐ(③)。抗がん剤、放射線照射、アルテスネイト+5-ALA(5-アミノレブリン酸)、ジクロロ酢酸ナトリウム、ジスルフィラム、鉄剤、ドキシサイクリン、高濃度ビタミンC点滴は活性酸素の産生を増やし(④)、2価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で(⑤)、脂質酸化を促進し(⑥)、脂質二重層の破綻によってフェロトーシスによって死滅する(⑦)。2-デオキシ-D-グルコース(2-DG)とメトホルミンはATPとNADPHの産生を減らしてグルタチンペルオキシダーゼ4(GPx4)の活性を低下する(⑧)。細胞膜に取り込まれたドコサヘキサエン酸とプニカ酸(ザクロ種子油)は脂質過酸化を促進する(⑨)。スルファサラジンはシスチン・トランスポーターの働きを阻害してグルタチオンの合成を阻害する(⑩)。これらを組み合わせると、がん細胞に選択的にフェロトーシスによる細胞死を誘導できる。
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 894)がん細胞... | 896)がん細胞... » |