がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
620)膵臓がんの代替療法(その3):ビタミンD3とジインドリルメタンとオーラノフィン
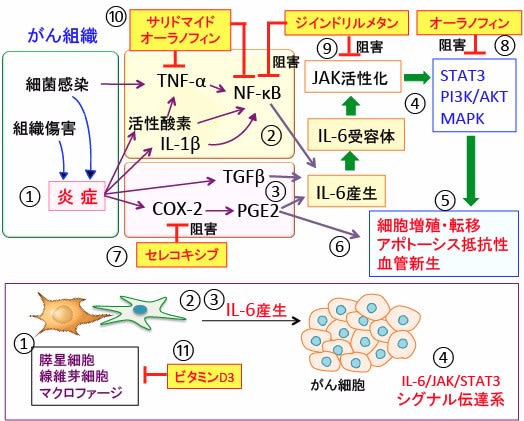
図:がん組織内では組織傷害や細菌感染などによって膵星細胞や線維芽細胞やマクロファージが活性化されて炎症反応が起こる(①)。炎症反応で産生されるIL-1βやTNF-αや活性酸素は炎症性転写因子のNF-κBを活性化し、IL-6遺伝子の発現を亢進する(②)。炎症応答でTGFβ(Transforming Growth Factor β)とCOX-2(シクロオキシゲナーゼ-2)の発現が誘導され、COX-2はPGE2(プロスタグランジンE2)の産生を高める。TGFβとPGE2はIL-6の産生を亢進する(③)。IL-6はIL-6受容体を介してJAK(ヤーヌスキナーゼ)を活性化し、細胞の増殖と生存を制御するSTAT3経路、PI3K/AKT経路、MAPK経路を活性化する(④)。その結果、がん細胞の増殖や転移やアポトーシス抵抗性が促進される(⑤)。PGE2はがん細胞に直接的に作用して増殖や転移を促進する(⑥)。セレコキシブはCOX-2活性を阻害し(⑦)、オーラノフィンはSTAT3の活性を阻害する(⑧)。ジインドリルメタンはJAK/STAT3経路を阻害し(⑨)、サリドマイドとオーラノフィンはTNF-αの発現とIκBキナーゼを阻害してNF-κBを阻害する(⑩)。ビタミンD3は膵星細胞やがん関連線維芽細胞の活性化を阻止する(⑪)。このような抗炎症作用は膵臓がん細胞の増殖や浸潤を抑制する。
620)膵臓がんの代替療法(その3):ビタミンD3とジインドリルメタンとオーラノフィン
【膵臓がんの90%以上は膵管上皮から発生する】
膵臓は胃の裏に存在します。膵臓の右側のふくらんだ部分は膵頭部、左側の幅の狭いほうの端は膵尾部、真ん中は膵体部と呼ばれます。膵頭部は十二指腸と接しており、膵臓で作られた消化酵素を十二指腸に分泌します。
膵臓は、食物の消化を助ける消化酵素を含む膵液をつくる外分泌機能と、インスリンやグルカゴンなど血糖値の調節に必要なホルモンを産生する内分泌機能という2つの役割を果たしています。
ホルモンを産生する細胞はランゲルハンス島という部位に存在します。
消化酵素を含む膵液は腺房細胞で作られ、膵管によって運ばれ、主膵管という1本の管に集まり、肝臓から膵頭部の中に入ってくる総胆管と合流し、十二指腸乳頭部へ流れこみます。

図:膵臓の腺房細胞(①)で作られた消化酵素は膵管(②)を通って十二指腸に分泌される。ランゲルハンス島(③)では血糖を調節するインスリンやグルカゴンなどのホルモンが作られて血中に分泌される。
膵臓がんは膵臓にできる悪性腫瘍の総称です。消化液をつくる腺房細胞やインスリンなどのホルモンをつくる内分泌細胞から発生するがんもありますが、膵臓がんの90%以上は、膵管の粘膜上皮細胞から発生する「膵管腺がん(Pancreatic ductal adenocarcinoma)」です。
膵管腺がんは胃がんや大腸がんと同様に、慢性的な刺激や炎症などによって、粘膜上皮細胞に遺伝子変異が生じ、複数のがん遺伝子やがん抑制遺伝子に遺伝子変異が蓄積することによってがん細胞になります。膵管は消化酵素が通るので、上皮細胞は消化酵素によって傷つきやすいかもしれません。
正常な膵管の上皮細胞にKRASやTP53やCDKN2やSMAD4などの遺伝子に変異が蓄積し、膵上皮内腫瘍性病変(Pancreatic Intraepithelial Neoplasm:PanIN) という前がん病変が出現し、さらに遺伝子変異が蓄積することによって、細胞の悪性化が進行し、ついには基底膜を超えて浸潤がんになるという多段階発癌仮説ががん研究者のコンセンサスになっています。

図:膵管の正常な粘膜上皮細胞(①)にがん遺伝子やがん抑制遺伝子に変異が生じると異型細胞(②)になり、さらに遺伝子変異が蓄積すると悪性度が進行し、ついには浸潤性を有するがん細胞(③)になる。組織学的には、正常な腺管上皮(④)は前がん病変の膵上皮内腫瘍性病変(⑤)となり、さらに悪性度が進行すると基底膜を破って周囲組織に浸潤する膵臓がん(⑥)となる。
【膵臓がんは抗がん剤だけではわずかな延命しか期待できない】
膵臓がんの論文のほとんどは、書き出しが共通しています。すなわち、膵臓がんの治療が極めて困難であること、予後が極めて不良であることの解説から書き始めています。膵臓がん治療の悲惨な現状を解説することが膵臓がんの論文の枕詞のようになっています。
膵臓がんは多くの治療法に抵抗し、再発や転移が多く、予後が極めて不良ながんです。
予後不良の原因の一つは早期発見が困難だからです。現在の状況では手術ができる段階で見つかるのは2割以下(治癒切除可能な患者は10〜15%程度)です。
80%以上の膵臓がんはすでに切除不能か肝臓転移や腹膜播種で手術の適応にはなりません。
ステージI(がんが2cm以内で膵臓内にとどまり、リンパ節転移の無いもの)にように極めて早期の段階で偶然見つかって手術を受けた場合は、5年生存率は50%前後と報告されていますが、このような早期の症例は膵臓がん全体の5〜6%程度です
膵臓がんが切除できた場合でも、生存期間の中央値は2年半程度です。
切除手術を受けた膵臓がんの補助化学療法の生存期間中央値はジェムザール単独が25.5ヶ月、ジェムザール/カペシタビン併用療法が28.0ヶ月という臨床試験の結果が出ています。
原発の切除ができても、再発や転移の頻度が多いので、5年生存率は20%程度です。
切除不能膵臓がんの場合は、抗がん剤治療を行なっても、多くの患者さんの生存期間は半年~1年程度です。
切除不能膵臓がんの抗がん剤治療の臨床試験で、生存期間中央値はゲムシタビン(ジェムザール)単独が5.7ヶ月、ゲムシタビン+nab-パクリタキセル(ナベルビン)が8.5ヶ月、FOLFIRINOX療法で11.1ヶ月と報告されています。
FOLFIRINOX療法は他の抗がん剤治療に比べて延命効果が高いのですが、副作用も強いため、若くて全身状態が良好な患者さんしか使えない治療です。いずれにしても、手術不能の膵臓がんの平均余命は1年以内となります。
膵臓がん全体では、3年生存率が15%程度、5年生存率は7〜9%程度です。
ステージ4の膵臓がんの5年生存率は2%以下です。
このように治療成績が悪いのは、がんが進行した場合に行われる抗がん剤治療の効き目が弱いからです。
たとえがんが進行して全身に広がっていても、抗がん剤がよく効けば、数年の延命が期待できます。膵臓がん以外のがんではステージ4でも抗がん剤治療で平均して2〜3年くらいは生存します。5年生存率は20%くらいです。(ただし、がん細胞の抗がん剤感受性を高める方法や副作用を軽減する治療法を併用すれば、かなりの延命が期待できます。)
しかし、ステージ4の膵臓がんは強い抗がん剤治療を行なっても生存期間中央値は6〜12ヶ月程度で、5年生存率は2%以下です。抗がん剤治療がほとんど効かないからです。
1997年にそれまでの標準的な治療であった 5-FU 単独療法とゲムシタビン (商品名:ジェムザール)単独療法を比較する第 III 相試験が行われました。ゲムシタビンの方が主要評価項目の症状緩和効果(clinical benefit response)が良好で、生存期間中央値も5-FU群が4.4ヶ月に対して、ゲムシタビン群が5.7ヶ月という結果で、その後はゲムシタビンが膵臓がん治療の中心になりました。
その後、ゲムシタビン に nab パクリタキセル(商品名: アブラキサン)を加えた併用療法とゲムシタビン単独療法を比較した臨床試験では,併用療法が全生存期間において単独療法より優れていました。
しかし、ゲムシタビン とnab パクリタキセルの併用療法の生存期間中央値は8.5ヶ月です。つまり、現行の抗がん剤治療では、切除できなかった場合は、通常の抗がん剤治療だけでは、半分の患者さんは1年以内に亡くなっているという現実があります。強い抗がん剤治療を受けても平均的には数ヶ月の延命効果しかありません。しかも、苦痛を伴っての数ヶ月です。
【がん細胞だけをターゲットにする抗がん剤は直ぐに効かなくなるメカニズムが存在する】
膵臓がんには抗がん剤や放射線や免疫療法が効かない理由が存在します。
その一つが、膵臓がん組織における強い間質反応による結合組織の増生です。
間質反応とは、がん細胞の周りに炎症細胞や線維芽細胞が増殖し、コラーゲンやヒアルロン酸が分泌されて結合組織ができ、その中に様々な間質細胞や血管が複雑に絡み合った構造ができる状態です。
この結合組織増生(Desmoplastic stroma)はがん細胞への抗がん剤や免疫細胞への到達を妨げているから、治療効果が出ないという考えです。

図:膵臓がんは浸潤傾向が高いがんで、臓器壁のバリアがないため、発生した膵臓がんはすみやかに連続性に膵臓内および周囲組織に進展・浸潤する(①)。したがって、根治手術を行なったつもりでも、術後に、高率に局所・肝・腹膜などに再発転移を起こす(②)。膵臓がん組織では、がん細胞(膵管腺がん細胞)を多量の結合組織が取り囲んでいる(③)。結合組織や細胞外マトリックスは線維芽細胞や活性化した膵星細胞から産生される(④)。これらの結合組織は抗がん剤や免疫細胞のがん細胞への到達を妨げている。
また、ゲムシタビンなどの抗がん剤治療が、がん細胞の増殖シグナル伝達系を刺激して、抗がん剤耐性を誘導することが知られています。例えば、ゲムシタビン投与が、がん細胞のNF-κBやSTAT3などの転写因子を活性化して、抗がん剤耐性を促進することが知られており、NF-κBやSTAT3の阻害剤を併用するとゲムシタビンの耐性が防げることが報告されています。
つまり、膵臓がんの治療においては、膵臓がん細胞を死滅させることを目的とする抗がん剤治療だけでは、その効果は極めて限定的です。
膵臓がん細胞をターゲットした抗がん剤感受性を高める方法、がん細胞の増殖活性を抑制する方法に加えて、抗炎症作用による間質反応の抑制、血管新生の阻害、抗腫瘍免疫の増強など、治療効果を高める方法を複数組み合わせる集学的な治療が必要です。
膵臓がんのみならず、一般的にがん組織にはがん細胞だけでなく、マクロファージなどの炎症細胞、リンパ球などの免疫細胞、結合組織を産生する線維芽細胞、血管やリンパ管、細胞外マトリックスなどが間質を構成しています。これらの間質はがん細胞の増殖を支持する働きを担っています。
強い間質反応による結合組織の増生が膵臓がんの組織学的特徴になっており、間質細胞は膵臓がん治療のターゲットとして極めて重要です。

図:がん組織はがん細胞(実質細胞)と間質から構成される(①)。間質では線維芽細胞や活性化膵星細胞が結合組織や細胞外マトリックスを産生するだけでなく、増殖因子やサイトカインを産生してがん細胞や炎症細胞の増殖を刺激し、免疫細胞の働きを抑制している(②)。特に、膵臓がんでは間質反応が亢進し、結合組織の顕著な増生が特徴。膵臓がんの治療においては、がん細胞のみをターゲットにしても抗腫瘍効果は極めて小さい。がん細胞とそれを取りまく様々な間質細胞や細胞外マトリックスから構成される「がん組織の微小環境」もターゲットにすることが重要。
【ビタミンD3のサプリメントは膵臓がんの抗がん剤治療の効果を高める】
膵臓には、ビタミンAを貯蔵し、コラーゲン等の細胞外マトリックスを合成・分泌する膵星細胞と呼ばれる細胞が存在します。
膵星細胞(Pancreatic Stellate Cells)は、膵臓中の主な線維芽細胞で、慢性膵炎や膵臓がんにおける線維化の主たる細胞外基質産生細胞であることが明らかになっています。
膵星細胞は、組織修復を促進する細胞外マトリックスタンパク質の合成および分解に関与し、膵腺房細胞に隣接して小膵管および血管周辺に分布します。膵星細胞が活性化されると、筋線維芽細胞様の形態を示し、慢性膵炎および腺癌で線維形成を誘導する細胞外マトリックスタンパク質を多量に分泌します。つまり、慢性膵炎や膵臓がんにおける線維形成に中心的役割を果たします。
さらに、膵星細胞は膵臓がん細胞と相互作用し、増殖因子を産生してがん細胞の増殖を刺激し、アポトーシスを阻害し、血管新生を促進します。したがって、膵星細胞は慢性膵炎と膵臓がんの治療のターゲットとして注目されています。(膵星細胞については617話参照)

図:膵星細胞は正常状態ではビタミンA含有脂肪滴を多く含んで、静止状態になっている(①)。組織傷害や炎症刺激で膵星細胞が活性化されると、脂肪滴は消失し、α平滑筋アクチンを発現して収縮性を持つ筋線維芽細胞様の形態を示す(②)。活性化した膵星細胞は増殖因子を産生してがん細胞の増殖や生存を促進し(③)、サイトカインやケモカインを産生して炎症反応を亢進し、さらに線維形成を誘導する細胞外マトリクス・タンパク質を多量に分泌する(④)。
膵臓がん組織の間質に存在する線維芽細胞や膵星細胞の活性を抑制することは、抗がん剤や放射線治療の効き目を高めることができます。その方法としてビタミンD3のサプリメントの有効性が報告されています。以下のような論文があります。
Vitamin D Supplementation is a Promising Therapy for Pancreatic Ductal Adenocarcinoma in Conjunction with Current Chemoradiation Therapy.(ビタミンDの補充は現在の化学放射線治療との併用において膵管腺がんの有望な治療法である)Ann Surg Oncol. 2018 Jul;25(7):1868-1879.
大阪大学医学部の消化器外科からの報告です。
【要旨】
研究の背景:膵管腺がん組織におけるがん関連線維芽細胞はがん細胞の遠隔転移の成立に重要な役割を担っていることが知られている。しかしながら、現在行なわれている化学放射線療法のがん関連線維芽細胞に対する影響については不明である。
目的:本研究は、現行の化学放射線療法におけるがん関連線維芽細胞の役割を明らかにし、がん関連線維芽細胞を制御する因子を検討することを目的とした。
手術前の化学放射線治療の有り無しを含めて、86例の切除した膵管腺がんの組織において、α-SMA陽性細胞を免疫染色によって解析した。血中ビタミンD濃度を含めて様々な要因と、がん組織中のがん関連線維芽細胞の数や無遠隔転移生存期間(distant metastasis-free survival)との関連を解析した。臨床検体から抽出したヒト膵星細胞を用いて、これらの因子を検証した。
結果:膵管腺がん組織の全てのサンプルにがん関連線維芽細胞が含まれていたが、その数は大きく異なっていた。無遠隔転移生存期間に関する多変量解析では、がん関連線維芽細胞の多さが有意な危険因子であった。
がん関連線維芽細胞の数に対する単変量解析では、術前化学放射線療法と血漿ビタミンD低値の2つが臨床的要因として同定された。
サブグループ分析では、術前化学放射線療法を受けた膵管腺がん患者において、血漿ビタミンDの高値が無遠隔転移生存期間の延長の支配的因子であった。
これらの結果は、膵臓がん組織から抽出されたヒト膵星細胞を用いて検証された。
放射線照射は間質細胞をがん関連線維芽細胞に活性化させ、膵管腺がんの悪性化を促進し、その悪性促進作用はのビタミンD補充によって阻害されることがin vitroの実験で示された。
結論:確立された現在の治療法と併せて、ビタミンDの補充は、がん関連線維芽細胞を不活性化することによって膵管腺がん患者に有効な治療法となり得る。
簡単にまとめると、膵臓がんに抗がん剤や放射線照射を行なうと、がん関連線維芽細胞や膵星細胞が活性化され、これらの細胞から分泌される増殖因子や炎症性サイトカインによってがん細胞の増殖を刺激し促進します。このようながん関連線維芽細胞や膵星細胞の作用をビタミンDの補充が阻止するという報告です。
ビタミンDが膵星細胞の活性化を抑制することが報告されています。以下のような報告があります。
Vitamin D receptor-mediated stromal reprogramming suppresses pancreatitis and enhances pancreatic cancer therapy.(ビタミンD受容体を介する間質細胞のリプログラミングは膵臓炎を抑制し、がん治療を増強する)Cell. 2014 Sep 25;159(1):80-93. doi: 10.1016/j.cell.2014.08.007.
【要旨】
膵管腺がんの治療成績が不良な理由は、がん細胞の抗がん剤抵抗性と増殖を促進する腫瘍微小環境に起因する。
休止の状態から活性化された膵星細胞(pancreatic stellate cells)への変換は、膵管腺がんを特徴付ける重度の間質反応を引き起こす。
ここ研究では、ビタミンD受容体がヒト膵臓がんの間質で発現し、ビタミンD受容体のリガンドのカルシポトリオール(calcipotriol)による治療が、膵炎およびヒト膵臓がんの間質における炎症および線維化のマーカーを著しく減少させることを明らかにする。
ビタミンD受容体が膵星細胞の最重要な転写調節因子として働き、活性化した膵星細胞を静止状態に誘導して間質リモデリングを誘導する。その結果、抗がん剤単独の場合と比べて、カルシポトリオールの併用は、腫瘍内ゲムシタビンの増加、腫瘍容積の減少、および生存率の57%の増加をもたらすことを示す。
この研究は、腫瘍間質細胞の遺伝子転写の再プログラミングが化学療法応答性を高め、膵管腺がんの治療における補助物質としてのビタミンDの有用性を示唆する。
この論文は米国のソーク研究所(Salk Institute)やコールドスプリングハーバー研究所(Cold Spring Harbor Laboratory)など10カ所以上のレベルの高い研究機関からの29人が著者になっており、生物系では超一流学術雑誌のCellに掲載されているので、その研究結果は信頼性が高く、かなり重要だと考えらます。
この研究では、ras遺伝子の活性型突然変異とp53癌抑制遺伝子欠損を膵管細胞で誘導して、人間の膵臓がんに近いがんを発生させるモデルを使っています。
がん組織から膵臓の間質反応に重要な細胞として知られている膵星細胞を分離して遺伝子発現を比べ、ビタミンD受容体が、マウスでもヒトでも膵星細胞に強く発現している事を明らかにしています。
このビタミンD受容体は間質細胞で発現しており、炎症における組織化に関与していると考えられています。従って膵星細胞での発現の意味を調べるために、ビタミンD受容体をcalcipotriolという薬剤で刺激すると、星細胞の活性化状態が収まり、元々の脂肪を貯めた細胞の形に戻りました。さらに、マウスの膵臓炎症も同じ薬剤で押さえられる事が明らかになりました。
すなわち、ビタミンD受容体の刺激は膵星細胞の活性化を押さえ、炎症を抑える働きがあるということです。
同じように膵臓がんで起こってくる膵臓の炎症性変化に対するビタミンD受容体刺激の効果を調べると、炎症や線維化が強く押さえられる事が示されました。さらに、膵臓がんをジェムシタビンで治療するモデル実験系でビタミンD受容体刺激を行なうと生存期間が約50%伸びることが示されています。
以上をまとめると、膵星細胞が活性化されると、様々な炎症性因子を分泌し間質反応を促進し、がん細胞の増殖も促進されるが、これをビタミンD受容体刺激で押さえる事ができるということです。
つまり、膵臓がんの治療では、ビタミンD3のサプリメントを1日4000〜10,000 IU(国際単位)程度摂取することは試してみる価値があります。
【膵星細胞はIL-6/STAT3シグナル伝達系を刺激してがん細胞の増殖を促進する】
膵星細胞は細胞外マトリックスや結合組織の産生だけでなく、増殖因子や炎症性サイトカインやケモカインを産生して、がん細胞の増殖を促進する微小環境を作り出しています。
つまり、ビタミンD3など膵星細胞の活性化を抑制する治療法とIL-6/STAT3シグナル伝達系を阻止する治療法の併用の有効性が示唆されます。以下のような報告があります。
Pancreatic stellate cell secreted IL-6 stimulates STAT3 dependent invasiveness of pancreatic intraepithelial neoplasia and cancer cells.(膵星細胞が分泌するIL-6は、膵上皮内腫瘍性病変細胞とがん細胞におけるSTAT3依存性の浸潤性を促進する)Oncotarget. 2016 Oct 4;7(40):65982-65992.
【要旨】
膵管腺がんは、膵星細胞などのいくつかの間質細胞によって支持される動的な腫瘍である。 膵星細胞と膵臓がん細胞の間には積極的な相互作用があり、発がん過程やがん細胞の悪性進展を促進している。しかしながら、膵星細胞がどのようにして膵臓がん細胞における細胞間シグナル伝達を活性化するかについてはまだ解明されていない。
我々は、シグナル伝達兼転写活性化因子3(Signal Tranducer and Activator of Transcription3)の活性化が、膵臓がんの進行を促進する重要なメカニズムであることを以前示した。
我々は、膵星細胞が分泌するIL-6がSTAT3シグナル伝達系を刺激して、膵臓がんの前がん病変である膵上皮内腫瘍性病変(pancreatic intraepithelial neoplasia)から膵臓がんへの進展を促進しているという仮説を立てた。
ヒトの膵臓がん細胞およびマウスの膵上皮内腫瘍性病変細胞を、膵星細胞を培養した後の培地で処理し、リン酸化したSTAT3および全STAT3のレベルを解析した。
膵星細胞を培養した後の培地のIL-6の量を測定し、IL-6の中和抗体およびJAK / STAT3阻害剤AZD1480の存在下または非存在下で細胞浸潤およびコロニー形成アッセイを行った。
膵臓がんを持たないマウスに比較して、膵臓がんの担がんマウスでは、血中のIL-6のレベルが有意に高値を示した。
膵星細胞から分泌されたIL-6は、非浸潤性前がん病変の膵上皮内腫瘍性病変細胞および膵臓がん細胞においてSTAT3シグナル伝達系を活性化し、結果として両方の細胞型において細胞浸潤およびコロニー形成が増強された。
IL-6濃度とリン酸化STAT3 /総STAT3の比との間に有意な正の直線的相関があった。 IL-6の中和抗体によるIL-6の不活性化またはSTAT3阻害は、膵星細胞を培養した培地によって誘導されるSTAT3シグナル伝達系の活性化および腫瘍形成性を抑制した。
これらの実験結果は、膵上皮内腫瘍性病変から浸潤性膵臓がんへの進行において、膵星細胞が直接関与しているという証拠を提供する。
この研究は、STAT3シグナル伝達の活性化を介する非浸潤性前がん病変の膵上皮内腫瘍性病変細胞から浸潤性膵臓がんへの進展における膵星細胞から分泌されるIL-6の新規な役割を示している。
つまり、活性化した膵星細胞はIL-6の産生によってがん細胞のSTAT3シグナル伝達系を活性化して、増殖や浸潤を亢進するというメカニズムです。
【STAT3はがん細胞の増殖を促進する】
STAT3は、STAT (Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子) ファミリーに属する蛋白質で、その名の通り、「シグナル伝達」と「遺伝子転写活性化」の両方において働きます。
STAT3は非活性化状態においては細胞質に存在しますが、ヤーヌスキナーゼ(Janus Kinase; JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
JAKはサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化する酵素(チロシンキナーゼ)の一種です。
IL-6ファミリーのサイトカインあるいは上皮成長因子(EGF)等の成長因子がそれらの受容体に結合することによりヤーヌスキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。
STAT3のリン酸化はJAKを介する以外に、増殖因子や成長因子の受容体が直接リン酸化する場合や、Srcなどの非受容体性チロシン・キナーゼによっても起こります。つまり、様々な細胞刺激に応答してSTAT3がリン酸化されて、増殖や生存を促進する作用を発揮します(下図)。
図:JAK(Janus Kinase;ヤーヌスキナーゼ)はサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化するチロシンキナーゼ活性を持つ(①)。IL-6や上皮成長因子(EGF)などの受容体が刺激されるとJAKが活性化されてSTAT3がリン酸化される(②)。STAT3のリン酸化は受容体性チロシンキナーゼや非受容体性チロシンキナーゼ(Srcなど)でも起こる(③)。STAT3は不活性な状態では細胞質に存在し、JAK(ヤーヌスキナーゼ)などでチロシン705がリン酸化されると、STAT3二分子のSH2ドメインが、それぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行する(④)。核内に移行したSTAT3二量体は、標的となるDNAに結合する事で転写を活性化する(⑤)。STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する(⑥)。
【炎症とがんとIL-6/STAT3】
「慢性炎症は、がんの発生や進展を促進する」というのは、多くのエビデンスがあり、がん研究では常識的な考えになっています。がんと炎症との関連においては、炎症性サイトカイン(TNF-α、IL-1、IL-6など)や、転写因子のNF-κBや、シグナル伝達系のSTAT(Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子)ファミリーのタンパク質や、化学伝達物質のプロスタグランジンなどが複雑に関与しています。
この中で、IL-6/STAT3シグナル伝達系が炎症とがんの治療のターゲットとして注目されています。多くのがんでは炎症過程が亢進しており、この炎症過程の中心にいるのがIL-6とSTAT3の連携です。
インターロイキン6(IL-6)はB細胞に作用して抗体産生を誘導するT細胞由来のサイトカインとして発見されました。サイトカインというのは、リンパ球や炎症細胞から分泌されて、免疫や炎症や創傷治癒など様々な生理機能の調節を担うタンパク質です。
サイトカインは細胞表面の膜上にある受容体に結合することによって、受容体に特有の細胞内シグナル伝達の引き金となります。炎症過程に関与するものは炎症性サイトカインと呼ばれています。
IL-6は代表的な炎症性サイトカインであり、自己免疫疾患など慢性炎症性疾患の発症や進展に重要な役割を担っており、IL-6の働きを阻害する薬は関節リュウマチのような慢性炎症性疾患の治療に使用されています。
IL-6は免疫や炎症のみならず、乳がんや前立腺がんを始めとする様々ながん細胞の増殖や悪性化にも深く関わっていることが明らかになっています。
慢性炎症によってIL-6の体内での産生が高い状態はがんの発生や進展を促進します。IL-6の血中濃度が高いほどがん患者の予後が悪いという報告もあります。
IL-6の作用は主にシグナル伝達分子であるSTAT3によるものであることが明らかにされています。
STAT3はさまざまなサイトカインや成長因子からのシグナルを統合して免疫や炎症を制御する転写因子であり、また、炎症に起因した発がんに重要な働きをすることが報告されています。

図:細菌感染や組織の傷害やがんは炎症応答を引き起こし、これらはいずれもIL-6(インターロイキン-6)の産生を刺激する。細菌のLPS(リポポリサッカライド)と炎症反応で産生されるIL-1βやTNF-αや活性酸素は炎症性転写因子のNF-κBを活性化し(①)、活性化したNF-κBはIL-6遺伝子の発現を亢進する(NF-κB依存性経路)。炎症応答でTGFβ(Transforming Growth Factor β)とCOX-2(シクロオキシゲナーゼ-2)の発現が誘導され(②)、COX-2はPGE2(プロスタグランジンE2)の産生を高める(③)。TGFβとPGE2はIL-6の産生を亢進する(NF-κB非依存性経路)。IL-6はIL-6受容体を介してJAK(ヤーヌスキナーゼ)を活性化し(④)、細胞の増殖と生存を制御するSTAT3経路、PI3K/AKT経路、MAPK経路を活性化し(⑤)、その結果、がん細胞の増殖や転移やアポトーシス抵抗性が促進される(⑥)。PGE2は直接的に作用してがん細胞の増殖や転移を促進する(⑦)。(参考:Cancer Manag Res. 2011; 3: 177–189.)
IL-6/STAT3シグナル伝達系を阻害する方法としてオーラノフィン(427話)、ジインドリルメタン(428話)、セレコキシブ(428話)があります。
また、IL-6/STAT3シグナル伝達系の上流に位置するTNF-αやNF-κBの阻害にはオーラノフィン(431話)とサリドマイド(544話)があります。
これらの治療法を組み合わせて、膵臓がん組織の炎症応答を抑制すれば、がん細胞の増殖活性を低下させ、がんとの共存に役立ちます。

図:がん組織内では膵星細胞や線維芽細胞やマクロファージが活性化されて炎症応答が起こる(①)。炎症反応で産生されるIL-1βやTNF-αや活性酸素は炎症性転写因子のNF-κBを活性化し、IL-6遺伝子の発現を亢進する(②)。炎症応答でTGFβ(Transforming Growth Factor β)とCOX-2(シクロオキシゲナーゼ-2)の発現が誘導され、COX-2はPGE2(プロスタグランジンE2)の産生を高める。TGFβとPGE2はIL-6の産生を亢進する(③)。IL-6はIL-6受容体を介してJAK(ヤーヌスキナーゼ)を活性化し、細胞の増殖と生存を制御するSTAT3経路、PI3K/AKT経路、MAPK経路を活性化する(④)。その結果、がん細胞の増殖や転移やアポトーシス抵抗性が促進される(⑤)。PGE2は直接的に作用してがん細胞の増殖や転移を促進する(⑥)。セレコキシブはCOX-2活性を阻害し(⑦)、オーラノフィンはSTAT3の活性を阻害する(⑧)。ジインドリルメタンはJAK/STAT3経路を阻害し(⑨)、サリドマイドとオーラノフィンはTNF-αの発現とIκBキナーゼを阻害してNF-κBを阻害する(⑩)。ビタミンD3は膵星細胞やがん関連線維芽細胞の活性化を阻止する(⑪)。このような抗炎症作用はがん細胞の増殖や浸潤を抑制する。
膵臓がんの補完・補完代替療法は多数の種類があります。その一部を以下の書籍でまとめています。
| « 619)膵臓がん... | 621)「植物の... » |