がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
415)VDAC-1とヘキソキナーゼ-IIと黄芩(オウゴン)
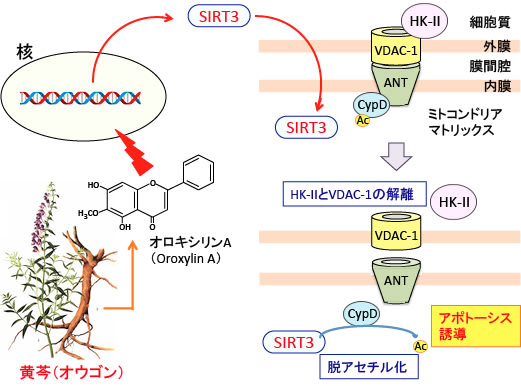
図:生薬の黄芩(オウゴン:Scutellaria baicalensis Georgi)に含まれるオロキシリンAは、細胞核のDNAに作用してサーチュイン3(SIRT3)の発現を亢進し、ミトコンドリアへの移行を促進する。ミトコンドリア内に入ったSIRT3はシクロフィリンD(CypD)を脱アセチル化して不活性化するとヘキソキナーゼ-II(HK-II)とVDAC-1(電位依存性陰イオンチャネル-1)が解離する。その結果、アポトーシスが誘導される。
415)VDAC-1とヘキソキナーゼ-IIと黄芩(オウゴン)
【VDAC-1はアポトーシスの制御に働いている】
ミトコンドリアは細胞の生存と死の両方に必須の働きを行っています。
ミトコンドリアは酸化的リン酸化によってエネルギー(ATP)を産生します。つまり、ミトコンドリアは細胞のエネルギー産生工場です。
一方、ミトコンドリアの異常はアポトーシスや壊死による細胞死を引き起こし、様々な病気の発生に関与しています。
このミトコンドリアによる細胞の生存と死の制御に重要な働きを行っているのがVDAC1です。
VDAC1(Voltage-dependent anion channel-1: 電位依存性陰イオンチャネル1)は細胞質とミトコンドリアの間の代謝産物やエネルギー(ATP)やイオンなどを通過させるゲートで、ミトコンドリア・ポリン(mitochondrial porin)とも呼ばれます。
多くのがん細胞でVDAC1の発現が亢進しており、VDAC1の発現を阻害するとがん細胞の増殖が停止することが報告されています。
また、VDAC1はPTP(permeability transition pore:ミトコンドリア膜透過性遷移孔)を形成してアポトーシスの発現にも関与します。
PTPはミトコンドリア内膜と外膜との接触部位に存在する穴様の構造で、VDAC1、アデニン・ヌクレオチド・トランスロカーゼ(adenine nucleotide translocase)、シクロフィリンD(cyclophilin D)などで構成される蛋白複合体です。
PTPはミトコンドリア膜透過性遷移現象(mitochondrial membrane permeability transition:MPT)に関与します。
MPTは、カルシウム依存性(Ca2+依存性)に内膜の透過性が亢進し、その結果、ミトコンドリアの膜電位(mitochondrial transmembrane potential)が低下し、ミトコンドリアが膨化し、ミトコンドリア外膜の崩壊を伴うミトコンドリアの機能障害が起こって、アポトーシスが誘導されます。
アポトーシスを制御するBax(アポトーシスを促進する)やBcl-2(アポトーシスを抑制する)はPTPに作用してアポトーシスを制御しています。
つまり、PTPを開くように作用するとアポトーシスが起こり、PTPを閉めるように作用するとアポトーシスの進行を阻害します。(下図参照)

図:PTP(permeability transition pore:ミトコンドリア膜透過性遷移孔)はミトコンドリアの内膜と外膜を貫通するタンパク質複合体で、ミトコンドリア・マトリックスと細胞質の間の水や低分子物質の移行に関与する。
ミトコンドリア外膜で最も多いタンパク質であるVDAC1(voltage-dependent anion channel-1)とマトリックスの可溶性タンパク質のCypD(cyclophilin D:シクロフィリンD)、ANT(adenine nucleotide translocase:アデニン・ヌクレオチド・トランスロカーゼ)で構成される。さらに、HK-II(Hexokinase-II:ヘキソキナーゼ-II)、CK(Creatinekinase:クレアチンキナーゼ)、PBR(peripheral benzodiazepine receptor:末梢性ベンゾジアゼピン受容体)が結合している。
シクロフィリンD(CypD)は、通常はミトコンドリアのマトリックスに存在し、MPT(mitochondrial membrane permeability transition:ミトコンドリア膜透過性遷移現象)に際して、ミトコンドリア内膜に移行する。そして、シクロフィリンDは、内膜に存在するANT、外膜に存在するVDACなどとPTPを形成する。
Bcl-2ファミリーのBcl-2(アポトーシスを抑制する)やBax(アポトーシスを促進する)はPTPの開閉に作用してアポトーシスを制御している。
【がん細胞ではヘキソキナーゼ-IIの発現と活性が亢進している】
がん細胞ではグルコースの取込みと解糖系が亢進しているのが特徴で、これをワールブルグ効果と言います。
このワールブルグ効果を是正すること、すなわちグルコースの取込みと解糖系の亢進を抑制することは、がん細胞の増殖の抑制につながることになります。
がん細胞におけるワールブルグ効果の成立には様々な因子やタンパク質が関与していますが、これらはがん治療のターゲットとして研究されています。その一つがヘキソキナーゼ-II(HK-II)です。
ヘキソキナーゼはグルコーストランスポーターを介して細胞内に取り込んだグルコース(ブドウ糖)の6位の水酸基をATP(アデノシン3リン酸)を使ってグルコース-6リン酸に変換する酵素です(下図)。

図:ヘキソキナーゼは細胞内に取込んだグルコースにATPを使ってリン酸化してグルコース-6リン酸に変換する酵素。グルコース-6リン酸になるとグルコース・トランスポーターを通過することができなくなるので、細胞内に保持され、解糖系やペントース・リン酸経路などで代謝される。
グルコースはグルコース・トランスポーターを通過できますが、リン酸化されてグルコース-6リン酸になるとグルコース・トランスポーターを通過できません。
つまり、細胞内に入ってきたグルコースを細胞内に停めておき、そのから先の代謝に進めるための最初のステップに働く酵素です。解糖系の律速酵素の一つです。
グルコース-6リン酸は、解糖系で代謝されてピルビン酸になり、さらにミトコンドリアで代謝されてATP産生に使用されます。また、ペントース・リン酸経路などでNADPHや核酸などの産生に使われます。
ヘキソキナーゼにはIからIVの4種類のアイソフォーム(基本的な機能に関連するアミノ酸残基は共通しているが、他の部分の アミノ酸配列は異なるタンパク質)があります。
このうち、がん細胞ではヘキソキナーゼ-IIが多く発現しているのが特徴です。つまり、がん細胞ではヘキソキナーゼ-IIの発現と活性が亢進している結果、解糖系が亢進し、細胞分裂に必要なエネルギー産生と物質合成が亢進しているのです。
したがって、ヘキソキナーゼ-IIの発現を抑制したり、ヘキソキナーゼ-IIの活性を阻害すると、がん細胞で亢進している解糖系を抑制してがん細胞の増殖を抑えることができます。
ヘキソキナーゼ-IIは低酸素誘導因子—1(HIF-1)によって発現が誘導されるので、HIF-1の発生を阻害する方法(ラパマイシン、ジインドリルメタン、シリマリンなど;364話参照)やヘキソキナーゼを阻害する2-デオキシグルコースやメトホルミン(368話参照)を用いれば、がん細胞の解糖系を阻害することができます。
【がん細胞ではヘキソキナーゼ-IIがVDAC-1と結合している】
VDAC1(Voltage-dependent anion channel-1:電位依存性陰イオンチャネル-1)はミトコンドリア外膜に存在するチャネル蛋白質で、ミトコンドリアと細胞質の間の代謝物質の輸送を制御し、細胞のエネルギー産生やアポトーシス(細胞死)の制御に重要な役割を担っています。
チャネル(channel)というのは細胞の生体膜(細胞膜や内膜など)にある膜貫通タンパク質の一種で、イオンや低分子物質を透過させるタンパク質の総称です。
特にがん細胞においては、VDAC1に解糖系酵素のヘキソキナーゼ-IIが結合して、低酸素環境下でも発育できる特殊なエネルギー代謝系(解糖系の亢進)を確立しています。
すなわち、がん細胞ではヘキソキナーゼ-IIが過剰に発現しており、ミトコンドリア外膜のVDAC1に結合し、グルコースからグルコース-6リン酸への変換を促進しています。
ミトコンドリアのマトリックスのATP合成酵素はアデニン・ヌクレオチド輸送体や無機リン酸輸送体と複合体を形成し、ミトコンドリアで産生したATPをVDAC1に結合したヘキソキナーゼーIIへ直接送り込み、ヘキソキンーゼ-IIはこのATPを使って、グルコースをリン酸化しています。
がん細胞において、増殖能を維持するためには、このヘキソキナーゼ-IIとVDAC1の結合が重要であり、この結合が阻害されると、グルコース代謝によるがん細胞のエネルギー産生と物質合成が阻害されます(下図)。
つまり、ヘキソキナーゼ-II(HK-II)とVDAC1の過剰発現と、HK-IIとVDAC1の結合ががん細胞のワールブルグ効果(解糖系の亢進)を引き起こす重要なポイントと言えます。そしてさらに、ヘキソキナーゼがVDAC1から解離すると、PTP(ミトコンドリア膜透過性遷移孔) によるMPT(ミトコンドリア膜透過性遷移現象)が亢進します。

図:細胞膜のグルコース・トランスポーターを通って細胞内に取込まれたグルコースは、ヘキソキナーゼ-II(HK-II)によってリン酸化されグルコース・6リン酸に変換される。リン酸基がつくとグルコース・トランスポーターを通過できないので、細胞内に保持されてさらに解糖系やペントース・リン経路で代謝され、ATPやNHDPHや核酸の産生に使われる。ヘキソキナーゼーIIはミトコンドリアの外膜に存在するVDAC1(Voltage-dependent anion channel-1:電位依存性陰イオンチャネル-1)に結合している。
ATP合成酵素はANT(adenine nucleotide translocator:アデニン・ヌクレオチド輸送体)とPiC(inorganic phosphate carrier:無機リン酸輸送体)と複合体を形成し、ミトコンドリアで産生したATPをVDAC1に結合したヘキソキナーゼーIIへ直接送り込む。ヘキソキンーゼ-IIはこのATPを使って、グルコースをリン酸化する。
がん細胞において増殖能を維持するためには、このヘキソキナーゼ-IIとVDAC1の結合が重要であり、この結合が阻害されると、グルコース代謝によるがん細胞のエネルギー産生と物質合成が阻害される。(Semin Cancer Biol. 19(1): 17–24. 2009年のFig.1を改変)
【オロキシリンAはヘキソキナーゼ-IIとVDAC1の結合を解離してアポトーシスを促進する】
がん細胞はVDAC1とヘキソキナーゼ-IIの発現量が増えています。この2つのタンパク質の発現量が多いほど、増殖活性が高く悪性度が高いという報告があります。
この2つのタンパク質の発現亢進は、がん細胞における解糖系の亢進とアポトーシス抵抗性を引き起こしています。この働きにはVDAC1とヘキソキナーゼ-IIが結合していることが必要です。
VDAC1にヘキソキナーゼ-IIが結合していると、VDAC1を通過したATPがヘキソキナーゼ-IIにすぐに利用されて、エネルギー産生にメリットになります。
さらに、VDAC1にヘキソキナーゼ-IIが結合すると、PTP(ミトコンドリア膜透過性遷移孔)の働きに作用して、アポトーシスを阻止します。そして、VDAC1とヘキソキナーゼ-IIの結合を解離させるとアポトーシスが起こりやすくなることが明らかになっています。
黄芩(オウゴン)という生薬に多く含まれるオロキシリンAがVDAC-とヘキソキナーゼ-IIの結合を阻害して解離させ、がん細胞のアポトーシスを誘導することが報告されています。次のような報告があります。
Oroxylin A induces dissociation of hexokinase II from the mitochondria and inhibits glycolysis by SIRT3-mediated deacetylation of cyclophilin D in breast carcinoma.(オロキシリンAは乳がん細胞において、SIRT3によるシクロフィリンDの脱アセチル化によってヘキソキナーゼ-IIをミトコンドリアから解離させ、解糖系を阻害する)Cell Death Dis. 2013 Apr 18;4:e601. doi: 10.1038/cddis.2013.131.
【要旨】
オロキシリンA(Oroxylin A)は中国伝統医療で使用される黄芩(オウゴン:Scutellaria baicalensis Georgi)の主要な活性成分の一つで、有効な抗がん活性を有することが報告されている。
この報告では、ヒト乳がん細胞株を用いた実験で、オロキシリンAがヘキソキナーゼ-IIとミトコンドリアの結合と解糖を阻害し、その作用がサーチュイン-3(sirtuin-3; SIRT3)に依存することを示した。
ミトコンドリアにおけるSIRT3の量はオロキシリンAによって増加した。そして、SIRT3はシクロフィリンD(cyclophilin D)を脱アセチル化し、そのペプチジル-プロリル・シス-トランス・イソメラーゼ(peptidyl-prolyl cis-trans isomerase)活性を低下させ、シクロフィリンDをアデニンヌクレオチド輸送体(adenine nucleotide translocator)との結合から解離させた。
最終的に、SIRT3によって引き起こされるシクロフィリンDの不活性化はヘキソキナーゼ-IIとミトコンドリアの結合を阻害して解離させ、解糖を阻害した。
以上の結果から、乳がん細胞におけるオロキシリンAによるミトコンドリア障害を介する細胞毒性の作用機序として、SIRT3に依存したエネルギー産生の阻害が示唆された。
シクロフィリンD(cyclophilin D)はpeptidyl-prolyl cis-trans isomerase D (PPID)とも呼ばれるタンパク質でミトコンドリア・マトリックスに存在し、ヘキソキナーゼ-IIとVDACの結合を促進する作用があります。
オロキシリンAは黄芩(オウゴン)という生薬に含まれるフラボノイドの一種で、抗酸化作用、抗炎症作用、抗ウイルス作用、抗腫瘍作用など多彩な薬理活性を示すことが報告されています。
オロキシリンAの抗腫瘍作用のメカニズムに関しては、アポトーシスの誘導、転移能の阻害、細胞周期の停止などが今までに報告されています。
この論文では、新規の作用メカニズムとして、オロキシリンAがミトコンドリアのサーチュイン3を活性化してシクロフィリンDを脱アセチル化して活性を阻害し、その結果、ヘキソキナーゼ-IIとミトコンドリアの結合が阻害されて解離し、がん細胞の解糖系が抑制されるというメカニズムを示しています。(トップの図を参照)
乳がん、大腸がん、肝臓がん、肺がん、膵臓がん、甲状腺がんなど多くのがん細胞でVDAC1の発現が亢進していることが報告されています。
また、多くのがん細胞でヘキソキナーゼ-IIの発現が亢進しています。悪性度が高く増殖の早いがん細胞ほどHK-II活性が高い
さらに、多くのがん細胞はヘキソキナーゼがミトコンドリアに結合しており、これは解糖系でのエネルギー産生と細胞の生存に有利に作用することが明らかになっています。
HK-IIとVDAC1の結合は、解糖系の最初のステップで、ATPにすぐアクセスできる状態になるからです。
つまり、HK-IIとVDAC1の発現亢進とHK-IIとVDAC1の結合はがん細胞におけるワールブルグ効果の成立に最も重要であると言えます。
HK-IIとミトコンドリアの相互作用を壊すとがん細胞のワールブルグ効果は破綻し、細胞死が誘導されます。(下図)

(トップの図を参照)
| « 414)VDAC-1と... | 416) 再開発医... » |



