がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
295)糖と脂肪とがん(その2):糖質制限食とケトン食
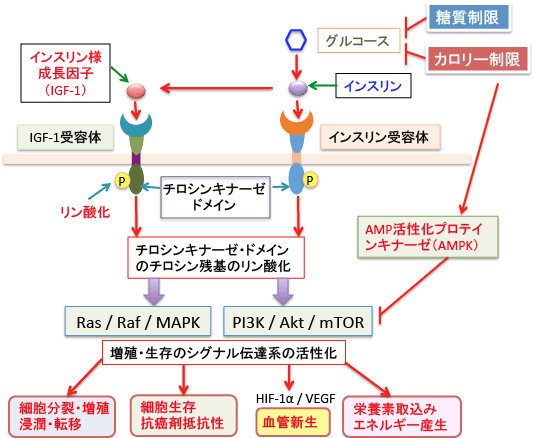
図:グルコース(ブドウ糖)とインスリンは直接的にがん細胞の増殖を促進する作用を持つ。さらに、高インスリン血症はインスリン様成長因子を介して増殖や転移や抗がん剤抵抗性を促進する。インスリンおよびインスリン様成長因子はそれらの受容体に結合することによって受容体のチロシンキナーゼ・ドメインをリン酸化し、細胞内シグナル伝達系のRas/Raf/MAPK経路とPI3K/AKT/mTOR経路を活性化する。カロリー制限や糖質制限は、これらの経路を阻止することによって抗がん作用を発揮する。
295)糖と脂肪とがん(その2):糖質制限食とケトン食
【カロリー制限 vs 糖質制限】
最近は、糖尿病治療や減量(ダイエット)の目的で糖質制限食がブームになっています。「主食を抜けば糖尿病は良くなる!(江部康二 著、東洋経済新報社 2005年)」「食べても太らない糖質ゼロの健康法(釜池豊秋 著、洋泉社 2011年)」というような本が多数出ています。糖質を減らせば、肉や脂肪やアルコールを多くとっても血糖は上がらないし、体重も増えないという内容です。アマゾンの書籍で『糖質制限』で検索すると150以上の書籍がヒットします。
従来の糖尿病食事療法の基本はカロリー制限食です。カロリー制限食では、身体活動量などに合わせてカロリー計算を行います。通常、摂取総エネルギー量=標準体重(kg) X 仕事別消費カロリーで計算します。仕事別消費カロリーは、軽労作(デスクワークが主な仕事が主婦など)は25~30kcal、普通の労作(立仕事が多い職業)は30~35kcal、重い労作(力仕事の多い職業)で35kcal以上となっています。(厚生労働省のホームページより)
例えば、標準体重60kgでデスクワークが主な仕事の人は1500~1800キロカロリーに制限します。カロリー制限食では、食べてはいけないものはなく、主食の炭水化物の量もカロリーに応じて減らすだけです。
「総カロリーを制限し、カロリーの約半分は炭水化物から取り、脂肪摂取を控え、食後に血糖が高くなることに対しては、糖尿病の薬やインスリンを用いて下げればいい」というのが今までの糖尿病治療の基本です。しかし、カロリー制限による食事療法では血糖を下げることも体重を減らすことも難しいということも指摘されています。カロリー制限に寿命を延ばす効果があることが霊長類でも確認されており、アンチエイジングの領域でもカロリー制限が推奨されています。しかし、カロリーを減らす食事の第一の欠点は、空腹感によって長続きしにくいということです。
一方、数年前から「炭水化物(糖質)制限食」が糖尿病の食事療法として注目されています。「食後に血糖を上げるのは炭水化物(糖質)だけだから、献立からご飯やうどんやパンを減らせば、血糖は上がらない」という考えが糖質制限食の根拠です。実際に、糖質制限の方が血糖をコントロールしやすいと言われています。血糖を上昇させるのは糖質だけだからです。食後高血糖の是正という点では,糖質制限食が非常に優れた食事療法であることが示されています。さらに,体重減少,HbA1cの改善,トリグリセライド(TG),HDLコレステロール(HDL-C)など血清脂質値の改善においてもカロリー制限食と同等かそれ以上の効果を示しています。
近年、糖質制限食の有効性を示すエビデンスも蓄積され、米国糖尿病学会は2011年のガイドラインでは、カロリー制限食と糖質制限食がともに糖尿病食事療法の選択肢として推奨されています。米国糖尿病学会のガイドラインでは、2007年までは「糖質制限食(130g/日以下)はしてはいけない」、2008年には「カロリー制限食と同様に減量に有効」、2012年には「血糖管理や脂質改善にも有効」となっており、現在では糖質制限食は減量と糖尿病の食事療法として評価されているのです。
日本でも一部の専門家は糖質制限食を高く評価しています。しかし、日本糖尿病学会の門脇孝理事長(東大病院長)は7月26日に「炭水化物を総摂取カロリーの40%未満に抑える極端な糖質制限は、脂質やたんぱく質の過剰摂取につながることが多い。短期的にはケトン血症や脱水、長期的には腎症、心筋梗塞や脳卒中、発がんなどの危険性を高める恐れがある。現在一部で広まっている糖質制限は、糖尿病や合併症の重症度によっては生命の危険さえあり、勧められない」という見解を発表しています。つまり、専門家の間でも、糖尿病の治療法としての糖質制限についてはかなりの議論があります。(読売新聞の記事に関しては294話参照)
この糖質制限食は糖尿病の領域で現在最もホットなテーマですが、その詳細はここでは省きます。糖質制限は糖尿病の治療として賛否両論があるという状態ですが、最近の傾向は糖質制限のメリットを認める専門家が増えているように思います。ただし、極端な糖質制限(1日40g以下)は糖尿病治療としては推奨されていません。(興味のあるかたはこのサイトへ)
がんの領域においては、極端な糖質制限の有効性が議論されています。カロリー制限ががん予防に効果があることが動物実験などで報告されています。カロリー制限の寿命延長効果が霊長類(アカゲザル)の実験で明らかになっていますので、カロリー制限はがんや老化性疾患の予防に有効だといえます。しかし、ここで議論しようとしている「がん治療における極端な糖質制限やケトン食(=低炭水化物+高脂肪食)についてはまだ賛否両論があります。脂肪や蛋白質の取り過ぎがかえってがんを促進するのではないかという懸念もあります。ケトン食では、糖尿病治療では推奨されない「極端な糖質制限」を行います。がんの予防のように長期的な効果を目標とする場合には、低炭水化物・高脂肪食はまだ十分な根拠はないかもしれません。しかし、今存在するがんを縮小させるという短期的な目的では、がん細胞のグルコースの利用をできるだけ絶つことを目標とする『極端な糖質制限』や『脂肪を多く摂取してケトン体を増やすケトン食』は、有効性を示唆する報告が最近増えてきています。
ここで、「炭水化物」と「糖質」の用語の使い分けを説明しておきます。炭水化物(carbohydrate)は単糖を構成成分とする有機化合物の総称で、代謝されてエネルギー源となる「糖質(saccharides)」と人の消化酵素で消化されない(したがって、エネルギー源にならない)食物繊維(dietary fiber)に分けられます。つまり、炭水化物は糖質と食物繊維から成ります。糖尿病食事療法において摂取制限の対象になるのは糖質であり、食物繊維はいくら摂取しても問題ありません。英語のlow-carbohydrate diet(低炭水化物食)は実質的には糖質制限食です。
【グルコースとインスリンを減らせばがん細胞の増殖は遅くなる】
前回の294話では、高血糖や高インスリン血症ががんを促進すること、がん細胞が正常細胞の何十倍も多くのグルコースを取り込んでいる理由を解説しました。
がん細胞はブドウ糖をエネルギー源として大量に取り込んでいるため、高血糖はがん細胞の増殖に有利になります。高血糖は活性酸素の産生を高め、血管内皮細胞や基底膜にダメージを与えて、血管透過性を高め、転移を起こしやくするという意見もあります。高血糖はマクロファージを活性化して炎症性サイトカインの産生を刺激します。炎症性サイトカインはがん細胞の増殖や浸潤を促進します。高インスリン血症は肝臓における性ホルモン結合グロブリンの産生を抑制するので、フリーのエストロゲンが血中に増えて、乳がん細胞の増殖を促進することも指摘されています。
また高血糖は免疫細胞へのビタミンCの取り込みを阻害します。ビタミンCとグルコースは似た構造をしています。そして細胞内へのビタミンCの取り込み(輸送)はグルコースの取り込みを担当するグルコース・トランスポーター(GLUT1)によって行われます。したがって、高血糖になるとビタミンCの細胞への取り込みが阻害されます。ビタミンCは免疫細胞の活性化や増殖に必要なため、高血糖のためにビタミンCの取り込みが低下すると免疫細胞の働きが低下します。つまり、高血糖はがん細胞に対する免疫力を低下させる原因となります。このように様々な理由で、高血糖や高インスリン血症は、がんの発生や再発のリスクを高め、がん細胞の増殖を促進することになるのです。
培養したがん細胞を使った実験で、培養液のグルコース濃度を高めると、がん細胞の増殖や転移や浸潤が促進されます。高濃度のグルコースがある状態で、インスリンを添加すると、増殖シグナル伝達系の刺激により、増殖や浸潤能はさらに促進されます。生体でも同様で、食事のたびに血糖やインスリンが上昇するとがん細胞の増殖が刺激されます。
逆に、グルコースの取り込みを阻害すれば、がん細胞は生存も増殖もできません。がん細胞はグルコースが枯渇すると比較的短時間で死滅します。ネズミにがんを移植した動物実験では、カロリー制限を行うと、腫瘍の増殖が抑制され、生存期間が延びることが報告されています。カロリー制限をしなくても、糖質を減らすだけで、がんの増殖を遅くできるという結果が得られています。カロリーを減らさずに糖質を減らすということは、脂肪の摂取量を増やすことになります。脂肪の摂取量を増やしても炭水化物の摂取量を減らすことの方ががん組織の増殖抑制に有効であることが多くの動物実験で明らかになっています。これは、脂肪が分解してできるケトン体は、正常細胞のエネルギーとして利用できますが、がん細胞はケトン体を利用できないということが一つの理由です。がん細胞の増殖を、糖質は促進しますが、脂肪は促進しないと言えます。
これは人体でも同じです。がん患者において、糖質制限によって血糖を低下させ、インスリンの分泌を抑制することは、それだけでがん細胞の増殖を抑制することができるのです。「甘いものはがんの栄養になる」と言われていますが、実際にグルコース、つまり砂糖の多いお菓子や食品を多く摂取することはがん細胞の増殖や転移を促進し、砂糖を多く使った食品の摂取を少なくするだけでがん細胞の増殖を抑える効果が得られます。一方脂肪は、炭水化物の摂取量が少なく、カロリーがオーバーしない条件であれば、がんを促進することはありません。
糖質を含む食事のたびに血糖が上がって、それを低下させるためにインスリンが分泌されている状態が、恒常的にがん細胞の成長を刺激していることになります。したがって、毎回の食事から糖質の摂取を減らしてインスリンの分泌を減らせば、がん細胞の増殖を抑えることができるのです。
【がん細胞の増殖・進展のカギを握るインスリン様成長因子】
インスリンは51個のアミノ酸からなるペプチドホルモンで、血糖値の上昇に応じて膵臓のランゲルハンス島のベータ細胞から分泌され、筋肉細胞へのブドウ糖の取り込みや、脂肪細胞での脂肪合成、肝臓におけるグリコーゲン合成を促進します。インスリン自体にがん細胞の増殖を促進する作用がありますが、さらに、インスリンはがん細胞の増殖を促進するインスリン様成長因子-1(IGF- 1)の活性を高める作用があります。高インスリン血症は、IGF-1の活性を制御しているIGF-1結合蛋白の産生量を減少させ、その結果、IGF-1の活性が高まるからです。大腸がん、前立腺がん、乳がんでは、インスリンの濃度が高く、IGF1結合蛋白が低いと予後が悪いという結果が報告されています。
体の成長を促進する成長ホルモンは肝臓に働きかけてIGF-1を分泌させ、IGF-1が標的組織の細胞分裂を刺激します。したがって、多くの臓器や組織の細胞にIGF-1の受容体があり、それらの細胞から発生するがん細胞の多くがIGF-1受容体をもち、IGF-1によって細胞分裂が促進されるため、がん細胞の増殖や転移を促進する作用があります。
IGF-1は70個のアミノ酸からなり、インスリンと似た構造をしています。IGF-1受容体とインスリン受容体も類似しており、IGF-1とインスリンが交差反応することが知られています。インスリンとIGF1はそれぞれの受容体に結合して細胞を刺激すると。増殖シグナルの経路(PI3K/Akt/mTOR/HIF-1α経路とRas/Raf/MAPK経路)を活性化して、細胞増殖や転移を促進し、抗がん剤抵抗性を高めます。高インスリン血症では、インスリンがIGF-1受容体に結合して、IGF-1と同じように細胞の増殖を促進します。
高齢者男性で、血中のIGF-1の濃度が高い人はがんを発生するリスクが高いという疫学研究の結果が米国から報告されています。この研究では、50歳以上の男性633人を対象に、IGF-1値を測定したのち18年間の追跡調査を行った結果、試験開始時にIGF-1値が100ng/mlを超えていた男性のがん死亡のリスクはIGF-1値が低かった男性のほぼ2倍であったということです。その他の研究でも、血清IGF-I濃度が高いほど、前立腺がん、乳がん、肺がん、大腸がん、膵臓がんのリスクが高くなることが示されています。
以上のことから、血中のインスリンやインスリン様増殖因子を高めなければ、がん細胞の増殖を抑制できることが理解できます。
【がん細胞にグルコールを与えない食事療法】
がん細胞にグルコースを与えないようにすれば良いので、断食療法やカロリー制限は効果がありますが、断食療法は体重が減少し栄養素が不足する欠点があり、カロリー制限も体重や体力を低下させる欠点があります。抗がん剤などで治療を行っているときには、断食やカロリー制限は実施しにくいと言わざるを得ません。
絶食と同じような効果があって体力も栄養状態も悪化させない食事療法として「ケトン食」があります。これは炭水化物(糖類)の摂取を極端に減らし、脂肪を多く摂取しケトン体を産生させるという食事で、てんかんの食事療法として確立されている食事法です。
ケトン体は、グルコースが枯渇したときに、肝臓で脂肪酸の分解が亢進したときにできる物質です。正常細胞では、ケトン体を使ってエネルギー(ATP)を産生することができるのですが、多くのがん細胞はケトン体を利用できません。そこで、がん細胞が利用できるグルコースの量を減らし、がん細胞が利用できないケトン体を利用してがん細胞を死滅させる食事療法としてケトン食が注目されています。このケトン食のとき、脂肪として中鎖脂肪酸やω3不飽和脂肪酸(DHAやEPA)を多く使い、タンパク源としてはがんを促進する赤身の肉(牛肉など)は控え、大豆製食品(豆腐や納豆)や魚や卵や鶏肉などを利用すれば、抗腫瘍効果が高まることが報告されています。
【ケトン体は脂肪酸や一部のアミノ酸が分解してできる】
通常、細胞に必要なエネルギー(ATP)は、グルコースが解糖系からピルビン酸を経てTCA回路(クエン酸回路)へと代謝され、さらに酸化的リン酸化によって産生されます。しかし、飢餓でグルコースが枯渇した場合や、糖尿病で細胞にグルコースが十分に取り込めない場合は、代わりに脂肪酸が分解されてATPを産生することになります。すなわち、脂肪酸が分解(β酸化)されてアセチルCoAになり、このアセチルCoAがミトコンドリアのTCA回路で代謝されてATPを作り出します。
肝細胞では、脂肪酸が分解されてできたアセチルCoAの一部はアセト酢酸、βヒドロキシ酪酸、アセトンに変換されます。これら3つをケトン体と言います。アセチルCoAがアセトアセチルCoAになり、3-ヒドロキシ-3-メチルグルタリル-CoA(HMG-CoA)を経てアセト酢酸が生成され、これは脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換されます。グルコースからの解糖系で産生されるアセチル-CoAは主としてTCA回路で代謝され、脂肪酸酸化で産生されたアセチル-CoAはケトン体産生の方に主に振り分けられる性質があり、脂肪酸の異化が亢進して脂肪酸由来のアセチル-CoAの産生が多くなるとケトン体産生が増えます。
脂肪酸と違ってケトン体は水溶性であるため、特別な運搬蛋白質の助けがなくても肝臓からその他の臓器(心臓や筋肉や腎臓や脳など)に運ばれ、細胞内でケトン体は再びアセチル-CoAに戻され、TCA回路で代謝されてエネルギー源となります。この際、エネルギー産生に使われるのはアセト酢酸のみで、βヒドロキシ酪酸はアセト酢酸に変換されて初めてエネルギー代謝に使用され、アセトンはエネルギー源にはなりません。
飢餓時やインスリン欠乏による糖尿病などでグルコースが利用できない場合、ケトン体が重要なエネルギー源となります。脂肪酸は血液脳関門を通過できませんが、ケトン体は通過できるので、グルコースが利用できない場合の脳の唯一の代替エネルギーとなっています。
ケトン体は一部のアミノ酸からも産生されます。蛋白質はアミノ酸に分解されてから代謝されますが、アミノ酸ごとに代謝経路が異なります。アミノ酸のうち、脱アミノを受けたのち、その炭素骨格部分が脂質代謝経路に由来して、主として脂肪酸やケトン体合成に利用されるものをケト原性アミノ酸(ketogenic amino acid)と呼び、一方、TCAサイクルに入って糖産生に利用されるものを糖原性アミノ酸(glucogenic amino acid)と呼びます。詳しいことは省略しますが、アミノ酸は細胞内で蛋白合成の材料としてだけでなく、グルコースや脂肪酸が不足してエネルギー源がなくなると、蛋白質もアミノ酸に分解され、グルコースやケトン体に変換されてエネルギー産生に利用されるということです。蛋白質も多くとり過ぎると、肝臓における糖新生でグルコースが作られるので、糖新生を阻害するとケトン食の効果を高めることができます。肝臓での糖新生を阻害する薬として糖尿病治療薬のメトホルミンがあります。ケトン食とメトホルミンの併用によるがん治療の可能性が指摘されています。
【ケトン食はてんかんの治療法として開発された】
「ケトン食」というのは、体内でケトン体が多く産生されるように考案された食事です。古来、さまざまな疾患に絶食療法が行われており、特にてんかん発作が絶食によって減少することは古くから知られていました。そして、「脂肪を多く炭水化物の少ない食事をと摂れば、絶食と同等の効果が得られる」という考えのもとに、1920年代にメイヨークリニックのRussel Wilderがケトン食療法(ketogenic diet)を発案しました。この当時のケトン食は「古典的ケトン食」と呼ばれ、蛋白質を体重1kg当たり1g、炭水化物は1日10~15g、残りのカロリー(90%以上)は脂肪からというものでした。てんかんに対するケトン食療法の有効性は証明されていたのですが、1938年に抗てんかん薬としてフェニトインが開発され、てんかんの治療は食事療法から薬物療法に移行し、ケトン食療法はすたれていきました。1960年代には、中鎖脂肪酸トリグルセリド(medium-chain triglycerides:中鎖中性脂肪 )を使うとケトン体の産生効率が高いことが明らかになり、脂肪の摂取割合を50%程度まで減らし、蛋白や炭水化物の摂取量の許容範囲で高くなったので、ケトン食療法は見直されました。しかしその後もてんかんの治療薬がいくつも開発され、面倒な食事療法より薬物治療の法が便利で有効性が高いということでケトン食療法は次第に行われなくなりました。
しかし、1994年、ハリウッドのプロデューサーのジム・アブラハムス(Jim Abrahams)が自分の息子の難治性のてんかんがケトン食療法で劇的に改善した実話をテレビで放映し、その後、ケトン食療法を広めるための基金(the Charlie Foundation)を設立、さらにこの話は1997年にはメリル・ストリープ(Meryl Streep)が主演でテレビ映画化(First do no harm)され、難治性てんかんに対するケトン食療法の有用性が広く世界に知られるようになりました。ケトン食はグルコースを細胞内に取り込めないグルコース・トランスポーター(glucose transporter:GLUT)1型欠損症に極めて有効で、唯一の治療法としても利用されています。さらに、ケトン体は脳神経のエネルギー代謝を改善し、活性酸素や炎症から神経細胞を保護する作用があるので、ケトン食にアルツハイマー病やパーキンソン病や脳卒中等を原因とする脳神経細胞障害の進行抑制にも利用されています。
【ケトン食の抗がん作用】
がん細胞ではケトン体をエネルギーとして使うための酵素の活性が低下している特徴があります。したがって、糖質を極端に制限したケトン食療法を行えば、グルコースが枯渇してがん細胞は弱り、正常細胞はケトン体を利用して活動を続けることができます。また、ケトン体のβヒドロキシ酪酸にはそれ自体に抗がん作用があることが知られています。培養がん細胞を使った実験で、培養液にβヒドロキシ酪酸を添加すると用量依存的にがん細胞の増殖が抑制されることが報告されています。ケトン体はがん細胞のグルコースの取り込みと代謝を阻害する作用が知られています。
近年、がん治療において、ワールブルグ効果をターゲットにした治療法の有効性が確認されるようになり、がんに対するケトン食療法が注目されるようになりました。がんを移植したネズミを使った実験では、ケトン食ががんの増殖速度を遅くし、生存期間を延ばす効果があることが報告されています。この場合、カロリー制限を併用すると抗腫瘍効果が高いのですが、中鎖脂肪酸を多く使いケトン体の産生を増やすケトン食であれば、カロリー制限をしなくても、がん組織の増殖を抑え、生存期間を延ばすことが確認されています。
人間でも、脳腫瘍などの悪性腫瘍の治療におけるケトン食の有効性が報告されています。ケトン食によるがん治療の有効性が最初に報告されたのは1995年のことです。米国のオハイオ州クリーブランドのCase Western Reserve Universityの栄養部門(Nutrition Department)からの報告で、進行した小児がん(脳腫瘍)の患者をケトン食を使って治療し、全身の栄養状態に悪影響を及ぼさずにがん細胞の増殖を抑えることができたという臨床試験の結果を報告しています。
Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports.
J Am Coll Nutr 14(2): 202-8. 1995
この報告では、進行した脳腫瘍(Malignant Astrocytoma 悪性星細胞腫)の女児2名を、中鎖脂肪酸トリグリセリドを60%、他の脂肪10%、蛋白質20%、炭水化物10%、というケトン食を使って、8週間外来通院で治療を行っています。ケトン食を開始して7日後には血糖値は正常下限まで低下し、血中ケトン体は20~30倍に増加しました。PET検査の測定では、グルコースの取り込みは平均21.8%低下しました。患者の一人は、臨床症状の著明な改善を認めた。その後もケトン食を継続しており、10年以上腫瘍の進行を認めていないと報告されています。
末期がんの患者に対するケトン食の効果と安全性を検討した報告もあります。この報告では炭水化物を1日70g以下に抑えたケトン食で治療し、脂肪と蛋白質が豊富で炭水化物を制限した食事は、臓器の働きを良くし、症状を改善する効果があるという結果が得られています。がん細胞はグルコースの利用が高いのですが、筋肉組織など正常組織では脂肪酸や蛋白質の需要が大きいので、炭水化物を少なくし、蛋白質や脂肪の多い食事の方が、進行がん患者の状態を良くする効果が高いという結果が報告されています。
がんの食事療法の定番の「玄米菜食」や「ゲルソン療法」などは、玄米や雑穀や野菜が豊富で、動物性食品を減らすことが基本になっています。玄米や雑穀などグリセミック指数が低い炭水化物はインスリンの分泌を抑えるという観点からはがん細胞の増殖を促進しない効果はあります。このような食事は健康的であり、がんの予防には向いているように思います。しかし、現在存在しているがん組織を縮小させる効果は弱いと思います。それは、がん細胞が必要とするエネルギーと物質合成の材料であるグルコースが豊富に供給されているからです。今あるがん細胞を死滅させるためには、炭水化物を減らすことが基本であり、低炭水化物・高脂肪食のケトン食の方が抗がん作用は強いと言えます。(具体的方法に関しては次回)
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
画像をクリックするとサイトに移行します。
| « 294)糖と脂肪... | 296)糖と脂肪... » |





