図:神経障害や炎症などによって発生した痛み刺激は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され、さらに脳幹、中脳、視床を経て大脳皮質に達して痛みとして認知される。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節している(下行性疼痛抑制系)。オピオイド系鎮痛薬が作用するμオピオイド受容体やカンナビノイド(アナンダミドやテトラヒドロカンナビノールなど)が作用するCB1受容体は感覚神経終末や脊髄後角や下降性疼痛抑制系のシナプスにおける神経伝達物質の放出を抑制する作用機序で鎮痛作用を発揮する。
【モルヒネは長期使用で耐性ができる】
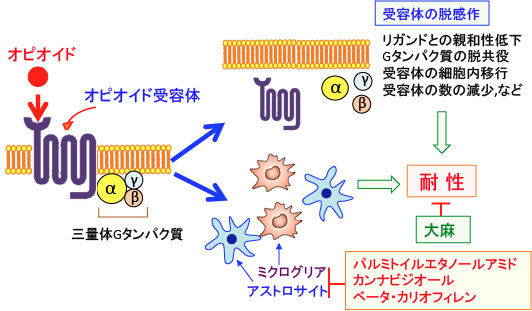
モルヒネおよびその他のオピオイド系鎮痛薬はμオピオイド受容体に作用して鎮痛、傾眠、呼吸抑制、消化管運動抑制、自律神経系変化などの薬理作用を発現しますが、モルヒネを長期に使用すると次第に作用の低下が起こり、同じ効果を得るのにより多くの服用が必要になってきます。このような現象を耐性(tolerance)と言います。
薬物耐性のメカニズムの一つは、薬剤を反復使用しているうちにその薬物の薬物代謝系が賦活されて、分解が促進するので、服用量を増やさないと同じ効果が得られないという作用機序です。
さらに、受容体作動薬の場合は、受容体機能の変化による感受性低下(脱感作)によって耐性が生じることが知られています。
特にGタンパク質共役型受容体ファミリーの場合については、受容体のリガンド(作動薬)に対する親和性の低下、受容体とGタンパク質の脱共役、受容体の細胞内移行による細胞表面からの受容体の消失、受容体の数の減少などが耐性発現に関与しています。
さらに、最近の研究では、オピオイドの長期使用によって中脳水道周囲灰白質領域や脊髄後角のミクログリアやアストロサイトの活性化などによって、疼痛抑制系が抑制される結果、オピオイドの鎮痛効果が減弱するという報告があります。
例えば、モルヒネの慢性投与によって中脳水道周囲灰白質領域においてミクログリアの活性化が観察され、ミクログリアの活性を阻害する薬を投与するとモルヒネ耐性が抑制されるという報告があります。
モルヒネ耐性によって必要な鎮痛効果を得るためにモルヒネの服用量が増えると、次第に依存性(dependence)を引き起こし、さらに服用量が増えるという悪循環を形成します。
モルヒネには延髄の呼吸中枢に作用して呼吸抑制を引き起こす副作用があり、これがモルヒネなどのオピオイド系鎮痛薬による死亡の原因になっています。
がん以外の慢性疼痛に対するオピオイドの処方が増えている米国では、薬剤の過剰投与による死亡で最も多いのがオピオイド系鎮痛薬です。
米国では、オピオイド系鎮痛薬の過剰投与による死亡が、1999年には4400人、2010年には16,000人という統計が報告されています。
薬物は、効果を発揮する用量(薬効量)と死亡する用量(致死量)の差が大きいほど安全性が高いと言えます。
例えば、アルコールは普通に酔う量が33g(22~40g)で、致死量が330g(276~455g)というデータがあります。この場合、致死量と薬効量の比率は10になります。
このような致死量:薬効量の比率はヘロインが6、コカインやモルヒネは15、ニコチンが50、カフェインが100、大麻(マリファナ)は1000以上、と考えられています。
つまり、モルヒネは安全域が狭いので、耐性や依存によって服用量が過剰になると、死亡の原因になりやすいと言えます。大麻やテトラヒドロカンナビノール(THC)は呼吸中枢に作用しないので呼吸抑制作用が無いことが、安全性が高い理由になっています。
同じような鎮痛効果がある医療大麻が認可されている米国の州では、オピオイド系鎮痛薬による死亡数が減っているという報告があります。大麻の安全域は極めて広いので、大麻で死亡することは無いためです。
【パルミトイルエタノールアミドはモルヒネ耐性を抑制する】
前述のように、モルヒネの反復使用が脊髄後角のミクログリアやアストロサイトの活性化を引き起こして、疼痛抑制系が抑制される結果、オピオイドの鎮痛効果が減弱するという機序が報告されています。
パルミトイルエタノールアミドはミクログリアやアストロサイトの活性化を抑制する作用があります(
442話参照)。したがって、パルミトイルエタノールアミドがモルヒネ耐性を軽減する可能性が示唆されます。最近、以下のような論文があります。
Delay of morphine tolerance by palmitoylethanolamide.(パルミトイルエタノールアミドによるモルヒネ耐性の遅延)Biomed Res Int. 2015;2015:894732. doi: 10.1155/2015/894732. Epub 2015 Mar 22.
【要旨】
モルヒネの鎮痛作用は強力ではあるが、長期に使用していると鎮痛作用に対する耐性ができるので、慢性疼痛に対する臨床使用には限界がある。
モルヒネ耐性のメカニズムは複雑でまだ十分に解明されていない。最近の研究で、モルヒネ耐性の発生に、グリア細胞の活性化とグリア細胞由来の炎症性メディエーターの産生が関与していることが報告されている。
パルミトイルエタノールアミドは鎮痛作用を持つ体内物質で、グリア細胞の活性化を抑制する作用が知られている。
本研究では、1日体重1kg当たり10mgのモルヒネを腹腔内投与したラットに、パルミトイルエタノールアミド(体重1kg当たり30mg/日、皮下投与)を投与した。
パルミトイルエタノールアミドの投与は、モルヒネ耐性の発生を顕著に抑制し、耐性が発生するまでの日数を2倍に延長した。
モルヒネ投与よって誘導される脊髄後角におけるミクログリアとアストロサイトの数の増加をパルミトイルエタノールアミドは抑制した。しかし、脊髄のTNF-αの増加は抑制されなかった。免疫染色の結果では、パルミトイルエタノールアミドを投与したラットのアストロサイトではTNF-αの量の増加を認めたので、パルミトイルエタノールアミドはアストロサイトからの炎症性サイトカインの放出を抑制する作用が示唆された。
以上の結果から、パルミトイルエタノールアミドはモルヒネの抗侵害受容効果を減弱させる神経系の変化に影響して、モルヒネ耐性の発現を抑制する作用があり、オピオイドを使った治療にこの内因性物質を利用する有用性が示唆された。
パルミトイルエタノールアミドには肥満細胞からの脱顆粒を阻止する作用があります(
440話参照)。同様にミクログリアやアストロサイトの活性化や炎症性メディエーターの放出を抑制してモルヒネ耐性を抑制するという結果です。
【カンナビジオールはミクログリアの活性化を抑制する】
ミクログリアの活性化はモルヒネ耐性だけでなく、様々な精神疾患の発症にも関与しています。大麻成分のカンナビジオールがミクログリアの活性化を抑制するという報告があります。
Decreased glial reactivity could be involved in the antipsychotic-like effect of cannabidiol.(グリア細胞の活性抑制がカンナビジオールの抗精神病作用に関与している)Schizophr Res. 164(1-3):155-63. 2015年
【要旨の抜粋】
NMDA(N-methyl-D-aspartate;N-メチル-D-アスパラギン酸)型受容体の活性低下が、統合失調症患者にみられる認知機能障害などの様々な症状の発現に関与していることが指摘されている。
統合失調症と神経組織の炎症の関連性が多くの研究によって示されており、ミクログリアやアストロサイトのようなグリア細胞が統合失調症の発症に関連している可能性が示唆されている。
大麻に含まれる精神作用のないカンナビノイドの代表であるカンナビジオールは抗炎症作用と神経細胞保護作用を有し、抗精神病作用を示すことが知られている。
本研究では、NMDA型受容体の阻害剤のMK-801を28日間投与してNMDA受容体の機能を阻害した統合失調症の動物実験モデルを用いて、カンナビジオール(30mgと60mg/kg)の投与による効果を検討した。
NMDA阻害薬のMK-801の長期間の投与は、社会的行動試験(social interaction test)と新奇物体認識試験(Novel object recognition test)による評価で、マウスの社会的行動と新私意物体への探索行動を障害した。
MK-801の長期投与は、前頭前皮質内側部(medial prefrontal cortex)におけるアストロサイトの数を増やし、前頭前皮質内側部と背側海馬(dorsal hippocampus)におけるミクログリアの活性化(ミクログリアの数は不変で活性化したミクログリアの割合の増加)が認められた。神経細胞の数には変化が見られなかった。
このようなMK-801投与による行動障害と病理学的なグリア細胞の変化は、カンナビジオールおよびクロザピン(clozapine:非定型抗精神病薬で治療抵抗性の統合失調症の治療薬)によって抑制された。
このような実験結果から、カンナビジオールは精神病治療薬としての効果を有していることが示された。この効果の作用メカニズムはまだ十分に解明されていないが、カンナビジオールの抗炎症作用と神経細胞保護作用が関与している可能性があり、ミクログリアの活性化の阻害が統合失調症の症状の改善に寄与している可能性が示唆された。
以上のように、パルミトイルエタノールアミドとカンナビジオールはミクログリアやアストロサイトの活性を抑制するので、モルヒネ耐性の予防や神経変性疾患の治療に役立つ可能性があります。さらにCB2受容体の選択的アゴニストであるβカリオフィレンの併用も相乗効果が期待できます。これらはオピオイド系鎮痛薬との併用は問題ないので、試してみる価値はあります。
● パルミトイルエタノールアミドについては
こちらのサイトで紹介しています。